Введение. Аденома предстательной железы (АПЖ) является частым заболеванием среди мужчин пожилого и старческого возраста. Заболевание с годами прогрессирует, о чем убедительно свидетельствуют материалы многих исследований [1]. По оценкам отечественных и зарубежных авторов [2, 3], у современного мужчины, сумевшего прожить до старости, в течение жизни риск АПЖ с
клиническими проявлениями заболевания составляет 85%, а частота обнаружения АПЖ на аутопсии
достигает 95%. Активное применение консервативных методов лечения больных АПЖ, в том
числе α-адреноблокаторов, приводит к постепенному увеличению доли больных с большими (более
80 см3) размерами предстательной железы [4]. Несмотря на возможности консервативной терапии, радикальным методом лечения АПЖ по-прежнему остается только оперативный [2] как наиболее эффективный и рациональный. Урологи могут и должны подходить к выбору способа аденомэктомии дифференцированно. Среди трех основных видов оперативных вмешательств на аденоматозно
измененной предстательной железе (чреспузырная и позадилонная аденомэктомия и трансуретральная резекция) по своей технической простоте, органосохраняющему характеру, травматичности, объему как интра-, так и послеоперационной кровопотери, а также по продолжительности периода послеоперационной реабилитации и количеству послеоперационных осложнений на первое место вышла радикальная органосохраняющая экстрауретральная аденомэктомия (ЭУА) [5], как чреспузырная, так и позадилонная.
Экстрауретральная аденомэктомия многократно и подробно описана в отечественной литературе
[5–10, 13]. Характер вмешательства в каждом конкретном случае определяется с учетом анатомических и функциональных изменений почек, верхних мочевыводящих путей, мочевого пузыря, предстательной железы и общего состояния больного. В выборе метода аденомэктомии мы стремимся к оптимально возможному объему оперативного лечения индивидуально для каждого пациента.
Материалы и методы. С 1973 по 2010 г. в урологических отделениях ГВКГ им. Н. Н. Бурденко и
2-го ЦВКГ им. П. В. Мандрыки выполнено более 3000 ЭУА. Многостороннему анализу подвергнуты
результаты лечения 2570 больных АПЖ. Одноэтапная аденомэктомия выполнена 2250 (87,54%) мужчинам, двухэтапная – 320 (12,46%). Экстрауретральная аденомэктомия выполнена 2133 (82,99%) больным, аденомэктомия по методике Федорова–Фрейера – 437 (17,01%). Из числа оперированных умерли 28 (1,08%), из них после экстрауретральной аденомэктомии – 19 (0,89%) больных. Вторая стадия аденомы предстательной железы была у 1117 оперированных больных, III – у 1426 и IV – у 27. Большинство радикально оперированных больных были в возрасте от 65 до 75 лет – 1358 (52,84%), 912 (35,48%) пациентов были старческого возраста.
Сопутствующие урологические заболевания имели 2319 больных АПЖ: хронический пиелонефрит – 1045 (40,66%), хронический простатит – 1376 (53,54%), из них у 438 (18,88%) больных в стадии обострения, в том числе у 112 – гнойный простатит, у 21 – абсцесс простаты, подтвержденные
гистологически. Камни мочевого пузыря имели 345 больных. У 39 больных аденомэктомия сочеталась с
уретеролитотомией и у 27 – с иссечением дивертикулов мочевого пузыря. У 72 больных аденомэктомии предшествовала резекция мочевого пузыря по поводу рака (32) и папиллярных доброкачественных
опухолей (40) слизистой.
Отличительными особенностями ЭУА от аналогов (операция Федорова–Фрейера) [11, 12] чреспузырного удаления аденоматозных тканей из простаты являются полуовальный или клиновидный разрез по задней полуокружности шейки мочевого пузыря, фрагментарное удаление гиперплазированных тканей, полное сохранение простаты и предстательного отдела уретры. Отсечение аденоматозных тканей вместе с патологически измененной частью задней полуокружности проксимального отдела предстательной части уретры позволяет выполнять коррекцию тканей и реабилитировать пузырно-уретральный сегмент. При отсечении аденоматозных тканей вместе с патологически измененной частью задней полуокружности проксимального отдела предстательной части уретры удается выполнять коррекцию тканей и реабилитировать пузырно-уретральный
сегмент. Техника вмешательства предусматривает воссоздание полной непрерывности между мочепузырным треугольником Льето и мочеиспускательным каналом, сохранение замыкательного аппарата (внутреннего сфинктера) мочевого пузыря. При этом в ходе коррекции пузырно-уретрального сегмента обеспечивается полный гемостаз [5, 13] (рис. 1–3).
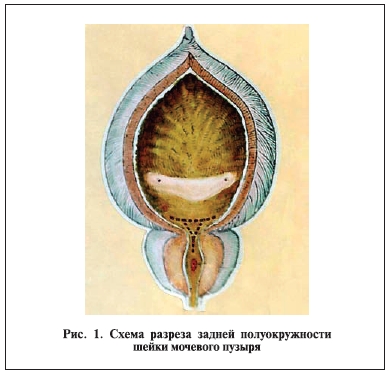
Пластика пузырно-уретрального сегмента проводится путем наложения швов в поперечно-переднем направлении. При этом, отступя 0,5–1,0 см от правого или левого угла раны, из полости ложа прошивают хирургическую капсулу, выкалывая иглу на слизистую, и той же иглой с нитью прокалывают слизистую, подслизистый и мышечный слои противоположного края раны с выходом в ложе аденомы. Петлю прошивной нити смещают за угол разреза, а концы ее связывают, образуя “погружной” шов. После наложения первого шва кровотечение резко уменьшается. Второй узловой шов с прошиванием всех слоев стенки мочевого пузыря и стенки уретры накладывается, отступя от первого с интервалом приблизительно в 1 см и на аналогичное расстояние от края раны. Достаточно двух швов справа от уретры, в которой находится катетер, и двух швов слева, чтобы ушить рану и восстановить целостность пузырноуретрального сегмента, обеспечив полный гемостаз. При больших размерах аденом (более 100 см3) и выраженных рубцово-склеротических изменениях в простате и тканях пузырно-уретрального сегмента количество швов может быть увеличено до четырех как справа, так и слева. Швы на рану пузырно-уретрального сегмента могут накладываться в виде как
отдельных узловых, так и непрерывного погружного узлового шва.
Рисунок 2. Этапы операции ЭУА.
Оптимальные условия для фрагментарного удаления аденоматозных тканей и формирования входа
во внутреннее отверстие уретры достигаются при наличии катетера в просвете мочеиспускательного
канала.
После сшивания нижнего края треугольника мочевого пузыря с боковой стенкой уретры сохраняется дефект треугольной формы размером до 1 см3, через который полость ложа аденомы сообщается с
просветом мочеиспускательного канала и полостью мочевого пузыря. В ближайшем послеоперационном периоде ложе аденомы сокращается, а раневое отделяемое из ложа самопроизвольно эвакуируется в мочевой пузырь и затем удаляется вместе с промывной жидкостью. Создаются условия для восстановления анатомической и функциональной активности сдавленной аденоматозными образованиями паренхимы простаты.
Чреспузырная ЭУА заканчивается ушиванием раны передней стенки мочевого пузыря, как правило, однорядным непрерывным узловым или отдельными узловыми швами наглухо, герметично с использованием рассасывающегося шовного материала. До ушивания раны мочевого пузыря выше ее
поперечного разреза через прокол в его полость вводится дренажная трубка, которая фиксируется прошивной (кетгутовой) лигатурой. Дистальный конец трубки, оставляемый в мочевом пузыре, не должен превышать 2–3 см.
Результаты. У 411 (15,99%) больных возникли послеоперационные осложнения, в том числе: раннее
и позднее кровотечение из сосудов шейки мочевого пузыря и ложа аденомы – 32 (1,24%), острая сердечно-сосудистая недостаточность – 66 (2,57%), тромбоэмболия легочной артерии – 10 (0,39%) инфаркт миокарда – 12 (0,47%), пневмония – 4 (0,16%), тромбофлебит нижних конечностей – 5 (0,14%), острый эпидидимоорхит – 67 (2,6%), обострение хронического пиелонефрита – 54 (2,1%).
Причиной летальности после аденомэктомии послужили острая сердечно-сосудистая недостаточность
(7 больных), острый пиелонефрит и почечная недостаточность (9), тромбоэмболия легочной артерии
(5), желудочно-кишечное кровотечение (4), внутрипузырное кровотечение (1), уросепсис (2).
В отдаленном послеоперационном периоде рецидив АПЖ наблюдался у 18 больных, оперированных
более 5 лет назад. Пять больных, перенесших аденомэктомию по эндоуретральной методике, имели
частичное недержание мочи, и семерым выполнена операция ТУР в связи с рубцовой деформацией
шейки мочевого пузыря. В отдаленном послеоперационном периоде у больных, перенесших ЭУА,
стриктура уретры и недержание мочи не наблюдалось.
Обсуждение. Методика ЭУА изначально рассчитана на минимальную травму и коррекцию пузырно-
уретрального сегмента, чем достигается и минимальная кровопотеря. Нет необходимости применять
многочисленные модификации кровоостанавливающих съемных лигатур, накладываемых на обор-
ванную “ни в чем не повинную” нижнюю часть мочевого пузыря.
При выполнении ЭУА важно помнить, что аденома всегда имеет свою фиброзную капсулу разной
плотности, образованную стромальной фиброзной тканью. Если фиброзная капсула развита слабо, она
сравнительно легко рвется кончиком пальца. Однако в большинстве случаев бранши ножниц вводят в
простату через разрез в шейке и, встретив аденоматозную ткань, рассекают ее, облегчив расчленение и вылущивание узлов. Аденомы, располагающиеся вблизи мочеиспускательного канала, часто плотно сращены с последним, и тогда насильственное выделение аденом приводит к повреждению уретры.
В зависимости от изменений предстательного отдела уретры и шейки мочевого пузыря во время аденомэктомии возможны их повреждения. Повреждения задней стенки уретры встречаются в тех случаях, когда она резко истончена, а хирург первоначально выделяет тупым путем истонченную заднюю стенку уретры. Это повреждение не должно огорчать оперирующего хирурга, так как в некоторых случаях такого повреждения избежать невозможно из-за выраженного изменения тканей.
Ушивание хирургической раны в области пузырно-уретрального сегмента является основным способом
остановки кровотечения и реабилитации больного в послеоперационном периоде.
Преимущество чреспузырной ЭУА перед известной эндоуретральной методикой Федорова–Фрейера состоит прежде всего в том, что не обрывается и не обрезается шейка мочевого пузыря, сохраняются пузырно-уретральный сегмент и предстательный отдел мочеиспускательного канала, в результате чего удается избегать повреждения трех зон сосудов: сосудистого сплетения, окружающего уретру; капсулярного сплетения; сосудистой зоны между капсулярными и уретральными сплетениями. Этим обусловливается минимальная травма и минимальная кровопотеря во время операции, как правило не требующая ее возмещения [5, 13].
Гемостаз при экстрауретральном способе удаления аденомы простаты достигается общепринятым ушиванием раны задней полуокружности пузырно-уретрального сегмента.
Сравнительно малая интраоперационная травматичность и сохранение целостности передней
полуокружности и боковых поверхностей пузырноуретрального сегмента обеспечивают раннюю реабилитацию поврежденных тканей и служат профилактикой стриктуры уретры, контрактуры шейки
мочевого пузыря и недержания мочи в ближайшем и отдаленном послеоперационном периоде.
Чреспузырную ЭУА следует доверять тому врачу, который в совершенстве знает анатомию предстательной железы, шейки мочевого пузыря, предстательного отдела мочеиспускательного канала, имеет общехирургические навыки выполнения оперативных вмешательств на органах брюшной полости и таза.
Заключение. Таким образом ЭУА существенно отличается от принятой в мире операции Федорова–
Фрейера. Вместо циркулярного отсечения шейки мочевого пузыря выполняется только полуовальный
или клиновидный разрез по задней полуокружности шейки мочевого пузыря. Во время удаления аденомы сохраняется предстательный отдел уретры, не повреждается уретральное сосудистое сплетение, сохраняется замыкательный аппарат мочевого пузыря, не повреждается и произвольный сфинктер уретры, что служит профилактикой недержания мочи в послеоперационном периоде. Минимальное повреждение мочевого пузыря и пузырно-уретрального сегмента, радикальное удаление аденоматозных тканей позволяют сохранить анатомическую и функциональную активность предстательной железы, что соответствует современным требованиям в хирургии лечения больных АПЖ.



