Введение. Микозы являются одним из самых серьезных, хотя и не самых частых, инфекционных
осложнений после трансплантации почки. Частота инвазивных грибковых инфекций у реципиентов
солидных органов составляет от 5 до 20% [1, 2]. Среди всех больных с пересаженными органами у
реципиентов почечного трансплантата системные микозы встречаются реже всего – с частотой около
5% [3]. Развитие системного микоза у реципиента почечного трансплантата повышает риск смерти в 15 раз. Факторами риска для всех системных микозов являются ЦМВ-болезнь, хроническое заболевание
печени, гипергликемия, сопутствующий туберкулез, продолжительная госпитализация, длительная антибактериальная терапия и посттрансплантационный сахарный диабет [4].
В патогенезе грибковых инфекций огромную роль играет ЦМВ-инфекция, которая вызывает иммуносупрессию и является своего рода “пусковым механизмом” тяжелых оппортунистических инфекций – бактериальных, грибковых, микобактериальных [5]. При глубоких оппортунистических микозах, развивающихся в условиях иммунодефицита, поражаются внутренние органы и глубоколежащие ткани. Наиболее часто возбудителями системных микозов у больных после трансплантации почки являются Candida spp. (до 80%) и Aspergillus spp. (до 60%), существенное значение имеет также Cryptococcus spp. [6, 7]. Иногда у реципиентов почки после трансплантации развиваются более редкие грибковые заболевания – зигомикоз (в том числе мукороз), моноспоридиоз, сцедоспориоз, феогифомикоз и др. [8]. При развитии системных микозов после трансплантации почки легкие вовлекаются практически всегда. Пусковым механизмом развития грибкового поражения легких является вирусная инфекция – чаще всего ЦМВ-инфекция, вызывающая дополнительную системную иммуносупрессию [9].
Особой проблемой для реципиентов ренальных трансплантатов является кандидурия, поскольку это
состояние может осложняться восходящим грибковым поражением мочевыводящих путей, обструкцией грибковыми сгустками и диссеминацией инфекции. В одном из наиболее крупных исследований
микозов, развивающихся после трансплантации почки, кумулятивная частота системных грибковых
инфекций составила 6,6%, при этом ведущим возбудителем оказался Aspergillus spp. [10].
В своей монографии, посвященной трансплантации почки, которая является общепризнанной
в мире, G. Danovitch указывает, что микозы подлежат интенсивному лечению полиенами – амфотерицином B, его липидными формами. Полиены обладают наиболее широким среди антимикотиков спектром активности. Амфотерицин B традиционно является препаратом выбора при лечении системных грибковых заболеваний, включая кандидоз, аспергиллез, криптококкоз, мукороз,
кокцидоидомикоз [11].
Несмотря на то что за последние 10 лет появились новые антифунгальные препараты – класс эхинокандинов, амфотерицин В и его липидные формы не утратили своего значения и широко применяются в современной антифунгальной терапии.
Цель настоящей работы: анализ клинического течения и эффективности терапии инвазивных
микозов у больных в раннем периоде после пересадки почки.
Материалы и методы. В центре трансплантации и диализа ГУ МОНИКИ с 2005 по 2011 г. выполнено
210 пересадок почки 204 больным (122 мужчины и 86 женщин). Щести больным трансплантация почки
выполнена дважды. Средний возраст больных на момент трансплантации почки составил 38,5±11 лет.
Причины ХБП V стадии: хронический гломерулонефрит – 127 (62,2%) больных, аномалии развития
почек и мочевыводящих путей – 22 (17,3%), поликистоз почек — 16 (7,8%), тубулоинтерстициальный
нефрит – 10 (4,9%), синдром Альпорта – 4 (2%), опухоли мочевыделительной системы – 3 (1,5%),
другие заболевания – 5 (2,5%). До трансплантации почки 131 (64,2%) больной находился на лечении
регулярным гемодиализом, 57 (27,9%) больным проводился перитонеальный диализ, 13 (6,4%) – перитонеальный диализ, а затем гемодиализ, 3 (1,5%) больным была выполнена додиализная трансплантация почки. Медиана срока наблюдения после трансплантации составила 30,9 (0–185,8) мес.
Все больные после трансплантации почки получили 3-компонентную базисную иммуносупрессивную
терапию, включившую ингибитор кальцинейрина: такролимус по 0,17 мг/кг/сут или циклоспорин А
(ЦсА) по 150 мг/сут под контролем концентрации препарата в крови, микофинолаты в стандартной
начальной дозе, преднизолон в стартовой дозе 0,5 мг/кг с постепенным ее снижением. В качестве
индукции перед трансплантацией почки вводили моноклональные антитела: базиликсимаб или
даклизумаб по стандартному протоколу. В 4 случаях стероидрезистентных кризов применялись препараты антилимфоцитарных антител (АТГ или антилимфолин, ОКТ3), в 2 – в сочетании с плазмаферезом.
Верификация микозов была основана на выявлении или выделении грибов из материала, полученного из крови, бронхоальвеолярного лаважа (БАЛ), мочи, плевральной и асцитической жидкости. Известную диагностическую роль играло определение антигенов – манана при инфекции грибами рода Candida spp. или галактоманнана при инфекции Aspergillus spp., глюкуроксиломаннана (Cryptococcus spp.).
При выявлении дрожжеподобных грибов в моче, аспергиллезе пациентам назначали противогрибковые препараты: амфотерицин В, липидный комплекс амфотерицина В-ABLC (амфолип, BSV), флюконазол 150 мг/сут, вориконазол (вифенд, “Пфайзер”). Амфотерицин В вводили внутривенно
в дозе 0,75–1 мг/кг/сут. В случаях развития пирогенных реакций, нефротоксичности амфотерицин В
заменяли на ABLC, который вводили в дозе 2–5 мг/кг/сут. Коррекции дозы ингибиторов кальцинейрина при этом не требовалось. Для поддерживающей терапии назначен флуконазол. При назначении вориконазола в дозе 200–400 мг/сут в течение 2 мес. требовалась коррекция дозы прографа
или ЦсА. При пневмониях, обусловленных микстинфекцией, одновременно проведено лечение антимикотиками и антибиотиками широкого спектра действия, при микробиологической идентифика-
ции возбудителя – с учетом его чувствительности к антибиотикам.
Всем больным пневмонией снизили дозу микофинолатов, а при развитии лейкопении микофенолаты
отменили полностью. Дозу ингибиторов кальцинейрина корригировали по концентрации в крови. Дозу
кортикостероидов не снижали.
Пациенты с бактериальной пневмонией при поступлении получили эмпирически цефалоспорины
III поколения и профилактические дозы противогрибковых препаратов – амфолип 2 мг/кг, флюконазол.
Больные пневмонией, обусловленной микстинфекцией, получали ганцикловир, антибиотики
широкого спектра действия, противогрибковые препараты – амфотерицин В, флюконазол.
Статистическая обработка данных. Показатели, подчиняющиеся нормальному распределению,
представлены в виде М±SD (среднее значение ± стандартное отклонение); показатели с распределением, отличающимся от нормального, описывали при помощи медианы и диапазона колебаний; качественные показатели – в долях (процентах) либо в абсолютных значениях. В качестве критического уровня достоверности различий в сравнениях групп был принят уровень 0,05.
Результаты. Изолированной нозокомиальной грибковой инфекции не наблюдалось ни у одного
больного. В процессе наблюдения у 40 (19,6 %) из 204 больных зарегистрирована грибковая инфекция. Легочные проявления системных микозов выявлены у 31 (15,1%) больного, при этом диагностированы микозы, развившиеся в составе микстинфекции (вирусно-бактериально-грибковые или вирусно-бактериально-грибково-пневмоцистные). У большинства (70%) больных выявлены признаки орофарингеального кандидоза, который у 11% из них протекал с кандидозным эзофагитом. В 100% наблюдений грибковая инфекция в легких развивалась на фоне ЦМВ-инфекции в виде распро-
страненной пневмонии с прогрессирующей дыхательной недостаточностью. Среди выделенных из
мокроты микроорганизмов преобладали грамположительные кокки – 47,8% и грибы Candida spp. –
30,4%; грамотрицательные палочки составили 12,7%. При этом изолированной грибковой инфекции не было ни у одного больного. У 6 пациентов в крови и БАЛ обнаружен галактоманнан (антиген Aspergillus spp.) в диагностически значимой концентрации. Двенадцати (80,1%) больным дыхательная недостаточность потребовала применения ИВЛ.
Нелегочные проявления системных микозов диагностированы у 9 (4,1%) из 204 больных, из них кандидоз мочевыводящих путей у 7 больных, аспергиллез – у 2. Возбудителями грибковой инфекции
в 85% наблюдений были Candida spp., в 15% – Aspergillus spp.
Медиана сроков развития симптомов легочной инфекции с момента трансплантации почки для
всех заболеваний составила 1,03 (0,03–55,4) мес., для микст-пневмоний – 3,1 (0,13–37) мес. Медиана продолжительности пневмонии для всех пациентов – 35,5 (3–78) сут., микст-пневмоний (вирусно-бактериально-грибковых) – 40,5 (17–78) сут.
Самым частым клиническим симптомом легочных инфекций для всех больных с пересаженной почкой
было повышение температуры тела. Также наблюдались слабость, дыхательный дискомфорт, в тяжелых случаях нараставший до выраженной одышки. У 32,3% больных отмечен кашель. Из лабораторных симптомов наиболее частыми были повышение СОЭ (100%), уровня С-реактивного белка (96,8%); снижение содержания гемоглобина (87,1%), лейкоцитоз (41,9%), несколько реже – лейкопения (29%). У 45,2% реципиентов при проявлении грибковой как легочной, так и нелегочной инфекции имело место ухудшение функции трансплантата. При нелегочных проявлениях системных микозов выявлены протеинурия (23,8%), микрогематурия (34,7%), лейкоцитурия (18,4%).
Общая летальность при пневмониях составила 35,5%. Наиболее высоким этот показатель был для
больных с вирусно-бактериально-грибковой пневмонией – 64,3%. Микст-пневмонии оказались ведущей причиной смерти 11 больных с функционирующим трансплантатом. Гибели больных с нелегочными проявлениями системных микозов не зафиксировано.
Тридцати восьми (80%) больным при выявлении грибковой инфекции был назначен ABLC в дозе от
2 до 5 мг/кг/сут. Лечение, как правило, начиналось с назначения амфотерицина В, который вводился
внутривенно в дозе 0,75–1 мг/кг/сут, начиная с дозы 0,25 мг/кг/сут. При развитии побочных реакций
препарат заменяли на ABLC. Необходимо отметить, что у всех 4 больных при назначении амфотерицина В отмечены пирогенные реакции, что требовало перевода больного на лечение ABLC. Коррекции дозы ингибиторов кальцинейрина при этом не требовалось. Двум больным при лечении кандидозной инфекции был назначен вориконазол в дозе 200 мг/кг, что привело к значительному повышению концентрации ЦсА в сыворотке крови и циклоспориновой нефропатии, несмотря на то что при этом концентрация циклоспорина А была снижена на 80%.
В табл. 1 представлены данные о частоте развития побочных реакций при назначении больным ABLC.
Одной из самых частых побочных реакций на введение амфотерицина В и ABLC считалась гиперазотемия – 80%. Причем подъем уровня креатинина в сыворотке крови на введение амфотерицина В составил 25% от исходного, в то время как при назначении ABLC изменение данного показателя составило 10–15%. У 17 (42,5%) больных наблюдалась лейкопения. Тремор и тошнота зафиксированы у 37,5% пациентов, снижение уровня гемоглобина — у 27,5%.

Нами были проанализированы изменения биохимических показателей в сыворотке крове на фоне
лечения ABLC (табл. 2).
Таблица 1. Основные биохимические показатели сыворотки крови у реципиентов почечных трансплантатов с грибковой инфекцией до и после лечения ABLC (M ± SD).
У 13 (34,2%) больных уровень креатинина в сыворотке крови увеличился на 10%, у 22 (57,2%) – на
15%, у 5 (13,1%) больных содержание креатинина не изменилось. Отмечен и рост уровня мочевины в
крови у 35 (92,1%) больных – с 15,2±1,93 до 19,3±2,07 ммоль/л. Необходимо отметить, что во всех наблюдениях после отмены ABLC имело место снижение уровня креатинина и мочевины в сыворотке крови до субнормальных показателей. Характерная динамика концентрации креатинина в сыворотке крови при назначении ABLC показана на рис. 1, из которого следует, что после назначения амфотерицина В у больного случился подъем креатинина в крови с 520,6 до 840,6 ммоль/л. При переводе больного на лечение ABLC уровень креатинина крови снизился на 16,7% и стабилизировался. А после отмены данного препарата содержание креатинина в крови уменьшилось до субнормальных значений.
Рисунок 1. Динамика уровня креатинина в сыворотке крови у больных при назначении ABLC.
Гипокалиемия ниже 4 ммоль/л развилась у 7 больных. Отмечен умеренный рост уровня общего билирубина в среднем с 4,66±0,41 до 6,59±0,53 мкмоль/л, содержание мочевой кислоты в крови повысилось с 340±2,5 до 879±4,1 мкмоль/л.
Смешанная грибковая инфекция (Candida spp., Aspergillus spp.), которая спровоцировала острую
почечную недостаточность (ОПН) трансплантата, обусловила формирование дефекта донорского
мочеточника и развитие мочевого затека, отмечена у одного больного. Гифы аспергилл инфильтрировали мышечный слой мочеточника, проникли в сосудистую стенку донорского мочеточника, вызвали кровотечение, тромбоз и как следствие – некроз мочеточника (рис. 2).

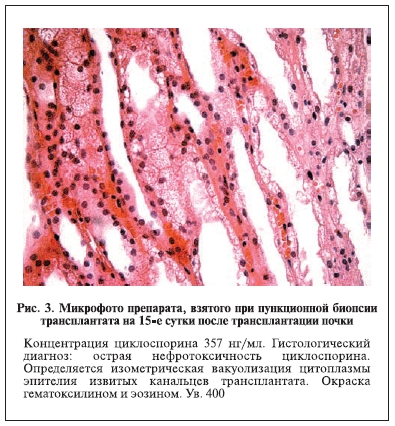
Двум больным с аспергиллезной инфекцией в посттрансплантационном периоде назначен вориконазол
в дозе 4 мг/кг/сут. При этом доза ЦсА была снижена на 80%. Несмотря на это, у одного из этих больных отмечено повышение концентрации ЦсА до 357 нг/мл, что привело к острой циклоспориновой нефропатии, подтвержденной результатами пункционной биопсии трансплантата, и ухудшению функции пересаженной почки (рис. 3). Вориконазол был заменен на амфолип в дозе 5 мг/кг/сут. Нефротоксический эффект амфолипа не был отмечен. Концентрация ЦсА в крови больного восстановилась до 154 нг/мл, функция пересаженной почки нормализовалась. У второго больного назначение вориконазола не отразилось на функции пересаженной почки. Обсуждение. Возникающие грибковые инфекции оказывают негативное влияние на выживаемость реципиентов и почечных трансплантатов. Наиболее опасны пневмонии смешанной этиологии – вирусно-бактериально-грибковые. Летальность при этом, по нашим данным, превышает 60%.
Особенностью течения легочных инфекций у реципиентов почечных трансплантатов было частое выявление грибковых инфекций – до 32,3%. Выявление грибов при бактериологическом анализе
мокроты или позитивные результаты определения грибов в крови далеко не всегда означают наличие
инвазивного легочного микоза, поскольку существует высокая вероятность колонизации грибами слизистой дыхательных путей. Однако полностью исключить грибковый характер поражения легочной ткани не представляется возможным. С учетом прогноза стратегически оправданно считать грибы возбудителями пневмонии и назначать полноценную антимикотическую терапию. При позднем назначении противогрибковых препаратов летальность крайне высока – до 80% [12]. В терапии микст-пневмоний необходимо сочетать антимикробные препараты против различных классов возбудителей, особенно на начальном этапе, когда этиологические факторы еще не установлены.
Назначаемый внутривенно, амфотерицин B до сих пор является препаратом выбора при большинстве
глубоких микозов, особенно угрожающих жизни с невыясненной этиологией. Наиболее серьезным
побочным действием амфотерицина В считают нефротоксичность, наблюдающуюся в процессе
лечения более чем у половины больных.
Попытки уменьшить токсичность обычного амфотерицина B привели к созданию его липидассоциированных форм, обладающих отличными фармако-кинетическими свойствами и безопасных в применении. К препаратам этой группы относятся липидный комплекс амфотерицина B (абелцет, амфолип), липосомальный амфотерицин B (амбизом), коллоидная дисперсия амфотерицина (амфотек). Отсутствие нефротоксичности позволяет использовать эти препараты в более высоких дозах (до 5 мг/кг/сут), чем дезоксихолатный комплекс амфотерицина B. Липидассоциированный амфотерицин B с успехом применяется реципиентами почечного трансплантата, которые относятся к группе наиболее высокого риска развития ОПН на фоне лечения полиеновыми антибиотиками.
Инвазивный кандидоз может поражать любой орган и вызывать жизнеугрожающие шоковые
состояния или диссеминированную внутрисосудистую коагулопатию. Гифы аспергилл обусловливают
разрушение сосудистой стенки и как следствие – некроз пораженного органа. Скопления аспергилл
могут вызывать обструкцию сосуда или мочеточника (в случае поражения почек аспергиллезом) и приводить к ОПН.
У одного больного в нашем исследовании с поражением смешанной грибковой инфекцией донорской почки назначение ABLC сыграло решающую роль в ликвидации грибковой инфекции. У данного
больного скопление грибковых тел (аспергиллома) вызвало прекращение выделения мочи по мочеточнику.
Амфотерицин B, являющийся “золотым стандартом” эмпирической антимикотической терапии,
часто бывает неэффективным в лечении иммуно-компрометированных больных выраженной грибковой инфекцией. Кроме того, амфотерицин B нефротоксичен, что особенно опасно для больных после
трансплантации почки. Благодаря низкой нефротоксичности (по данным литературы, риск ухудшения
функции трансплантата снижен на 58%) терапия ABLC стала шагом вперед в лечении больных си-стемной грибковой инфекцией по сравнению со стандартной терапией амфотерицином B.
Несомненно, успех пластики лоханочно-мочеточникового сегмента донорского трансплантата с использованием собственного мочеточника во многом обязан ликвидации грибковой инфекции при помощи липидного комплекса амфотерицина B (ABLC, Амфолип). Назначение же амфотерицина В приводит к ухудшению функции трансплантированной почки, что подтверждается повышением креатинина крови. При последующей замене амфотерицина В на ABLC повышение креатинина в крови прекращается с последующим его регрессом до субнормальных цифр.
Лечение инвазивных микозов, в том числе легочных, проводится в два этапа: I этап – интенсивное
лечение наиболее эффективными препаратами, II этап – поддерживающее лечение, профилактика
рецидива. Практически всегда при развитии системного микоза реципиентам почечного трансплантата требуется уменьшение объема иммуносупрессивной терапии. Первый этап должен продолжаться не менее 6–10 нед., II – в зависимости от течения заболевания от нескольких месяцев до нескольких лет, а по мнению некоторых авторов, пожизненно. На I этапе терапии препаратом выбора является амфотерицин B, вводимый внутривенно капельно в дозе до 1,5 мг/кг/сут или его липидные формы в дозе до 5 мг/кг/сут. На II этапе обычно применяются пероральные азольные препараты – флюконазол, итраконазол или вориконазол. Амфотерицин B после окончания курса внутривенного введения может быть назначен в ингаляционной форме.
Все азольные антимикотики (кетоконазол, флюконазол, итраконазол, вориконазол, позаконазол)
повышают концентрацию в крови ингибиторов кальциневрина. Особенностью каспофунгина, микамина является отсутствие влияния на концентрацию ЦсА.
В нашем исследовании назначение вориконазола привело к значительному повышению концентрации в сыворотки крови ЦсА и тем самым обусловило развитие циклоспориновой нефропатии. Функция
трансплантата была снижена. Только после отмены вориконазола и назначения ABLC концентрация иммуносупрессора нормализовалась и функция трансплантата восстановилась. В связи с этим
применение противогрибковых препаратов, изменяющих концентрацию иммуносупрессоров, после
трансплантации почки должно быть крайне осторожным, с постоянным мониторированием концентрации ЦсА и такролимуса в крови.
С учетом различных механизмов действия антимикотиков в последнее время при угрожающих
жизни микозах при трансплантации солидных органов используются различные сочетания этих препаратов. При этом амфотерицин B и особенно его липид-ассоциированные формы являются препаратами первой линии при лечении различных форм инвазивных микозов [13, 14]. Эти препараты обладают меньшей нефротоксичностью, вызывают меньше метаболических расстройств, легче переносятся при инфузионном введении.
Заключение. Таким образом, реципиентам почечных трансплантатов для достижения противомикозного эффекта при необходимости может быть назначена максимальная терапевтическая доза антифунгального препарата широкого спектра действия. По нашему опыту, препаратом выбора антимикотической терапии в посттрансплантационном периоде является ABLC, так как обычный амфотерицин B не всегда эффективен, обладает токсическими побочными эффектами, может приводить к почечной недостаточности. Вместе с тем следует отметить, что нефротоксический эффект амфотерицина В обратим и не представляет серьезной угрозы для функции трансплантата.


