Урологические осложнения после трансплантации почки – одни из главных причин увеличения времени госпитализации, нарушения функции почки, потери трансплантата и смертности больных. Несмотря на появление новых мер профилактики и все более совершенных методов лечения, распространенность урологических осложнений остается довольно высокой — от 2,5 до 14,1 % [1]. Большинство из них служат осложнением со стороны мочеточника трансплантата. Многие из них развиваются в первый месяц после трансплантации. К числу ранних урологических осложнений следует отнести некроз мочеточника трансплантата (3,3 %), несостоятельность уретероцистоанастомоза (1,9 %), мочевой затек (0–8,9 %), окклюзию мочеточника (0,6 %), стеноз уретероцистоанастомоза с развитием инфравезикальной обструкции (3,1–8 %) [2].
К главным факторам развития этих осложнений относятся технические проблемы во время изъятия донорских органов (травма нижнеполюсной артерии трансплантата), обработка мочеточника во время операции трансплантации, скелетирование его (нарушение кровообращения мочеточника) и техника выполнения пузырно-мочеточникового анастомоза [3]. До 70% некрозов дистального отдела донорского мочеточника возникает из-за вышеуказанных причин. Потенциальными факторами риска служат возраст реципиента, причина болезни почек, сахарный диабет, время холодовой ишемии, высокие дозы стероидов, реакция отторжения трансплантата. Множественные артерии трансплантата могут способствовать нарушению кровоснабжения донорского мочеточника и как следствие – его инфаркту [4]. Следствием некроза мочеточника может стать развитие пиелонефрита, сопровождающегося нарушением хорошей первичной функции трансплантата, и потеря последнего. Как правило, эти состояния легко диагностируются и требуют экстренного оперативного вмешательства. Первой линией лечения после диагностики мочевого затека является скорейшая ревизия и дренирование раны, по возможности выполнение уретероцистоанастомоза или, используя ипсилатеральный мочеточник, осуществление уретеропиелоанастомоза с собственным мочеточником с или без удаления собственной почки. Имеются сообщения об использовании части тонкой кишки при невозможности выполнить вышеперечисленное [5]. Описания применения контралатерального мочеточника при реконструкции лоханочно-мочеточникового сегмента вследствие некроза донорского мочеточника в литературе нами найдено не было. Приводим собственное наблюдение.
П а ц и е н т М., 53 года. Поступил 31.01.12 в отделение трансплантологии и диализа МОНИКИ им. М.Ф. Владимирского. Диагноз артериальная гипертензия с исходом в нефроангиосклероз, хроническая болезнь почек Vд-стадии, состояние на программном гемодиализе, нефрогенная анемия, дилатационная миокардиодистрофия, хроническая сердечная недостаточность 1–2, энцефалопатия смешанного генеза, хронический простатит, язвенная болезнь желудка вне обострения, хроническая обструктивная болезнь легких, гипертоническая ангиопатия сетчатки».
Болен с 1974 г. (с 14 лет), когда впервые выявлена гипертензия. В 2006 г. появились отеки стоп, голеней. За медицинской помощью не обращался.
С 2008 г. – выраженные отеки нижних конечностей, неконтролируемая гипертензия до 210/140 мм рт.ст., одышка в покое. Выполнена КТ брюшной полости, где впервые обнаружены киста надпочечника справа, множественные кистозные образования почек, сморщенные почки. Отмечено повышение уровня креатинина сыворотки крови до 1247 ммоль/л, мочевины сыворотки крови до 38,4 ммоль/л, гиперкалиемия. Больному сформирована артериовенозная фистула на левом предплечье и с 2008 г. начато лечение программным гемодиализом.
При обследовании: Нb 95 г/л, эр. 2,82х1012/л, 7,5х109/л. Биохимический анализ крови: билирубин общий 7,0 мкмоль/л, холестерин общий 4,5 ммоль/л, общий белок 71 г/л, АлАТ 7 ЕД/л, АсАТ 9 ЕД/л, щелочная фосфатаза 65 ЕД/л, кальций 2,21 ммоль/л, фосфор 3,87 ммоль/л, сывороточное железо 11,51 мкмоль/л, глюкоза 4,8 ммоль/л, ГГТ 35 ЕД/л.
 С целью выявления причины реноваскулярной гипертензии исследованы гормоны крови: кортизол (утро) 682 нмоль/л, альдостерон (при физической активности) 0,03 нмоль/л, АРП ренин (при физической активности) 0,5 нг/мл/ч, паратгормон 107 пг/мл.
С целью выявления причины реноваскулярной гипертензии исследованы гормоны крови: кортизол (утро) 682 нмоль/л, альдостерон (при физической активности) 0,03 нмоль/л, АРП ренин (при физической активности) 0,5 нг/мл/ч, паратгормон 107 пг/мл.
Для исключения гормонозависимой опухоли надпочечника исследована суточная моча на продукты распада катехоламинов: метанефрин – 71 мкг/сут (норма 74–297), норметанефрин – 92 мкг/л (норма 150–354), адреналин – 4,5 мкг/сут (0–20), норадреналин – 14,3 мкг/сут (норма 15–80). Данных за гормональную активность образования (киста) в области надпочечника нет.
Мониторирование АД: зарегистрирована систолодиастолическая артериальная гипертензия на протяжении суток 217/136 мм рт.ст. Рентгенологическая картина застоя в малом круге кровообращения. Данные ЭКГ: выраженные изменения миокарда гипертрофированного левого желудочка, обусловленного недостаточностью кровообращения с исходом в очаговую дистрофию. Эхокардиография: фракция выброса 51%.
Магнитно-резонансная томография головного мозга: картина соответствует энцефалопатии смешанного генеза. Мультиспиральная компьютерная томография (МСКТ) органов брюшной полости в 2009 г.: вторично сморщенные почки с наличием мелких кист. Объемное образование передней губы левой почки размером 1,5х2 см – опухоль? киста? Изменения парааортальных лимфоузлов нет. Узелковая гиперплазия обоих надпочечников. Через два года, в 2011 г., при повторной МСКТ динамики размеров образования на почки не отмечено.
Биоимпедансометрия показала, что, несмотря на отсутствие клинически избыточной массы тела, имеется избыток воды 7–8 кг. После достижения «сухого веса» больного АД снизилось до 140/80–160/100 мм рт.ст.
Состояние больного постепенно нормализовалось, что позволило включить пациента в лист ожидания для трансплантации почки.
28.08.12 выполнена трансплантация правой почки в левую подвздошную область. Совпадение по системе АВО полное, по системе HLA – по трем антигенам: A2, B27, DR4. Донор: мужчина 45 лет, погиб от черепно-мозговой травмы. Мультиорганное изъятие органов. Время холодовой ишемии составило 8 ч. Перед операцией выполнена индукция зенапаксом 20. Назначена 3-компонентная иммуносупрессия: метипред – 20 мг/сут, такролимус – 0,1 мг/кг/сут, ММФ (мофетила микофенолат) – 1,5. Во время трансплантации почки введен метипред 500 мг. В связи с тем что у больного выявлена опухоль левой почки, во время трансплантации проведена левосторонняя нефрэктомия. Размер почки 8х5х5,8 см.
Гистология почки от 30.08.12 № 34605/11. Размер почки 8х5х4 см. Почка с мелкобугристой поверхностью, на которой определяются единичные крупные до 2 см и мелкие до 0,2 см тонкостенные кисты с прозрачным содержимым. В области ворот обнаружен мелкокистозный узел диаметром 4,5 см с содержимым геморрагического вида, со стенками ярко-желтого цвета. Гистология удаленной почки: мультилокулярная кистозная светлоклеточная почечно-клеточная карцинома, Grade I по Фурману. Жировая капсула без признаков опухолевого роста с участками кровоизлияний. Прилежащая ткань почки с признаками хронического пиелонефрита и поликистоза. Множество кист, выстланных уплощенным кубическим эпителием, в просветах некоторых кист белковые цилиндры, клеточный детрит.
Выполнен уретеропиелоанастомоз с собственным мочеточником. Установить стент не удалось. Функция трансплантата немедленная. На 3-й день после операции уровень креатинина крови 0,14 ммоль/л, мочевины крови 16 ммоль/л. Мочи за сутки до 3500 мл. 02.09.12 гемодиализ не проводился.
В послеоперационном периоде отмечены выделение мочи по страховому дренажу, отек мошонки. 03.09.12 выполнена ревизия раны. Обнаружен краевой некроз в области уретеропиелоанастомоза. Выполнена резекция мочеточника в пределах здоровых тканей. Установлен стент № 8.
Гистология мочеточника от 03.09.12 № 3430-34. Мочеточник серо-синюшного цвета. В стенке мочеточника выраженные расстройства гемодинамики, элементы слизистой и подслизистой отсутствуют, обнаруживаются пучки дистрофически и некротически измененных гладких мышц, заключенных в отечную строму.
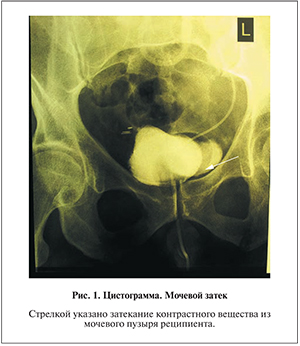
11.09.12 отмечено подтекание мочи по дренажу. При цистографии определено затекание контрастного вещества в области мочевого пузыря (рис. 1).
Ревизия трансплантата. Мочеточник серого цвета на большом протяжении, не перистальтирует. С учетом нежизнеспособности мочеточника нецелесообразность его резекции решено выделить мочеточник с контралатеральной стороны и анастомозировать его с лоханкой донорской почки. Мочеточник максимально выделен из окружающих тканей, перевязан и пересечен, выполнена его транспозиция к трансплантату. Собственную почку не удаляли. Мочеточник без натяжения переведен к лоханке трансплантата. Сформирован уретеропиелоанастомоз. Установлен стент № 8. Выполнено дренирование мочевого пузыря катетером Фоли № 18.
15.09.12. на антеградной пиелографии выявлен затек контрастного вещества неправильной овальной формы в области лоханки донорской почки. 20.09.12 отмечено промокание повязки мочой. Проведена ревизия раны. Мочеточник в области уретеропиелоанастомоза серого цвета некротически изменен. Края мочеточника иссечены до кровоточащего края. В связи с возможностью перегиба мочеточник максимально выделен к мочевому пузырю. Осуществлен реуретеропиелоанастомоз. Установлен стент № 8, выполнена нефростомия трансплантата, мочевой пузырь дренирован катетером Фолея № 18. Данные КТ от 24.10.12: лоханка донорской почки расширена до 26х26 см. Стойкое сужение проксимального отдела сформированного мочеточника на протяжении 17 мм. Далее просвет мочеточника не изменен.
В связи с тем что у больного были корригирующие операции на мочеточнике и лоханке трансплантата, решено ревизию места сужения не выполнять, а провести ретроградное стентирование мочеточника. Послеоперационный период без особенностей.
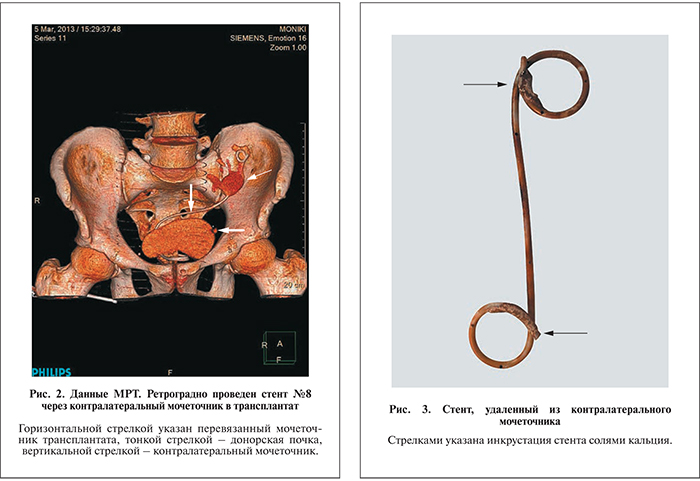
Больной выписан домой со стентом (рис. 2). Состояние больного при выписке удовлетворительное: креатинин крови – 0,07 ммоль/л, мочевина крови – 8,4 ммоль/л, общий белок –74 г/л, билирубин общий – 7 мкмоль/л, щелочная фосфатаза – 110 ЕД/л, Hb – 107 г/л, гематокрит – 33, лейкоциты – 10,8х109л. Назначены адваграф, преднизолон 15 мг/сут, селсепт 1000 мг/сут.
Через 4 мес после трансплантации почки больной поступил в связи с ростом уровня креатинина крови до 350,7 ммоль/л, мочевины крови до 28,3 ммоль/л. В посеве мочи определены Klebsiela pneumoniа 103, Candida albicans 105. В связи с этим к иммуносупрессивной терапии было добавлено лечение антибиотиком имипенемом и антифунгальным препаратом Cansidens 100,0.
При УЗИ трансплантата констатирован гидронефроз трансплантата, лоханка расширена до 10 см3, несмотря на наличие стента в донорской почке. Решено заменить стент. Выполнена цистоскопия, стент удален. Последний значительно изменен, инкрустирован солями (рис. 3).
Стент заменен. При контрольном УЗИ трансплантата гидронефроза нет. Больной выписан домой в удовлетворительном состоянии. Креатинин крови снизился до 0,15 ммоль/л, мочевина крови до 13 ммоль/л.
19.08.13 (через год после трансплантации почки) у больного вновь отмечено увеличение концентрации креатинина крови до 0,4 ммоль/л, мочевины крови до 28,4 ммоль/л. Температура тела повысилась до 38,8°С, ознобы. Трансплантат плотный, болезненный при пальпации. Несмотря на проводимую антибактериальную и антифунгальную терапию, состояние больного постепенно ухудшалось. При УЗИ трансплантата последний увеличен в размерах, гидронефроза нет. Выполнена биопсия трансплантата. Диагностирован криз отторжения IIA по классификации Banff. Проведена противокризовая терапия в полном объеме, включая 3 сеанса плазмафереза. Состояние больного не улучшилось и 29.08.13 выполнена трансплантатэктомия. Последний синюшного цвета, сосудистые анастомозы проходимы, тургор почки снижен. Трансплантат признан нежизнеспособным. Больной переведен на лечение гемодиализом.
29.12.13 осуществлена повторная трансплантация почки в правую подвздошную область. Совпадение по трем антигенам: A8, DR2, DR6. Функция трансплантата немедленная. В качестве индукции использован базиликсимаб 20,0 мг, во время операции метилпреднизолон до 1000.0 мг, 3-компонентная иммуносупрессия. С учетом высокого иммунологического риска больному сразу после трансплантации выполнен сеанс плазмафереза. Больной включен в программу трансляционной иммунотерапии. Проведена противовирусная, противоязвенная, антифунгальная, кардиометаболическая, гипотензивная терапия. Послеоперационный период без осложнений. На 28-е сутки после трансплантации почки больной выписан домой в удовлетворительном состоянии: креатинин крови – 0,11 ммоль/л, мочевина крови – 8,3 ммоль/л, клубочковая фильтрация – 106 мл/мин, АД 140/80 мм рт. ст. Через 6 мес состояние больного удовлетворительное. Жалоб нет. В посевах мочи роста нет.
Использование контралатерального мочеточника у данного больного стало вынужденной мерой. Тотальный некроз мочеточника, трудности в выделении мочевого пузыря из-за спаечного процесса в забрюшинном пространстве не позволили выполнить пиеловезикоанстомоз. В противном случае как паллиативную меру необходимо устанавливать нефростому в трансплантат временно или постоянно, что часто ведет к развитию хронического пиелонефрита с возможным уросепсисом и как следствие – к гибели почки.
Урологические осложнения могут стать причиной длительной госпитализации, потери трансплантата, септического состояния и представлять угрозу для жизни больного. Частота возникновения мочевых свищей в раннем послеоперационном периоде колеблется в пределах от 1 до 17% [6]. Пристальное внимание к лечению этого вида осложнений обусловлено следующими причинами: на фоне агрессивной стартовой иммуносупрессии риск развития септических осложнений крайне высок; раневая инфекция создает предпосылки к аррозии сосудистых анастомозов; выполнение реконструктивных операций на фоне мочевых затеков часто заканчивается развитием вторичных осложнений. Все вышеперечисленное нередко ведет к потере трансплантата [7].
От 60 до 80% мочевых свищей и затеков после пересадки почки обусловлены ишемическим некрозом части мочеточника. Степень ишемии мочеточника трансплантата определяет глубину и протяженность поражения его стенки. При полной облитерации трансплантированного мочеточника на большом протяжении восстановление проходимости мочевого тракта с помощью малотравматичных чрескожных методов может оказаться практически невозможным. Некоторые авторы считают допустимым выполнение резекции некротических участков тканей с реимплантацией мочеточника в мочевой пузырь реципиента [8]. Однако такой подход не всегда позволяет избегать развития повторных осложнений, связанных в основном с продолжающейся ишемией мочеточника. При самой тщательной ревизии вряд ли возможно достоверно оценить степень жизнеспособности тканей, так как некробиотические изменения распространены, как правило, гораздо проксимальнее зоны явно видимого некроза. Кроме того, выделение мочеточника трансплантата может стать причиной дальнейшего ухудшения его кровоснабжения [9]. Кровоснабжение мочеточника осуществляется сегментарно: проксимальная и средняя части его питаются главным образом посредством одной или двух ветвей почечной артерии, средняя и нижняя части мочеточника – из общей подвздошной, верхней и нижней пузырной артерии. Поэтому при трансплантации почки основное значение имеют ветви почечной артерии. Степень питания стенки мочеточника прогрессивно снижается в дистальном направлении. Чем короче донорский мочеточник, тем лучше. Наличие травмы, пересечение или лигирование нижнеполюсной артерии, чрезмерное скелетирование мочеточника во время изъятия донорских органов могут обусловливать частичную или полную ишемию донорского мочеточника [10]. Причина некроза мочеточника у реципиента в представленном наблюдении неясна. Одной из них может быть нарушение кровообращения в собственном мочеточнике из почечных артерий удаленной почки.
Вторичный некроз мочеточника с возникновением затека наиболее опаснен осложнением в ближайшем послеоперационном периоде. При этом вероятность сохранения трансплантата прогрессивно снижается до 18% [11]. Существенно ограничивает применение реуретероцистоанастомоза недостаточная длина остающейся части мочеточника. Выделение мочевого пузыря, как правило, затруднено из-за выраженного спаечного процесса в предпузырном пространстве, поэтому формирование уретероцистоанастомоза с натяжением даже на интубационном дренаже очень часто заканчивается его несостоятельностью и мочевым затеком. В связи с этим при некрозе относительно протяженной части мочеточника чаще прибегают к пиелоуретероанастомозу или уретероуретероанастомозу с ипсилатеральным мочеточником реципиента. Предпосылкой для таких операций служат наиболее благоприятные условия кровоснабжения лоханки трансплантата и мочеточника реципиента [12].
Непрерывный шов передней и задней стенок позволяет обеспечивать герметичность анастомоза и одновременно надежный гемостаз. Однако в условиях выраженного склероза и нарушенного кровообращения тканей безопаснее формировать анастомоз отдельными швами. Наиболее подходящим шовным материалом считается PDS. Для профилактики как несостоятельности, так и стеноза анастомоза необходимо его дренирование с помощью внутреннего стента [13].
Немаловажный вопрос при выполнении уретеропиелоанастомоза с использованием собственного мочеточника реципиента – возможность лигирования мочеточника без проведения нефрэктомии. Ранее считалось, что применение уретеропиелоанастомоза должно сопровождаться одномоментным удалением собственной почки [14]. Однако позже была доказана возможность выполнения подобных операций без нефрэктомии [15]. Выполнение пиелоуретероанстомоза без удаления собственной почки позволяет существенно снижать продолжительность и травматичность операции, что особенно важно для реципиентов, находящихся, как правило, в тяжелом состоянии. О благоприятном исходе семи таких операций было сообщено K Dreikorn. Ни одному из больных не потребовалось удаления собственной почки в течение всего периода наблюдения. При динамическом ультразвуковом наблюдении у большинства реципиентов отмечен умеренный гидронефроз, который уменьшался с течением времени [16]. При необходимости нефрэктомия может быть выполнена отсроченно в более благоприятных условиях люмботомическим или менее травматическим эндоскопическим доступом. Тем не менее проведение одномоментной ипсилатеральной нефрэктомии целесообразно при наличии стойкой рецидивирующей мочевой инфекции, резистентной к антибактериальной терапии. Существует методика формирования анастомоза лоханки реципиента в бок мочеточника без удаления собственной почки. При этом сохраняется нормальный отток мочи из ипсилатеральной почки. Такой способ может представлять интерес для больных с сохраненным диурезом. К основным недостаткам этого метода относятся необходимость мобилизации собственного мочеточника на значительном протяжении, что приводит к обеднению его кровоснабжения, что в свою очередь сопряжено с риском несостоятельности пиелоуретероанастомоза [17].
Интерес представленного наблюдения также в том, что собственная почка больного на противоположенной стороне не удалялась. На протяжении двух лет после трансплантации, по данным УЗИ собственной почки, гидронефроза не отмечалось. Размер ее не менялся. Болей в правой поясничной области не было.
Кроме того, наличие злокачественной гипертензии у больного могло быть следствием развития паранеопластического процесса. Не случайно, после удаления собственной почки, пораженной опухолью – мультилокулярной кистозной светлоклеточной почечно-клеточная карциномой, злокачественную гипертензию удалось скорригировать. В комплексной коррекции гипертензии имела значение и ликвидация гипергидратации (7–8 л).
Основным условием выполнения успешного пиелоуретероцистоанастомоза слвужит пригодность собственного мочеточника реципиента. Ее можно оценить до планируемой операции при помощи ретроградной уретеропиелографии или во время операции при помощи гидравлического бужирования. Мочеточник может быть пригоден для операции даже через много лет после нефрэктомии с одноименной стороны [6].
Таким образом, пиелоуретероанастомоз с собственным мочеточником реципиента можно считать достаточно универсальным способом восстановления мочевого тракта при лечении как некроза, так и стриктуры мочеточника трансплантата. В случае отсутствия или непригодности собственного ипсилатерального мочеточника пиелоуретероанастомоз можно выполнить с контралатеральным мочеточником. Использование трансперитонеального доступа может облегчить решение этой задачи.


