Введение. С момента первого описания лапароскопической пиелопластики у детей прошло уже более 15 лет [1]. За это время методика зарекомендовала себя как безопасная и эффективная альтернатива традиционным операциям [2]. Эффективность (как в морфологическом, так и в функциональном плане) лапароскопического доступа при гидронефрозе составляет 95–98%, что соответствует результатам использования стандартных методик [3, 4]. Мощная доказательная база, накопленная за этот период, позволяет с уверенностью говорить, что данная операция на сегодняшний день не является экспериментальной и принята за «золотой» стандарт лечения врожденного гидронефроза у детей во многих мировых центрах [5].
Однако, несмотря на значительный накопленный опыт и широкое распространение лапароскопических методик, в педиатрической практике остаются дискутабельными вопросы дренирования чашечно-лоханочной системы (ЧЛС) в послеоперационном периоде. Так, в большинстве работ в качестве варианта деривации мочи после операции применяется мочеточниковый стент, однако приходится сталкиваться с ситуациями, особенно пациентам младшей возрастной группы, когда проведение стента в мочевой пузырь ввиду небольшого диаметра мочеточника сопряжено со значительными трудностями.
Целью настоящей работы стало представление собственного опыта применения различных методов деривации мочи после лапароскопической пиелопластики у детей.
 Материалы и методы. С февраля 2008 по февраль 2012 г. было выполнено 57 пиелопластик с использованием лапароскопического доступа. Среди детей двадцати двум выполнена лапароскопически ассистированная пиелопластика, и они не были включены в данное исследование. У 4 детей обнаружены добавочные нижнеполярные сосуды, пересекающие неизмененный по диаметру пиелоуретеральный сегмент, в связи с чем им была проведена транспозиция сосудов и они также были исключены из группы наблюдения. Одному ребенку выполнена конверсия в связи с трудностями заведения мочеточникового стента. Полностью лапароскопически пиелопластика выполнена 30 детям.
Материалы и методы. С февраля 2008 по февраль 2012 г. было выполнено 57 пиелопластик с использованием лапароскопического доступа. Среди детей двадцати двум выполнена лапароскопически ассистированная пиелопластика, и они не были включены в данное исследование. У 4 детей обнаружены добавочные нижнеполярные сосуды, пересекающие неизмененный по диаметру пиелоуретеральный сегмент, в связи с чем им была проведена транспозиция сосудов и они также были исключены из группы наблюдения. Одному ребенку выполнена конверсия в связи с трудностями заведения мочеточникового стента. Полностью лапароскопически пиелопластика выполнена 30 детям.
Мальчиков было 16 (53%), девочек – 14 (47%). Средний возраст пациентов составил 61 мес (от 2 мес до 14 лет). В возрасте до года прооперированы 9 (30%) детей, при этом минимальная масса тела ребенка составила 5500 г. В 8 (26,7%) наблюдениях пиелопластика выполнена справа, в 22 (73,3%) – слева. Четвертая степень гидронефроза по классификации Ассоциации фетальной урологии (Society of Fetal Urology – SFU) диагностирована у 10 (33,3%) пациентов, III – у 19 (63,3%), II – у 1 (3,4%) ребенка.
Диагноз ставили на основании данных УЗИ с диуретической нагрузкой, внутривенной урографии и в некоторых случаях – компьютерной томографии.
Показаниями к операции служили снижение экскреторной функции пораженной почки, рецидивирующие боли, повторяющиеся эпизоды обострений пиелонефрита, значительная дилатация ЧЛС (IV степень по SFU) или ее нарастание в динамике.
Операции проводили трансабдоминальным доступом с использованием трех портов. В 4 (13%) наблюдениях потребовалась установка дополнительного, четвертого, порта в соответствующее подреберье для ретракции печени или раздутых петель кишечника.
В 21 (70%) наблюдении пиелоуретеральный сегмент визуализировался только после мобилизации ободочной кишки по линии Toldt и ее смещения медиальнее, у 9 (30%) детей доступ осуществлен трансмезентериально.
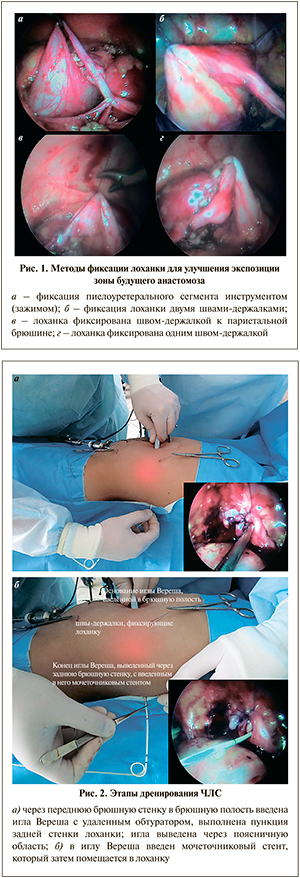
Анастомоз формировали по стандартной методике Hynes–Anderson, используя два непрерывных шва Vicryl или PDS 5/0 или 6/0 в зависимости от возраста оперируемого ребенка. Для удобства экспозиции зоны будущего анастомоза лоханку фиксировали сквозными швами-держалками через переднюю брюшную стенку (рис. 1).
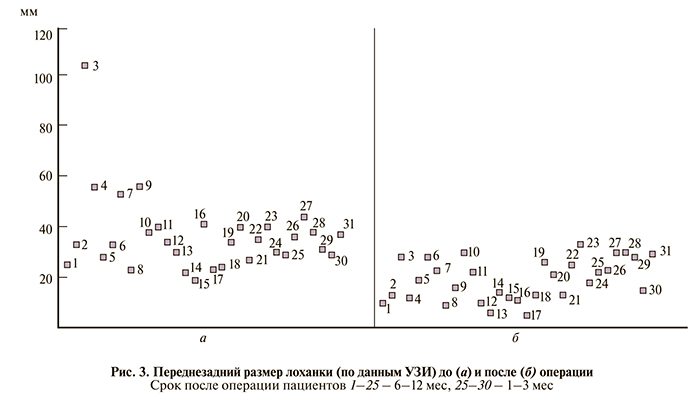
После формирования задней губы анастомоза осуществляли дренирование ЧЛС. У 13 (43,3%) детей использовали мочеточниковые стенты 5–6 Ch, при этом 2 (6,7%) выполнена ретроградная установка стента непосредственно перед операцией. Ранее наложенные нефростомические дренажи были оставлены у 2 (6,7%) детей, в 8 (26,7%) наблюдениях установлены пиелостомы (дренаж помещали через отдельное отверстие в лоханке и выводили через переднюю брюшную стенку, из них в 7 – мы использовали технику нефростомии. Троим (10%) пациентам в брюшную полость путем прокола брюшной стенки вводили иглу Вереша с удаленным обтуратором, через заднюю стенку лоханки иглу выводили наружу и в нее заводили дренажную трубку, которую помещали в лоханку (рис. 2).
Еще 4 (13,3%) детям подобная методика выполнена с интубацией зоны анастомоза – использовали double J-стент с удлиненным прямым концом. Дистальный извитой конец стента срезали, аналогично предыдущей методике дренаж помещали в лоханку, один прямой конец стента заводили до верхней трети или середины мочеточника, а второй прямой конец забрюшинно выводили наружу, таким образом формируя уретеронефростому.
Страховочный дренаж к месту анастомоза оставлен у 12 (40%) пациентов.
Результаты. Длительность операции в среднем составила 140 мин (от 80 до 240). Интраоперационных осложнений не было. В раннем послеоперационном периоде возникло 3 (10%) осложнения. У 1 мальчика в возрасте 17 мес на 2-е сутки после операции выпал пиелостомический дренаж с дальнейшим нарастанием дилатации ЧЛС по УЗИ и развитием обструктивного пиелонефрита. Пациенту наложена чрескожная пункционная нефростома, удаленная на 48-е сутки после операции. Еще у 1 мальчика 11 лет на 2-е сутки после пиелопластики с установленным ретроградно мочеточниковым стентом на УЗИ выявлена массивная уринома паранефрального пространства и нарастание дилатации ЧЛС. При попытке постановки чрескожной пункционной нефростомы возникло массивное кровотечение, потребовавшее люмботомии, ревизии зоны кровотечения и гемостаза. Уринома опорожнена, выполнено дренирование паранефрального пространства. Пациент выписан с нефростомическим дренажом, удаленным на 38-е сутки после операции. Однако в обоих случаях анастомоз оказался герметичным и исход операций признан хорошим. Еще у 1 (3%) мальчика 11 лет на 6-е сутки после пиелопластики с установкой мочеточникового стента возникли жалобы на интенсивные боли в боку. На УЗИ выявлена значительная дилатация ЧЛС, при этом в мочевом пузыре и в лоханке визуализировались петли мочеточникового стента. Пациенту выполнена чрескожная нефростомия. На 10-е сутки мочеточниковый стент был удален, ребенок выписан с нефростомическим дренажом. По данным антеградной пиелографии, выполненной через 1 мес, проходимость ПУС не восстановлена; планируется проведение повторной пиелопластики.
Мочеточниковые стенты удаляли в среднем через 47 (20–80) сут, а пиелостомический дренаж – через 16 (10–21) сут после операции.
Пациентов приглашали на стационарное обследование через 6 и 12 мес после операции для выполнения внутривенной урографии и УЗИ с диуретической нагрузкой; на амбулаторном этапе регулярно проводился УЗИ-контроль. Продолжительность наблюдения за пациентами составила до 53 мес.
На сегодняшний день жалобы отсутствуют со стороны всех пациентов. При контрольном обследовании практически у всех детей после лапароскопической пиелопластики зафиксировано уменьшение степени гидронефроза (рис. 3 и 4).
Обсуждение. Малоинвазивные операции в детской урологии сегодня становятся все более востребованными и получают более широкое распространение. Эффективность подобных операций составляет 95–100% [6, 7]. В зарубежных публикациях последних лет об эффективности лапароскопических методик говорят не только в морфологическом (сокращение ЧЛС по данным УЗИ, уменьшение степени гидронефроза), но и в функциональном (сохранение и возможное улучшение функции пораженного органа, подтвержденное результатами радиоизотопных исследований) аспекте [8].
В нашей стране данные методики применяются лишь в нескольких центрах, при этом количество выполненных операций не превышает 60. Несмотря на небольшой относительно наших зарубежных коллег опыт, лапароскопический доступ при выполнении пиелопластики зарекомендовал себя как надежный, безопасный и весьма эффективный способ, совмещающий возможности соблюдения основных принципов стандартного наложения пиелоуретерального анастомоза и великолепный косметический результат [9, 10].
Возраст, в том числе до года, уже несколько лет не является для нас ограничивающим фактором при определении показаний к лапароскопической пиелопластике. Одним из первых об успехе данной операции грудным детям сообщил еще в 2006 г. F. Schier [11]. На сегодняшний день большинство хирургов, практикующих лапароскопические методики лечения гидронефроза, не считают небольшую массу тела или возраст ребенка противопоказанием к выполнению операции [12].
 Мы предпочитаем трансабдоминальный доступ при выполнении пиелопластики, поскольку он обеспечивает адекватное рабочее пространство и хороший обзор, что нивелирует технические трудности при формировании анастомоза. Герметичное ушивание брюшины в зоне операции позволяет при адекватном дренировании ЧЛС максимально обезопасить брюшную полость от возможного подтекания мочи через зону анастомоза. Утверждения о возникновении спаечного процесса после наложения пневмоперитонеума, на наш взгляд, необоснованны, так как при повторных лапароскопических вмешательствах по поводу различных заболеваний (герниорафия, острый аппендицит) установлено, что спаечный процесс в брюшной полости либо отсутствует вообще, либо имеет минимальную выраженность и ограничен областью оперативного вмешательства [9].
Мы предпочитаем трансабдоминальный доступ при выполнении пиелопластики, поскольку он обеспечивает адекватное рабочее пространство и хороший обзор, что нивелирует технические трудности при формировании анастомоза. Герметичное ушивание брюшины в зоне операции позволяет при адекватном дренировании ЧЛС максимально обезопасить брюшную полость от возможного подтекания мочи через зону анастомоза. Утверждения о возникновении спаечного процесса после наложения пневмоперитонеума, на наш взгляд, необоснованны, так как при повторных лапароскопических вмешательствах по поводу различных заболеваний (герниорафия, острый аппендицит) установлено, что спаечный процесс в брюшной полости либо отсутствует вообще, либо имеет минимальную выраженность и ограничен областью оперативного вмешательства [9].
Дренирование ЧЛС при лапароскопических операциях может представлять серьезную проблему, которая иногда даже вынуждает выполнять конверсию, что подтверждает наш начальный опыт. Так, в 2007 г. в связи с трудностями при установке стента 1 пациенту 10 лет потребовался переход на люмботомию с последующей стандартной пиелопластикой.
В большинстве публикаций, посвященных лапароскопической пиелопластике, авторы отдают предпочтение мочеточниковым стентам, так как данный метод характеризуется доказанной эффективностью в плане предотвращения подтекания мочи из зоны анастомоза и освобождает от необходимости дренирования забрюшинного пространства [13]. Однако на практике далеко не всегда, особенно когда речь идет о маленьких пациентах, можно провести мочеточниковый стент через уретеровезикальное соустье. В некоторых случаях задняя губа анастомоза после многократных попыток насильно завести дренаж в мочевой пузырь выглядит довольно плачевно. Мы использовали различные типы мочеточниковых стентов (B-braun, Rush, Cook, МИТ и т.д.), при этом трудности при проведении дренажа не зависели от фирмы-производителя. Конечно, стент можно устанавливать ретроградно, однако, согласно нашему опыту, данная манипуляция также может быть сопряжена с техническими трудностями и требует дополнительного времени для выполнения цистоскопии.
Даже в случае успешной установки стента у последнего имеется один существенный недостаток – необходимость повторной госпитализации и удаления стента под общим обезболиванием. К тому же длительное нахождение мочеточникового стента неизбежно приводит к ряду осложнений, связанных с наличием инородного тела в мочеточнике и мочевом пузыре. Рецидивирующие инфекции мочевыводящих путей, абдоминальный болевой синдром и дисфункции мочеиспускания – наиболее частые из них. Подобные осложнения встречаются с частотой до 80% [14]. Наш опыт также подтверждает возможность возникновения дисфункции мочеточникового стента, который может перестать функционировать в связи с обструкцией кровяными сгустками.
Раньше при невозможности установки мочеточникового стента мы применяли лапароскопическую пиелостомию, при этом дренаж кисетным швом фиксировали к стенке лоханки и через переднюю брюшную стенку выводили наружу. Недостатками данной методики являлись длительное (до 20 дней) наличие инородного тела в брюшной полости и риск подтекания мочи через пиелостомический дефект в стенке лоханки после удаления дренажа, что иногда способствует поддержанию субфебрильной температуры и воспалительного процесса в брюшной полости с исходом в спаечный процесс.
В последнее время для деривации мочи после операции мы предпочитаем выполнять нефростомию при помощи иглы Вереша по методике, описанной ранее. Вопрос шинирования зоны анастомоза для нас остается открытым, так как наш опыт пока не позволяет проводить анализ и тем более давать какие-либо рекомендации. Исследователи разделяются на сторонников и противников интубации зоны анастомоза, при этом все приводят довольно аргументированные доводы [15]. Интересно, что, описывая свою методику, Anderson и Hynes утверждали, что инородное тело в области анастомоза негативно сказывается на его заживлении, и не рекомендовали использование шинирующих дренажей [16].
В нашем отделении при возникновении сомнений в герметичности накладываемого анастомоза или его достаточном диаметре мы используем метод уретеронефростомии, принцип которого мы позаимствовали у наших зарубежных коллег. Данная методика была внедрена еще в 1994 г., когда Z. Zaidi и соавт. описали использование так называемого blue stent (Angiomed Urosoft Pyeloplasty Stent, Bard, Великобритания) для совмещения наружного и внутреннего дренирования ЧЛС после пиелопластики [17]. Метод заключается в использовании double J-стента с удлиненным концом. Дистальный закрученный конец дренажа срезается, и стент заводится до нижней трети мочеточника через область анастомоза так, чтобы один закрученный конец оказался в лоханке, а удлиненная его часть выводилась наружу. Это обеспечивает условия для герметичного ушивания брюшной полости без необходимости оставления страховочного дренажа.
Мы применили данные методики к 8 детям, при этом длительность манипуляции не превышала 10 мин. К преимуществам, по нашему мнению, можно отнести отсутствие инородного тела в брюшной полости, сокращение времени операции (нет необходимости наложения фиксирующих швов на лоханку) и более программируемый послеоперационный период за счет возможности выполнения антеградной пиелографии и промывания дренажа при возникновении дисфункции дренажной системы. По сравнению с внутренним дренированием они выгодно отличаются отсутствием необходимости повторной госпитализации и применения наркоза для удаления стента, а также уменьшением выраженности проявлений стент-ассоциированных симптомов.
Осложнения после лапароскопической пиелопластики отмечены нами у трех пациентов, что составило 10%. У двоих из них анастомоз оказался состоятельным, и исход операции – успешным. У 1 (3%) ребенка констатирован рецидив, ему планируется выполнить повторную пиелопластику.
Заключение. Основываясь на анализе наших данных, можно утверждать, что процедура лапароскопического формирования пиелоуретерального анастомоза на настоящий момент практически не вызывает трудностей. Единственным элементом «импровизации» в данных операциях остается дренирование ЧЛС. Мы уверены, что выработка четких алгоритмов деривации мочи после подобных операций поможет снизить частоту нестандартного течения послеоперационного периода и, соответственно, возможных осложнений. Применяя различные методики дренирования ЧЛС после лапароскопической пиелопластики, мы пришли к выводу, что в случае возникновения трудностей при установке мочеточникового стента необходимо выполнять нефростомию по описанной выше методике. При этом важным является то, что если требует ситуация, имеется возможность провести дренаж через зону анастомоза и осуществить деривацию мочи относительно простым и универсальным альтернативным методом, совмещающим положительные качества внутреннего и наружного дренирования. Надеемся, что применение данных методик позволит облегчить выполнение подобных довольно сложных в техническом плане операций и будет способствовать более широкому применению лапароскопической пиелопластики в лечении детей в различных регионах Российской Федерации.



