Введение. Развитие ретроградной эякуляции после трансуретральной резекции предстательной железы (ТУРП), по данным больших мультицентровых исследований, отмечается у 80–90% пациентов [1–3]. Традиционной причиной развития ретроградной эякуляции считается разрушение шейки мочевого пузыря и утрата ею способности к спазму во время выброса спермы в простатический отдел уретры, что способствует забросу последней в мочевой пузырь. Таким образом, развитие ретроградной эякуляции воспринимается как результат утраты физиологической функции гладкомышечного сфинктера мочевого пузыря (так называемого внутреннего сфинктера) [4, 5]. Однако клинические, физиологические и анатомические факты заставляют сомневаться в однозначной роли травмы шейки мочевого пузыря в развитии послеоперационной ретроградной эякуляции и справедливости этой наиболее распространенной точки зрения.
Во-первых, по данным многочисленных клинических исследований, у 10–20% больных после стандартной ТУРП, всегда сопровождающейся разрушением шейки мочевого пузыря, сохраняется антеградная эякуляция. Сохраняется она также и у подавляющего большинства (более 80%) пациентов после инцизии предстательной железы, несмотря на рассечение зоны внутреннего сфинктера мочевого пузыря [6–8]. Во-вторых, видеоуродинамические наблюдения показывают наличие постоянно открытой шейки мочевого пузыря у пациентов с сохраненной антеградной эякуляцией и, напротив, у ряда пациентов с ретроградной эякуляцией (в частности, после забрюшинной лимфаденэктомии) шейка мочевого пузыря всегда закрыта. И наконец, обнаружена и изучена гладкая мышца m. ejaculatorius, расположенная в основании семенного бугорка, которую многие в последнее время и считают ответственной за процесс эякуляции [9, 10].
Эякуляция является важной частью мужского оргазма. Помимо риска кровотечения и развития других интра- и послеоперационных осложнений утрата возможности естественной эякуляции и эректильная дисфункция остаются основной причиной отказа пациентов от выполнения стандартной трансуретральной операции, несмотря на наличие у них показаний к ее выполнению. Ретроградная эякуляция служит главной проблемой в группе относительно молодых (30–60 лет) пациентов с наличием инфравезикальной обструкции вследствие доброкачественной гиперплазии или склероза предстательной железы. Утрата естественной эякуляции может приводить к развитию эректильной дисфункции, сопровождается психосоциальной дезадаптацией пациента, невозможностью деторождения естественным образом [11].

Исходя из вышеуказанных данных о механизме естественной эякуляции, а также опираясь на зарубежный опыт выполнения подобных операций [12–14], нами была адаптирована для использования в отечественной клинической практике оригинальная методика «эякуляторно-протективной» ТУРП (ЭП ТУРП). К основной технической особенности данной операции в нашем варианте относится помимо бережного отношения к шейке мочевого пузыря оставление интактной зоны семенного пузырька и участка слизистой вокруг на расстоянии не менее 1,0–1,5 см, что позволяет предохранять естественные эякуляторные механизмы. Мы выполняем данную операцию ряду пациентов уже более 20 лет, однако наметившаяся общая тенденция к «старению деторождения» заставляет нас все более часто к ней прибегать. Вследствие этого мы провели клиническое исследование, в котором приводим ближайшие и отдаленные (до 36 мес) результаты эякуляторно-протективной ТУР простаты по сравнению со стандартной ТУРП.
Материалы и методы. С мая по декабрь 2010 г. 42 пациентам с инфравезикальной обструкцией, вызванной доброкачественной гиперплазией предстательной железы (основная группа), на базе урологического отделения ГКУБ № 47 (в настоящее время ГКБ № 57) Москвы была выполнена ЭП ТУРП. Все пациенты основной группы были моложе 60 лет (возраст самого молодого – 48 лет). Показанием к включению пациентов в основную группу была сохраненная эректильная функция до операции (оценивалась по международному опроснику эректильной функции МИЭФ-5 с добавлением вопросов 9 и 10 из опросника МИЭФ-15). Двенадцать из 42 пациентов выразили желание сохранить естественную эякуляцию в связи с желанием иметь ребенка, 30 – вели активную половую жизнь и хотели ее сохранить в том же качестве после операции.

На этапе включения в исследование всем пациентам было проведено комплексное клинико-лабораторное обследование, включившее пальцевое ректальное исследование, оценку жалоб по шкале I-PSS и QoL, ультразвуковое исследование, урофлоуметрию с определением максимальной скорости мочеиспускания (Qmax), общеклинические анализы крови и мочи, микробиологическое исследование мочи, анализ крови на простатспецифический антиген (ПСА). Для исключения рака простаты по показаниям выполнили биопсию предстательной железы.
Для сравнительной оценки эффективности и безопасности метода ЭП ТУРП была сформирована контрольная группа из 40 пациентов, которым была выполнена стандартная ТУРП. Этим больным было проведено аналогичное стандартное комплексное клинико-лабораторное обследование.
Критерии исключения из исследования: хирургические вмешательства на органах малого таза в анамнезе, наличие стриктуры уретры, сахарного диабета, неврологического заболевания и эректильной дисфункции.
 Результаты предоперационного обследования больных обеих групп представлены в табл. 1.
Результаты предоперационного обследования больных обеих групп представлены в табл. 1.
Группы были сопоставимыми по основным показателям. Средний возраст и объем простаты в группе ЭП ТУРП был меньше, чем в группе, где проводилась стандартная ТУРП, однако статически достоверных различий выявлено не было.
Все пациенты были оперированы одной операционной бригадой в объеме трансуретральной резекции простаты (ЭП ТУРП или ТУРП).
Техника эякуляторно-протективной трансуретральной резекции предстательной железы
Стандартную ТУРП выполнили по методике Barnes (рис. 1) [15]. При выполнении операции по эякуляторно-сберегающей методике сохранили часть предстательной железы, окружавшую семенной бугорок (рис. 2), и шейку мочевого пузыря.
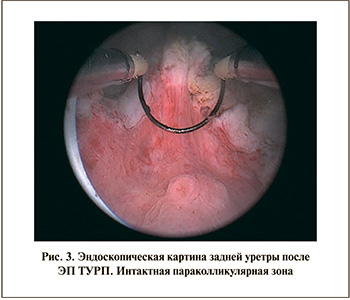
Сначала с помощью крючковидного электрода или петли нанесли горизонтальную коагуляционную метку проксимальнее семенного бугорка, отступив от него на 1,0–1,5 см. Затем выполнили резекцию гиперплазированных тканей по стандартной методике до метки, оставив нетронутой ткань в параколликулярной зоне и использовав минимальные режимы коагуляции (рис. 3). При этом старались минимизировать травму шейки мочевого пузыря, удалив лишь гиперплазированную ткань и оставив интактными мышечные волокна. Гемостаз и дренирование мочевого пузыря осуществили обычным способом. Учли время операции, изменение концентрации гемоглобина в плазме крови, время функционирования промывной системы, сроки дренирования мочевого пузыря уретральным катетером, продолжительность госпитализации, частоту развития осложнений (послеоперационная тампонада мочевого пузыря, недержание мочи, задержка мочи, необходимость гемотрансфузии, количество повторных операций).
По завершении стационарного лечения спустя 12, 24 и 36 мес большинству пациентов было проведено контрольное обследование, включившее оценку жалоб по шкале I-PSS и QoL, пальцевое ректальное и ультразвуковое исследование (размеры простаты, количество остаточной мочи), урофлоуметрию и контроль лабораторных показателей (общий анализ крови, мочи, по показаниям – микробиологическое исследование мочи). Больным с длительно сохраняющимися симптомами гиперактивности выполнено комплексное уродинамическое исследование. Качество половой жизни оценено по опроснику МИЭФ. В ряде случаев (в основном у пациентов с частичной антеградной эякуляцией) выполнены анализ мочи после полового акта и спермограмма.
Из окончательного анализа были исключены данные 3 и 5 пациентов основной и контрольной групп соответственно, так как они не явились в клинику для оценки результатов лечения.
Все результаты обследования и лечения занесены в специальную компьютерную программу, результаты лечения подвергли статистической обработке с определением стандартного отклонения, различия считали достоверными при р<0,05.
Результаты. Анализ показателей интра- и послеоперационного периодов показал (табл. 2), что статистически значимые различия в группах касались только объема удаленных тканей, незначительные – продолжительности операции. Скорость удаления тканей была немного выше при проведении стандартной ТУРП.

Контрольное обследование в сроки 12, 24 и 36 мес после операции прошли 39 пациентов основной группы и 35 — контрольной (табл. 3).
Как видно из табл. 3, положительные итоги, достигнутые в результате операций, оставались стабильными на протяжении 3 лет.
Операции в группе стандартной ТУРП сопровождались большим количеством «закрытых» перфораций капсулы – 7 (17,5%) больных против 2 (4,8%) в группе ЭП ТУРП (р<0,05), что было сопряжено с несколько большей кровоточивостью тканей. «Закрытая» перфорация простатической капсулы не является серьезным осложнением ТУРП, а скорее служит отражением степени радикальности удаления тканей. Умеренные кровотечения, потребовавшие форсированного гемостаза, возникли у 2 (4,8%) и 3 (7,5%) больных групп ЭП ТУРП и ТУРП соответственно.
Стандартная и модифицированная ТУРП оказались абсолютно сопоставимыми по послеоперационным осложнениям. Так, среди ранних и поздних послеоперационных осложнений в основной группе отмечали стриктуру уретры – 1 (2,6%) наблюдение, в контрольной – стрессовое недержание мочи, склероз шейки мочевого пузыря – по 1 (2,9%) больному. Необходимость в повторных операциях (трансуретральная резекция шейки мочевого пузыря, внутренняя уретротомия) возникла у 2 пациентов – по одному из каждой группы. Возможно, в более поздние сроки из-за оставления ткани в параколликулярной области и могут возникать какие-нибудь различия, но для окончательного суждения необходимо более длительное наблюдение.
Выполнение операции по разработанной нами методике позволило полностью сохранить естественную эякуляцию 48,7% пациентов и частично – 25,6% больных против 14,3 и 8,6% пациентов соответственно контрольной группы (табл. 4). Ряд пациентов с развитием ретроградной эякуляции после операции (9 из 37 больных обеих групп) отметили разнообразные нарушения в половой жизни, наиболее часто – снижение либидо и развитие эректильной дисфункции (снижение суммарного балла по шкале МИЭФ-5 с 19,5±2,6 до 13,2±3,4). В то же время большинство пациентов с сохраненной естественной эякуляцией (17 из 24 обеих групп) отметили улучшение качества половой жизни в отдаленные сроки после операции (повышение суммарного балла по МИЭФ-5 с 15,8±2,7 до 20,0±3,1).

Обсуждение. Исходя из современных представлений о механизме эякуляции, в основе развития ретроградной эякуляции (вне зависимости от ее этиологии), по всей видимости, лежит нарушение сложно координированного механизма сочетанной активации симпатического отдела вегетативной (сокращение простатической уретры, семенных пузырьков) и соматической (наружный сфинктер мочевого пузыря, мышцы тазового дна) нервных систем. В пользу данной теории говорят многочисленные наблюдения развития ретроградной эякуляции после забрюшинной лимфаденэктомии, а также при сахарном диабете, когда шейка мочевого пузыря абсолютно интактна, а происходит поражение симпатической нервной системы (при лимфаденэктомии механически пересекаются симпатические нервные волокна, а при диабете поражение служит следствием периферической нейропатии).
В свете данной теории механизм развития ретроградной эякуляции при действии α-адреноблокаторов связан скорее не с раскрытием шейки мочевого пузыря, а с блокадой α-адренорецепторов семенных пузырьков, капсулы предстательной железы и эякуляторной мышцы [16].
В антеградном выбросе спермы в простатический отдел уретры, несомненно, значительную роль играет функционально сохранная эякуляторная мышца, расположенная проксимальнее семенного бугорка.
В результате стандартной ТУРП, предполагающей удаление гиперплазированной ткани вплоть до семенного бугорка, эта мышца чаще всего повреждается, что, по всей видимости, способствует развитию ретроградной эякуляции. Более того, известно, что чувство «предшествующей эякуляции» достигается за счет скопления секрета бульбоуретральных и простатических желез в простатической уретре между наружным и внутренним сфинктером. Вероятно, наибольший вклад в данную фазу полового акта вносит раздражение чувствительных симпатических нервов зоны семенного бугорка и эякуляторной мышцы, поэтому бережное отношение к данной зоне во время операции важно для сохранения чувства «наступления эякуляции». Потеря данного чувства может приводить к снижению либидо и нарушениям в половой жизни пациента.
Щадящее удаление тканей в области шейки мочевого пузыря, по нашему мнению, также играет определенную роль в сохранении нормальной эякуляции после ТУРП. Если это не так, то как можно объяснить появление антеградной эякуляции после введения объемообразующего вещества в интактную шейку мочевого пузыря молодых пациентов с сахарным диабетом и ретроградной эякуляцией? Стимуляция симпатической иннервации в ответ на введение объемообразующего вещества сомнительна, хотя и возможна, а вот искусственно созданный замыкательный механизм гипотетически на какое-то время действительно может обеспечивать восстановление нормальной эякуляции.

Альтернативой ЭП ТУРП в отношении сохранения антеградной эякуляции остается инцизия простаты [6–8]. Частота сохранения естественной эякуляции после данного вида вмешательства достигает 60–80% и более, что сравнимо с результатами предлагаемой модификации ТУРП. К недостаткам инцизии относятся ее неэффективность при внутрипузырном росте предстательной железы и наличии средней доли, а также отсутствие гистологического материала.
Внедрение в клиническую практику лазерной энуклеации, вапорезекции и инцизии в качестве лечения инфравезикальной обструкции различной этиологии создает новые привлекательные возможности для выполнения эякуляторно-протективных трансуретральных операций, так как, в отличие от электрохирургии, лазерная энергия (гольмиевый и тулиевый лазеры) не проникает так глубоко и оказывает меньшее повреждающее действие на нервные волокна, что может обусловливать лучшие результаты в отношении сохранения эректильной функции [12].
Для выполнения эякуляторно-протективной операции, обеспечивающей сохранение эякуляции, важно на предоперационном этапе отбирать пациентов, которым данный вариант операции может быть выполнен с максимальной эффективностью при длительном сохранении хороших уродинамических результатов. Относительными противопоказаниями к ее выполнению могут быть инсулинозависимый сахарный диабет, демиелинизирующие болезни центральной нервной системы, ранее проводимая химиотерапия или лучевая терапия на органах малого таза. Ряд авторов высказывают следующее мнение: максимальная эффективность операции может быть достигнута пациентами с небольшими размерами предстательной железы [17, 18]. Одним из возможных объяснений этого может быть гипотеза о том, что при удалении доброкачественной гиперплазии больших и средних размеров предстательной железе наносится большая травма, что негативным образом сказывается на эякуляторной функции после операции. Вторым возможным объяснением является наличие большей массы апикальных тканей в проекции боковых долей и для создания надежных уродинамических результатов операции необходимо хотя бы частичное их удаление, что не всегда позволяет сохранить зону семенного бугорка интактной.
Заключение. Накопленный нами опыт выполнения ЭП ТУРП и его сравнение со стандартной техникой ТУРП позволяют нам считать данную методику эффективным и безопасным способом оперативного лечения пациентов с доброкачественной гиперплазией простаты. Дальнейшее наблюдение за оперированными пациентами позволит сделать окончательное заключение о стабильности достигнутых результатов и разработать более четкие показания к выполнению подобной операции.



