Введение. Магнитно-резонансная спектроскопия (МРС) простаты появилась сравнительно недавно, но уже зарекомендовала себя как перспективный метод диагностики первичного рака простаты с возможностью прогностической оценки степени его злокачественности и диагностики рецидива заболевания. Эта методика имеет функциональную направленность и предназначена для оценки изменений метаболизма в тканях простаты. Совмещение анатомических данных, полученных с помощью стандартной Т2/tse импульсной последовательности с малым полем обзора, с данными МРС позволяет более точно определять расположение опухоли и даже высказать предположение о степени ее злокачественности. В основе МРС лежат явления ядерно-магнитного резонанса и химического сдвига, а также преобразование изменения сигнала во времени в частотный домен, из которого и формируется спектр метаболитов. Известно несколько разновидностей МРС, используемых в клинической практике: одновоксельная (SVS), двухмерная мультивоксельная (2DCSI) и трехмерная мультивоксельная (3DCSI) спектроскопии. В данной статье мы рассмотрим только мультивоксельную спектроскопию, так как именно она используется в МРС простаты. Мы остановимся на методике проведения исследования, вопросах постобработки и оценке результатов. Рассмотрим несколько собственных клинических примеров, опишем достоинства и недостатки методики.
Описание методики. Магнитно-резонансная томография простаты проводится на томографах с напряженностью поля 1,5 и 3,0 Т с комбинацией эндоректальной катушки и катушки для тела. Для поля напряженностью 1,5 Т использование эндоректального датчика служит обязательным условием проведения МРС. Для поля напряженностью 3 Т использование эндоректальной катушки необязательно, но при ее наличии чувствительность и специфичность диагностики возрастают на 10% [1]. Катушка устанавливается в прямую кишку в положении пациента на левом боку. Фиксирующий баллон раздувается воздухом в количестве 60 и более миллилитров. Использование вместо воздуха инертной жидкости (например, перфторированного углерода, сульфата бария) с магнитной восприимчивостью, близкой к тканям простаты, позволяет добиваться однородности магнитного поля возле простаты и существенно улучшать качество спектров. После установки эндоректальной катушки пациент переворачивается на спину и над областью малого таза фиксируется катушка для тела. Для получения спектров оптимального качества решающее значение имеет правильное расположение эндоректальной катушки. В связи с этим при выполнении планировочных сканов нужно убедиться в следующем: 1) рабочая зона катушка находится напротив простаты на сагиттальных срезах, 2) поворот датчика по отношению к простате на аксиальных срезах не должен превышать 20°, 3) отсутствуют «следы» кровоизлияний после проведенной биопсии. Поскольку даже небольшие гематомы, формирующиеся после трансректальной биопсии, искажают данные спектроскопии, рекомендуется выдерживать срок не менее 8 нед после подобной процедуры [2]. В неясной ситуации перед установкой эндоректальной катушки рекомендуется проводить сканирование в Т1-импульсной последовательности с целью исключения гематом.
 Параметры CSI (мультивоксельной спектроскопии) сканирования простаты зависят от производителя томографа и напряженности поля [3–6]. Всех их объединяет наличие референсных сканов как минимум в двух взаимно перпендикулярных плоскостях для планирования CSI-скана и последующего совмещения метаболических данных с анатомическими срезами. Обычно в качестве референсных изображений используются Т2-ВИ высокого разрешения с малым полем обзора.
Параметры CSI (мультивоксельной спектроскопии) сканирования простаты зависят от производителя томографа и напряженности поля [3–6]. Всех их объединяет наличие референсных сканов как минимум в двух взаимно перпендикулярных плоскостях для планирования CSI-скана и последующего совмещения метаболических данных с анатомическими срезами. Обычно в качестве референсных изображений используются Т2-ВИ высокого разрешения с малым полем обзора.
Размер воксела колеблется от 0,15 до 1,00 см3 и зависит от технических возможностей аппарата. Чем выше магнитное поле, теме выше разрядность матрицы и меньше размер воксела.
Для проведения CSI-спектроскопии на 1,5 Т томографе с эндоректальной катушкой используется трехмерная матрица (VOI – сокр. от Volume of interest) с вокселом размером 5х5х5 мм. Эта матрица должна полностью закрывать простату – от основания до верхушки. С целью лучшей совместимости метаболической карты с анатомическими срезами для VOI выбирается наклон аналогично ориентации косо-трансверсальных Т2-срезов. Следует исключить из зоны интереса семенные пузырьки и стараться минимизировать захват интерференционной зоны между простатой и прямой кишкой [7, 8]. Липиды существенно искажают спектры остальных метаболитов на значительном протяжении VOI. Для корректировки этих искажений используется фильтрация [9]. Кроме того, для подавления сигнала липидов используются блоки селективной сатурации, которые устанавливаются вокруг простаты, адаптируя форму VOI под форму органа [10]. Верхний и нижний блоки насыщения устанавливаются по краям VOI, не захватывая вокселы крайних CSI-срезов. Задний блок устанавливается на прямую кишку параллельно заднему краю VOI с целью насыщения интерференционных артефактов в области стенки прямой кишки.
Шиммирование (выравнивание однородности магнитного поля). Вторым непременным условием получения качественных спектров служит достижение однородности внешнего магнитного поля в объеме интереса (VOI). Это необходимо для подавления сигналов воды и жира. Достигается это за счет систе- мы градиентных магнитных полей и называется активным шиммированием. У всех производителей МРТ-шиммирование производится в автоматическом режиме. Тем не менее для МРС рекомендуют пользоваться ручным шиммированием, особенно если обследуется «крупный» пациент. При проведении ручного шиммирования лаборант контролирует кривую МР-сигнала (FID – спад свободной индукции) в on-line-дисплее и его преобразование в частотный домен или спектр. Самый высокий пик является резонансной частотой воды. Критерии хорошего шиммирования: длинная и ровная синусоида сигнала FID с достаточно пологим затуханием, узкий спектр воды с низкими «плечами» без дополнительных гармоник. При несоблюдении этих условий лаборант последовательно регулирует магнитные поля градиентов x, y, z в сторону увеличения или уменьшения и следит за изменениями сигнала, пока не получит необходимое. Важно помнить, что даже незначительное улучшение шиммирования может существенно отразиться на качестве спектроскопии. Подавление сигнала воды и жира достигается инвертирующими, дефазирующими импульсами, которые рассчитываются автоматически после обработки результатов шиммирования, и блоками сатурации, ограничивающими VOI. После запуска изменения в on-line-дисплее можно контролировать качество спектров. Слишком широкие пики метаболитов или наложение на пики метаболитов липидного спектра говорит о неудовлетворительном шиммировании или плохом расположении блоков сатурации.
 Постобработка. После завершения измерения МР-сигнал в каждом вокселе VOI преобразуется в частотные спектры, в которых пики метаболитов распределяются в зависимости от резонансной часто-
ты атомов водорода, сцепленных с другими различными атомами: кислорода, углерода, азота и т.д. Это незначительное изменение резонансной частоты называется химическим сдвигом. Выражается оно в миллионных долях (ppm) относительно некоего нулевого эталона. Различными производителями оборудования используются разные эталонные среды. Так, у «General Electric» в качестве эталона выступает вода (0 ppm), у Siemens – тетраметилсилан, а вода находится на сдвиге 4,7 ppm. Значение химического сдвига в миллионных долях постоянное для каждого метаболита и не меняется с ростом магнитного поля, поскольку является относительной величиной в отличие от резонансной частоты.
Постобработка. После завершения измерения МР-сигнал в каждом вокселе VOI преобразуется в частотные спектры, в которых пики метаболитов распределяются в зависимости от резонансной часто-
ты атомов водорода, сцепленных с другими различными атомами: кислорода, углерода, азота и т.д. Это незначительное изменение резонансной частоты называется химическим сдвигом. Выражается оно в миллионных долях (ppm) относительно некоего нулевого эталона. Различными производителями оборудования используются разные эталонные среды. Так, у «General Electric» в качестве эталона выступает вода (0 ppm), у Siemens – тетраметилсилан, а вода находится на сдвиге 4,7 ppm. Значение химического сдвига в миллионных долях постоянное для каждого метаболита и не меняется с ростом магнитного поля, поскольку является относительной величиной в отличие от резонансной частоты.
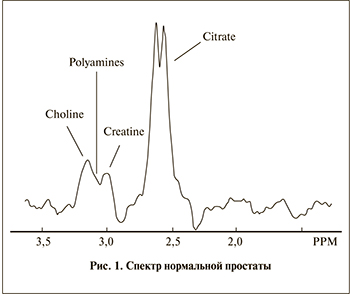
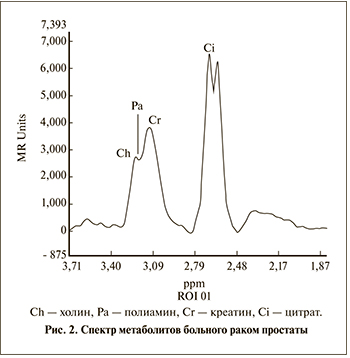
Основным метаболитом железистой ткани простаты служит цитрат (лимонная кислота). Пик этого метаболита находится на сдвиге 2,6 ppm [11]. Доминирующий пик цитрата является характерной особенностью нормальной железистой ткани (рис. 1). При достаточно хорошем шиммировании можно наблюдать удвоенный пик цитрата [12]. К другим метаболитам, представляющим интерес для диагно- стики, относятся холин и креатин. Холин входит в состав фосфолипидов клеточных мембран, участвует в синтезе аминокислоты метионин, поэтому является маркером пролиферативной активности клетки. Пик холина возрастает во многих злокачественных опухолях, в том числе при раке простаты (рис. 2) [13, 14]. Креатин – это азотсодержащая карбоновая кислота, участвующая в энергетическом обмене в мышечных и нервных клетках. Сдвиг между частотой креатина и холина весьма небольшой – 3,0 и 3,2 ppm соответственно, поэтому чаще всего их рассматривают вместе.
Для здорового эпителия простаты также характерна высокая концентрация полиаминов, которая тоже резко снижается при раке простаты [14]. Спектр полиаминов приходится на сдвиг между холином и креатином, поэтому почти никогда не виден. Пик липидов находится справа от цитрата, формируя широкий «горб» в спектре. При недостаточной сатурации липидный спектр искажают общую картину, делая спектр не пригодным для интерпретации.
Постобработка спектров для всех производителей сводится к единой концепции: расчету площади пиков всех метаболитов (интеграл) и вычислению их соотношения. Перед этим производится корректировка фазы, частоты и базовой линии спектра. Чем выше концентрация метаболита, тем выше пик и больше его площадь. Результатом постобработки служит совмещение CSI-матрицы с анатомическим Т2-изображением простаты. В каждом вокселе CSI-матрицы отображается спектр метаболитов. CSI-матрица может представляться в виде решетки или метаболической карты, в которой концентрация метаболита, выраженная в интегральном значении площади пика, кодируется палитрой. При CSI-спектроскопии простаты вычисляется соотношение пиков холина и креатина к цитрату.
Оценка спектров. Для интерпретации данных CSI-спектроскопии простаты необходимо знать: что означает пригодный для интерпретации спектр и какие морфологические изменения лежат в основе метаболических нарушений? Спектры метаболитов клинически приемлемы, если они: 1) не искажаются недостаточно подавленным сигналом воды или жира; 2) отношение площади пика метаболита к шуму превышает 5. Зональная анатомия простаты характеризуется не только различием тканей, но и их метаболическим профилем [15]. Ключевым моментом в интерпретации спектров простаты служит соотношение железистого и стромального компонентов в отдельно взятом вокселе. Для перифериче- ской зоны характерна высокая концентрация цитрата и умеренная – холина. По мере уменьшения удельного веса железистой ткани в переходной и центральной зонах уменьшается и пик цитрата. В передней фиброзно-мышечной зоне и парауретральных отделах самый низкий пик цитрата (в 3 раза меньше, чем в периферической зоне) [15]. Кроме того, возле семявыносящих протоков, семенных пузырьков и уретры резко возрастает пик холина и креатина вследствие высокой концентрации глицерофосфохолина в семенной жидкости.

Перед анализом спектров необходимо топографически сопоставить вокселы CSI-матрицы с Т2-изображениями и установить их принадлежность к периферической, переходной зонам железы, парауретральным отделам, семявыбрасывающим протокам, семенным пузырькам. Поскольку около 70% случаев клинически значимого рака простаты развивается в периферической зоне, на ней следует фокусировать внимание в первую очередь [16, 17], сравнивая соотношение пиков холина креатина и цитрата в различных отделах железы; для стандартизации оценки изменений предложили использовать шкалу PI-RADS (Prostate imaging and reporting data system), в которой вероятность наличия клинически значимого рака выражается в баллах (см. таблицу).
Вокселы периферической зоны, в которых соотношение Cho+Cre/Cit превышает 2 стандартных отклонения от среднего, рассматриваются как возможно злокачественные [4]. Превышение соотношения более 3 стандартных отклонений от среднего указывает на рак [5]. Следует помнить, что указанные пороговые величины не абсолютны и незначительно меняются у различных производителей, а также зависят от напряженности поля.
Итогом количественной оценки данных мультивоксельной спектроскопии является построение CSI-карты, на которой числовое значение соотношения Cho+Cr/Cit кодируется цветом. Голубым и желтым тонам соответствуют низкие, «вероятно доброкачественные», значения, зеленым и красным – высокие, «вероятно злокачественные». В целях удобства интерпретации CSI-матрица совмещается с Т2-изображением высокого разрешения.
Приводим клиническое наблюдение.
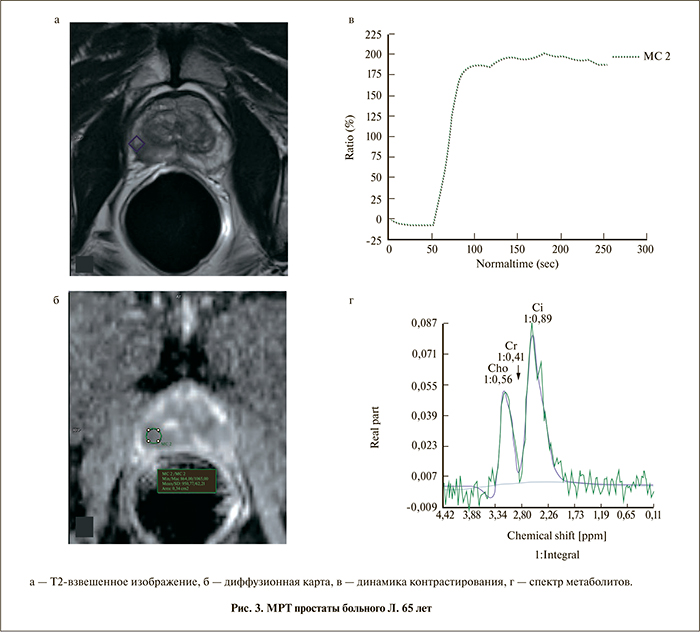
 Б о л ь н о й Л. 65 лет (рис. 3). Жалоб нет. Уровень общего простатспецифического антигена (ПСА) 5,3 нг/мл. Пальцевое ректальное исследование, УЗИ без особенностей. Данные МРТ: переходная зона без особенностей. В середине периферической зоны справа выявляется гипоинтенсивный в Т2-фокус (см. рис. 3, а) с признаками периневральной инвазии, низким истинным коэффициентом диффузии (ИКД) (см. рис. 3, б), вторым типом динамической кривой (см. рис. 3, в), демонстрирующим высокое соотношение пиков (Cho+Cr/Cit = 1,07) (см. рис. 3, г), что соответ-
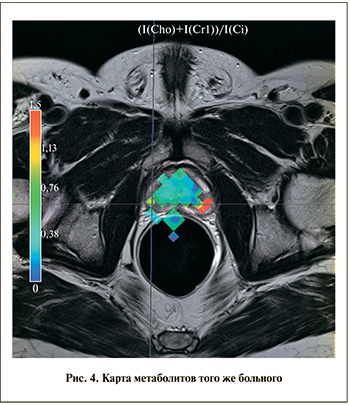
ствует 4–5 баллам по PI-RADS. Левая доля в стандартных режимах не вызывает подозрений. Однако при построении CSI-карты (рис. 4) на том же срезе в периферической зоне левой доли определяется воксел с соотношением Cho+Cr/Cit, равным 1,4, кодированный красным цветом (PI-RADS 5). Заключение: рак простаты с поражением обеих долей без признаков экстракапсулярного роста (Т2 с).
Б о л ь н о й Л. 65 лет (рис. 3). Жалоб нет. Уровень общего простатспецифического антигена (ПСА) 5,3 нг/мл. Пальцевое ректальное исследование, УЗИ без особенностей. Данные МРТ: переходная зона без особенностей. В середине периферической зоны справа выявляется гипоинтенсивный в Т2-фокус (см. рис. 3, а) с признаками периневральной инвазии, низким истинным коэффициентом диффузии (ИКД) (см. рис. 3, б), вторым типом динамической кривой (см. рис. 3, в), демонстрирующим высокое соотношение пиков (Cho+Cr/Cit = 1,07) (см. рис. 3, г), что соответ-
ствует 4–5 баллам по PI-RADS. Левая доля в стандартных режимах не вызывает подозрений. Однако при построении CSI-карты (рис. 4) на том же срезе в периферической зоне левой доли определяется воксел с соотношением Cho+Cr/Cit, равным 1,4, кодированный красным цветом (PI-RADS 5). Заключение: рак простаты с поражением обеих долей без признаков экстракапсулярного роста (Т2 с).
Трансректальная биопсия: в правой доле аденокарцинома, в левой – доброкачественная гиперплазия предстательной железы (ДГПЖ). Данные гистологического заключения после простатэктомии: в правой и левой долях обнаружен рост умеренно дифференцированной мелкоацинарной аденокарциномы (Глисон 3+4) с очагами периневральной инвазии и инвазии капсулы без признаков распространения за ее пределы суммарной площадью поражения до 65% в правой доле и 10 % площади в левой (рТ2 с).
Таким образом, в представленном примере мультивоксельная спектроскопия оказалась точнее стандартных МРТ-методик.
Менее широкое распространение получила качественная оценка спектров, при которой соотношение пиков метаболитов определяется «на глаз» и стандартизируются по аналогичной 5-балльной шкале: 1 балл – пик цитрата превышает пик холина более чем в 2 раза, 2 балла – пик цитрата превышает пик холина в 1–2 раза, 3 балла – пик цитрата и пик холина одинаковые по высоте, 4 балла – пик холина превышает пик цитрата в 1–2 раза, 5 баллов – пик холина превышает пик цитрата более чем в 2 раза.
Приводим клиническое наблюдение:
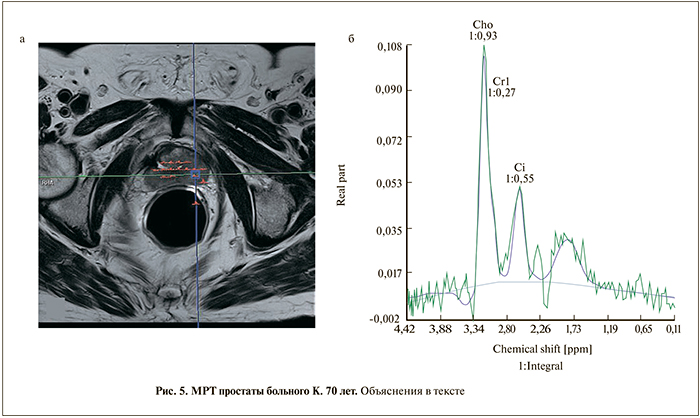
Б о л ь н о й К. 70 лет. Год назад перенес трансуретральную резекцию (ТУР) по поводу ДГПЖ. Спустя некоторое время уровень ПСА вырос до 15,4 нг/мл. При трансректальной биопсии в обеих долях была выявлена аденокарцинома (6 баллов по Глисону). При МРТ: простата после ТУР, в периферической зоне в обеих долях фокусы низкого в режиме Т2-сигнала (4 балла по PI-RADS). На CSI-спектрограмме гипоинтенсивные вокселы демонстрируют высокий пик Cho+Cr, превышающий цитрат более чем в 2 раза (PI-RADS 5) (рис. 5).
Данный пример иллюстрирует одинаковую чув- ствительность Т2-взвешенного изображения и CSI-спектроскопии. Преобладание спектра холина видно «невооруженным глазом» и не требует подтверждения в виде количественной оценки и расчета соотношения.
К факторам, ограничивающим оценку данных CSI, относят постбиопсийные кровоизлияния в простате, ДГПЖ, простатит, присутствие в вокселе микс-ткани (рак + доброкачественная гиперплазия) [18]. Так же как и при стандартной МРТ, при использовании МРС возникают трудности дифференциальной диагностики рака с хроническим простатитом [19, 20]. Многие исследователи обнаруживали повышение пика холина и уменьшение пика цитрата в вокселах периферической зоны при хроническом простатите с изменением соотношения Cho+Cr/Cit в пользу злокачественной опухоли (>1). По этой причине в дифференциальной диагно- стике рака и простатита следует полагаться на клинические данные, а не только на МРТ. Реже спектр метаболитов выглядит как в здоровой железе. Еще реже встречается уменьшение сигнала метаболитов или искажение спектра, которое лишает его диагно- стической ценности [21]. Аналогичным образом ведут себя постбиопсийные изменения. Геморрагическое пропитывание в простате после биопсии влияет на интерпретацию данных не только обычной Т2-взвешенной МРТ, но и МРС. Между временем, прошедшим после трансректальной биопсии, и искажением спектров выявлена обратная зависимость [2]. В связи с этим минимальная задержка, которую рекомендуют соблюдать, составляет 8 нед.
Приводим клиническое наблюдение.
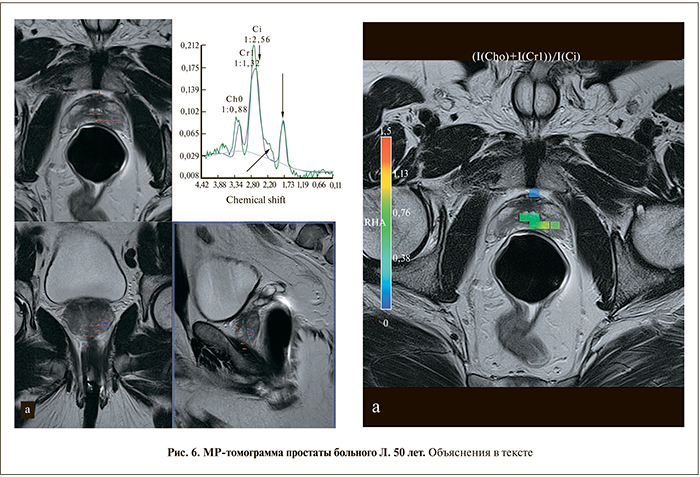
Б о л ь н о й Л. 50 лет. Жалоб не предъявлял. Хронический простатит и негативная трансректальная биопсия около месяца назад. Обследуется по поводу повышения уровня общего ПСА до 5,7 нг/мл. При пальцевом исследовании и ТРУЗИ подозрительных изменений не выявлено. На МРТ (рис. 6): простата уменьшена. Переходная зона не изменена. Периферическая зона: в основании, середине и верхушке обеих долей определяются нечеткие линейные и клиновидные зоны пониженного в Т2-сигнала (PI-RADS 2). На DWI (диффузионно-взвешенном изображении) – диффузное повышение сигнала на b=1200 без снижения ИКД (PI-RADS 2). На DCE (исследование с динамическим контрастированием) Т1-диффузное усиление интенсивности сигнала со вторым типом динамической кривой (PI-RADS 3). При МРС большинство вокселов не информативны (не окрашены). Пики метаболитов в просчитанных вокселах смещены влево. Вследствие этого в широком пике цитрата ошибочно выделяется креатин и при расчете соотношения Cho+Cr/Cit получаются ложно завышенные значения, будто указывающие на рак. Кроме этого слева от пика цитрата определяется небольшой горб и пик липидов на 1,7 ppm, свидетельствующие о недостаточной сатурации (стрелки).
В приведенном примере, вопреки бытующему мнению, мы не наблюдаем повышения пика холина, а видим, каким образом может искажаться спектр при хроническом воспалительном процессе. Таким образом, данный пример иллюстрирует важность сатурации для правильной интерпретации спектров и необходимость ручной корректировки данных при неправильной программной обработке.
Также сложна дифференциальная диагностика рака, локализующегося в переходной зоне, с доброкачественной гиперплазией стромального типа [22]. Для нее характерно критическое снижение концентрации цитрата, аналогичное той, которое наблюдается при раке. Повышение пиков холина при ДГПЖ объясняется, так же как и при раке, – высокой пролиферативной активностью. Таким образом, при гиперплазии стромального типа мы имеем право ожидать высокого соотношения Cho+Cr/Cit. Напротив, гиперплазия железистого типа не вызывает трудностей дифференциальной диагностики, поскольку сопровождается повышенной концентрацией цитрата.
Приведем клиническое наблюдение.
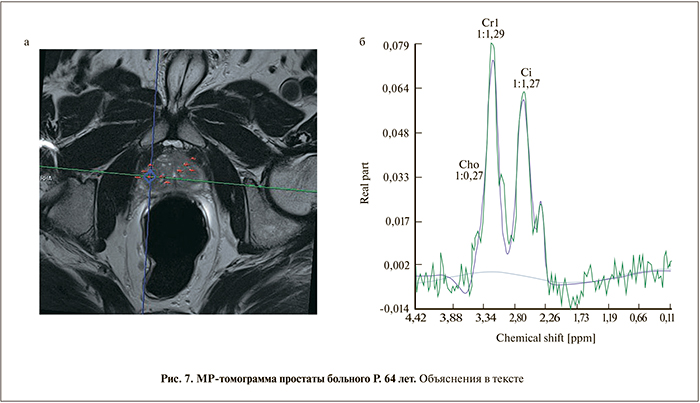
Б о л ь н о й Р. 64 лет. Уровень ПСА – 6,5 нг/мл. При пальцевом ректальном исследовании простата увеличена, данные трансректального УЗИ без особенностей. МРТ в Т2: простата увеличена за счет гиперплазии. Периферическая зона без подозрительных изменений (PI-RADS 2). На фоне гиперинтенсивной желези- стой гиперплазии в апикальных отделах переходной зоны имеется фокус пониженного в Т2-сигнала, демон- стрирующий высокий пик креатина – 1, 29 (рис. 7). Пик холина небольшой – 0,27, пик цитрата – 1,27. Соотношение Cho+Cr/Cit указывает на рак – 1,23 (PI-RADS 5), однако с учетом низкого пика холина наличие рака маловероятно. При трансректальной биопсии выявлена доброкачественная гиперплазия смешанного (железистостромального типа) с преобладанием в этой зоне гладкомышечных элементов.
Данный пример иллюстрирует важность отдельной интерпретации пиков метаболитов и игнорирование соотношения Cho+Cr/Cit. Мы обнаружили повышение пика креатина у 2 из 10 больных с доброкачественной гиперплазией стромального типа. По-видимому, это связано с преобладанием мышечных элементов в строме. А креатин, как известно, остается основным источником энергии в мышечной клетке.
Редкой разновидностью рака простаты, создающего трудности в МРТ-диагностике, является муцинозный рак [23]. Для него характерны высокая интенсивность сигнала на Т2-ВИ и слабый сигнал от метаболитов в спектре вследствие высокого содержания муцина и низкой клеточной плотности.
Заключение. Несомненно, из всех имеющихся в клинической практике методик МРТ-исследования простаты мультивоксельная спектроскопия наиболее сложная. Сложность ее выполнения заключается в необходимости тщательного соблюдения всех правил, к которым относятся подготовка больного, установка эндоректальной катушки, позиционирование VOI и блоков сатурации, ручное шиммирование и контроль результатов on-line. Только после этого можно начинать непосредственное измерение, продолжительность которого с учетом подготовки может достигать 20 мин. При этом даже при соблюдении всех правил нельзя быть абсолютно уверенным в том, что по окончании измерения мы получим качественный спектр в тех вокселах, которые нам нужны.
Получив качественные результаты с поддающимися интерпретации спектрами, мы все равно сталкиваемся с трудностями дифференциальной диагно- стики рака с доброкачественными изменениями. В дифференциальной диагностике рака с хроническим простатитом на первый план выступают данные клинического обследования. Вопрос дифференциальной диагностики рака с доброкачественной гиперплазией остается открытым. По-видимому, решающее значение имеют более тщательный анализ спектра и данные других МРТ-методик. Эти сложности ограничивают широкое применение МРС простаты.
На наш взгляд, наибольшей эффективности от методики можно ожидать в диагностике рака, локализованного в периферической зоне простаты, и в оценке динамики нехирургического лечения опухоли.


