Выявление, дифференциальная диагностика и последующее лечение заболеваний предстательной железы — первостепенные задачи современной клинической урологии. В структуре урологической патологии мужчин доминируют воспалительные и опухолевые болезни предстательной железы: до 10–15% пациентов страдают хроническим простатитом (ХП); более чем у 70% мужчин в возрасте старше 60 лет диагностируют доброкачественную гиперплазию предстательной железы (ДГПЖ); распространенность рака предстательной железы (РПЖ) в России составляет 31,6 на 100 тыс. взрослого мужского населения и имеет отчетливую тенденцию к росту (прирост с 2002 г. – 103,9%) [1]. Показатель смертности для РПЖ составляет 11,4 на 100 тыс. мужского населения, прирост с 2002 г. — 29,5 % [2] .
В мире РПЖ занимает 3–4-е место в структуре заболеваемости злокачественными новообразованиями, ежегодно регистрируют более 600 тыс. новых случаев РПЖ [3]. Данное заболевание широко распространено в России, характеризуется высокими темпами роста заболеваемости и смертности, обусловленными поздней диагностикой и большим числом пациентов с местнораспространенными и метастатическими формами РПЖ. Следовательно, разработка и внедрение в клиническую практику программ ранней диагностики РПЖ являются не только важной медицинской, но и большой социальной и экономической задачей государственного значения. Несмотря на положительные тенденции последних лет, внедрение программ скрининга, РПЖ впервые диагностируется на III–IV стадиях у 50–60% пациентов [2, 4].
Существующие методы диагностики и стадирования РПЖ, такие как пальцевое ректальное исследование (ПРИ), трансректальное ультразвуковое исследование (ТРУЗИ), магнитно-резонансная томография (МРТ) и биопсия предстательной железы, не всегда могут дать четкий ответ на вопрос о наличии и характере течения РПЖ, дифференцировать злокачественные изменения от доброкаче- ственных и воспалительных. До недавнего времени считалось, что проблему точной диагностики РПЖ решает определение уровня простатспецифического антигена (ПСА), однако в настоящее время представлены убедительные данные о недостаточной диагностической значимости этого маркера [5]. Качество ранней диагностики РПЖ остается низким, что определяет необходимость поиска как новых онкомаркеров, так и новых методов диагно- стики в целом.

Основным критерием агрессивности злокачественных новообразований, в том числе и РПЖ, является наличие метастазов. Метастазирование – многоступенчатый процесс, в ходе которого опухолевые клетки диссеминируют из первичной опухоли к отдаленным вторичным органам и тканям путем деградации базальной мембраны и экстраклеточного матрикса (ЭКМ). Разобщение компонентов ЭКМ достигается посредством действия нескольких протеолитических ферментов, основными из которых служат матриксные металлопротеиназы (ММР). В частности, ММП-9 разрушает основные компоненты внеклеточного матрикса: коллаген IV, фибронектин и ламинин, и может использоваться как маркер злокачественного фенотипа опухолей [6].
Ki-67 является маркером пролиферативной активности клеток, продукцию этого ядерного белка многие исследователи считают прогностическим фактором для большинства опухолей, включая и РПЖ [7]. Продукция ММР регулируется на уровне транскрипции генов, активации ферментов и торможением протеолитической активности тканевыми ингибиторами металлопротеиназ (TIMP) [8, 9], которые связываются с ММР и тормозят их активность, формируя комплекс с про-ММР-9, а это блокирует активирование последнего стромелизинами [10].
Высокая продукция TIMP-1 выявлена во многих опухолях, включая рак молочной железы, толстого кишечника, желудка, легких, а также при лимфомах [11, 12, 18, 19]. Продукция TIMP-1 в опухолевой ткани немелкоклеточного рака легких является независимым маркером плохого прогноза этого заболевания [18].

Целью настоящего исследования стало изучение продукции маркера пролиферации Ki-67, коллагена IV, ММР-9 и TIMP-1 в неизмененных клетках секреторного эпителия при ДГПЖ и атипических клетках аденокарциномы простаты различных градаций по шкале Глисона с целью анализа молекулярных механизмов инвазивного роста опухолевых клеток в предстательной железе.
Материалы и методы. В исследовании использован гистологический материал, полученный в ходе биопсии предстательной железы у 53 пациентов c аденокарциномой предстательной железы. Средний возраст больных составил 67 (52–83) лет. Контролем служил биопсийный материал 10 пациентов аналогичной возрастной группы с ДГПЖ.
Гистологическая оценка новообразований выполнена по шкале Глисона, балл 5 по которой соответствовал наиболее выраженным анапластическим изменениям клеток опухолевых желез в биоптате. Новообразование было оценено в 2 балла (2-я градация) у 10 больных, в 3 (3-я) – у 18, в 4 (4-я) – у 20 и 5 (5-я) – у 5. Всем пациентам также определен уровень общего ПСА в сыворотке крови. Материал фиксировали в 10%-ном нейтральном формалине (pH – 7,4), после проводки на гистопроцессоре заливали в парафин с температурой плавления 54°С. Для гистологического и иммуногистохимического исследования серийные срезы толщиной 5 мкм монтировали на стекла, покрытые поли-L-лизином. Для определения тканевых антигенов использовали очищенные антитела кроличьей антисыворотки к ММР-9 «Thermoscientific» 1:400; моноклональные кроличьи антитела к TIMP-1 «EPR 1550, EPITOMICS» 1:100; моноклональные мышиные антитела к коллагену IV «PHM-12, Thermoscientific» 1:100 и Ki-67 «MM1, Diagnostic Biosystems» 1:100. Выявление иммунных комплексов проведено с помощью безбиотиновой системы детекции на основе пероксидазы хрена «N-Histofine, Япония», срезы докрашивали гематоксилином Майера.
Оценка интенсивности иммуногистохимической реакции с MMP-9 и TIMP-1 осуществлена в соответствии со следующей градацией: 0 – отсутствие коричневых гранул в цитоплазме клеток, 1 – наличие отдельных мелких гранул в цитоплазме, 2 – распределение в отдельных клетках крупных гранул, 3 – наличие крупных гранул в цитоплазме большинства клеток. Распределение коллагена IV в базальной мембране желез простаты оценивали полуколичественным методом: 0 – отсутствие коллагена вдоль базальной мембраны, 1 – наличие тонкой полоски коллагена, 2 – толстая полоска коллагена вдоль базальной мембраны, сравнимая по толщине и интенсивности окрашивания стенки сосудов. Индекс пролиферации Ki-67 (ИП Ki-67) определен как отношение количества иммунореактивных ядер клеток к общему числу ядер в процентах.
Статистическая обработка полученных данных проведена с помощью программы STATISTICA 10.0 стандартными методами с определением средней арифметической (М) и среднего квадратического отклонения (σ). С учетом ненормального распределения отдельных статистических показателей сравнение двух независимых групп осуществлено непараметрическим методом при помощи U-критерия Манна–Уитни. Достоверными считали различия средних при уровне статистической значимости p< 0,05. Взаимоотношения между градацией опухоли по шкале Глисона, индексом пролиферации клеток, выраженностью экспрессии MMP-9 и TIMP-1 оценивали с помощью коэффициента корреляции Спирмена (rs).
Результаты и обсуждение. Иммуногистохимическое изучение ткани предстательной железы выявило особенности продукции белков, характеризующих пролиферативные процессы, распределение коллагена IV, ММР-9 и ее ингибитора в зависимости от градации опухолей по шкале Глисона.
В контрольных образцах ткани ДГПЖ отдельные клетки, окрашенные антителами к белку Ki-67, располагались только в базальном клеточном слое, пролиферативной активности клеток секреторного клеточного слоя не отмечено (рис. 1, а). В аденокарциноме различных градаций выявлен широкий спектр пролиферативной активности секреторных железистых клеток (рис. 1, в, д; табл. 1). В высокоинвазивных аденокарциномах 4-й и 5-й градаций нами отмечено увеличение пролиферативной активности атипических клеток по сравнению с аденокарциномами 2-й и 3-й градаций.
Таким образом, оценка пролиферативной активности анапластических клеток аденокарциномы различных градаций по шкале Глисона является чувствительным тестом для дифференциальной диагностики этих новообразований.
Инвазивные свойства опухолевых клеток связаны с разрушением коллагена IV соединительной ткани. При иммуногистохимическом исследовании коллаген IV выявлен вдоль базальной мембраны железистых клеток в виде тонкой коричневой полоски различной интенсивности.
Интенсивность иммуногистохимической реакции в соединительнотканной строме ДГПЖ соответ- ствовала 2 баллам, при этом были видны толстые коричневые полоски коллагена IV, распределяющегося вдоль базальной мембраны желез (рис. 1, б). Интенсивность иммуногистохимического окрашивания в препаратах с аденокарциномой предстательной железы зависела от градации опухоли по шкале Глисона. В образцах аденокарциномы 2-й градации реакция в соединительнотканной строме оказалась менее выраженной по сравнению с ДГПЖ и соответствовала 1 баллу, при этом тонкие волокна коллагена окружали отдельные клеточные элементы (рис. 1, г). С увеличением степени атипии коллагеновые волокна вокруг опухолевых клеток переставали определяться, коллаген IV сохранялся только в окружающей строме (рис. 1, е).

Последующие исследования были направлены на изучение механизмов протеолитической активности аденокарциномы предстательной железы, характеризующей инвазивный опухолевый рост, определяющих злокачественный опухолевый потенциал.
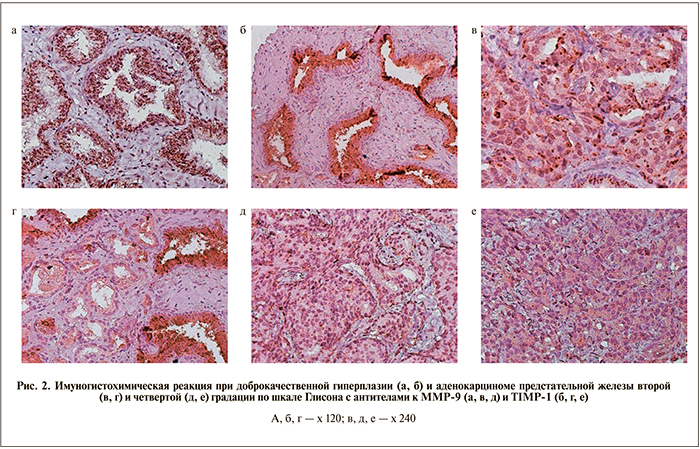
О наличии ММР-9 судили по содержанию в цитоплазме опухолевых клеток мелких или крупных гранул, имеющих разную степень окрашивания продуктами ДАБ-реакции. Так, в железистых клетках при ДГПЖ имела место выраженная иммуногисто- химическая реакция (интенсивность – 3 балла): в большом количестве определены крупные, средние и мелкие гранулы MMP-9 (рис. 2, а).
В аденокарциномах различных градаций интенсивность окрашивания была ниже, чем при ДГПЖ (см. таблицу 1); в цитоплазме секреторных клеток отмечались отдельные мелкие гранулы MMP-9 (рис. 2, в, д).
Как видно из представленных в табл. 1 данных, уровень продукции MMP-9 в опухолевых клетках снижался по мере нарастания в них анапластических изменений, при этом в аденокарциномах 2-й и 3-й градаций уровень продукции этого фермента стати- стически значимо в 2 раза превышал этот показатель в аденокарциномах 4-й и 5-й градаций. Нами не выявлено достоверных различий в продукции ММР-9 между аденокарциномами 2-й и 3-й, а также 4-й и 5-й градаций. По уровню продукции ММР-9 эти группы опухолей оказались идентичными.
Для дальнейшего изучения механизмов инвазии аденокарциномы были предприняты исследования продукции в опухолевых клетках белка, тормозящего активность ММР-9 в клетках, – TIMP-1.
В тканях ДГПЖ регистрировали выраженную иммуногистохимическую реакцию интенсивностью 3 балла: в секреторных клетках крупных желез в большом количестве были видны крупные, средние и мелкие гранулы TIMP-1 (рис. 2, б). При изучении аденокарциномы было выявлено снижение интенсивности иммуногистохимического окрашивания на TIMP-1. На рис. 2, г, е представлена иммуногистохимическая реакция в аденокарциноме предстательной железы с 2-й и 4-й градации по шкале Глисона. При этом в цитоплазме секреторных клеток отмечаются отдельные мелкие гранулы TIMP-1 (интенсивность – 1 балл) в неизмененных железах, которые в данном случае служат достоверным контролем. Как видно из табл. 1, уровень продукции TIMP-1 в аденокарциномах вне зависимости от градации был более чем в 3 раза меньше, чем в клетках при ДГПЖ. Нами не выявлено достоверных различий в продукции TIMP-1 между аденокарциномами различных градаций.
Таким образом, при ДГПЖ высокая продукция ММР-9 блокируется высоким содержанием TIMP-1. В аденокарциномах, несмотря на снижение продукции MMP-9, все же идет разрушение коллагена IV базальной мембраны железистых структур за счет отсутствия либо недостаточной продукции TIMP-1, блокирующего действие данного фермента на коллаген соединительной ткани. Низкой продукцией TIMP-1 в аденокарциномах, скорее всего, можно объяснить и инвазивные свойства этих опухолей.
Как видно из табл. 2, наблюдается умеренная положительная корреляционная связь между градацией по шкале Глисона и ИП Ki-67 (rs=0,674) (p≤0,05) и умеренная отрицательная корреляционная связь градации опухолей с уровнем продукции ММР-9 (rs=-0,660) (p≤0,05). Слабая достоверная отрицательная корреляция существует между уровнем пролиферативной активности клеток и продукцией секреторными опухолевыми клетками MMP-9 (rs=-0,369) (p≤0,05). Отсутствие достоверных корреляционных связей между продукцией TIMP-1 и другими клиническими, морфологическими и иммуногистохимическими показателями, вероятнее всего, свидетельствует о том, что уровень данного белка просто снижен в секреторных клетках аденокарциномы.
Заключение. В ходе проведенного исследования установлено, что по мере увеличения градации по шкале Глисона и повышения пролиферативной активности секреторных клеток аденокарциномы простаты происходит снижение выработки MMP-9. При этом инвазивные свойства опухолевых клеток, выражающиеся в разрушении коллагена IV базальной мембраны и соединительнотканной стромы простаты, можно объяснить нарушением баланса между MMP-9 и белком, блокирующим этот фермент, – TIMP-1, продукция которого существенно снижается в аденокарциноме различной градации.


