Введение. В эпоху растущей резистентности микробной флоры к антибактериальным препаратам и селекции штаммов, продуцирующих β-лактамазы широкого спектра (БЛШС), необходимо точно знать спектр патогенов и их устойчивость к антибиотикам.
В Китае, анализируя чувствительность 908 штаммов E. coli, выделенной из мочи, в течение 2004–2010 гг. установили, что всего 528 (58,1%) изолятов продуцировали БЛШС, причем если в 2004 г. их было 41,7%, то в 2010 – уже 60,9%. Наибольшую активность в отношении E. coli показали фосфомицина треметамол, пиперациллин-тазобактам, амикацин и имипенем. Установлена положительная корреляция между продукцией БЛШС и резистентностью к левофлоксацину [1].
 Другая большая группа китайских исследователей проанализировали спектр резистентности 1247 штаммов микроорганизмов семейства Enterobacteriaceae. Среди изолятов E. coli 64,3% продуцировали БЛШС, среди Klebsiella pneumonia таковых было 32,1%.
Другая большая группа китайских исследователей проанализировали спектр резистентности 1247 штаммов микроорганизмов семейства Enterobacteriaceae. Среди изолятов E. coli 64,3% продуцировали БЛШС, среди Klebsiella pneumonia таковых было 32,1%.
В 100% случаев E. coli была чувствительной к меропенему/имипенему, более чем в 90% – к амикацину. Однако свыше 60% штаммов E. coli оказались устойчивыми к ципрофлоксацину, левофлоксацину, цефтриаксону и цефотаксиму. Авторы отметили рост роли Acinetobacter baumannii (A. baumannii) как этиологического фактора урогенитальных инфекций (УГИ), при том что чувствительность этого возбудителя к карбопенемам не превышала 37% [2].
В Испании было выделено 31 758 уропатогенов, причем более половины (55,2%) из них пришлось на E. coli, Enterococcus faecalis был обнаружен в 18%, Klebsiella spp. – в 10,3% случаев. Чувствительность E. coli стабильно была наивысшей к имипенему (99,8%), амикацину (99,5%), нитрофурантоину (98,9%) и фосфомицину (100%). Хотя к цефуроксиму устойчивость за 7 лет наблюдения возросла с 67,8 до 86,4%, частота штаммов, резистентных к ципрофлоксацину и ко-тримоксазолу, существенно не изменилась (чувствительность соответственно 69,8–65,5%) [3].
В вопросе выбора антибиотика нельзя полностью полагаться на данные литературы, необходимо знать спектр микрофлоры и ее резистентность в своем регионе, причем иметь свежие (не старше двух лет) результаты бактериологических исследований, так как эти параметры чрезвычайно изменчивы.
Цель исследования – определить основной спектр возбудителей инфекций урогенитального тракта и их чувствительность к современным антибактериальным препаратам среди стационарных пациентов в динамике за 5 лет.
Материалы и методы. Проведено бактериологическое исследование мочи пациентов, находившихся в отделении урогенитальных форм туберкулеза Новосибирского НИИ туберкулеза Минздрава России и в урологическом отделении КГБУЗ ГКБ № 11 Барнаула. Материал для исследования собирали в стерильные одноразовые контейнеры и доставляли в бактериологическую лабораторию не позднее двух часов с момента сбора. Посев на питательные среды, выделение и идентификацию чистых культур проводили по стандартным методикам [4, 5].
Для идентификации микроорганизмов применяли методику времяпролетной масс-спектрометрии на масс-спектрометре «Microflex» (Bruker, Германия). Для части культур видовую идентификацию и определение антибиотикорезистентности проводили на комбинированных панелях BD PhoenixTM для грамотрицательных, грамположительных микроорганизмов и стрептококков с применением автоматической системы идентификации микроорганизмов и определения антибиотикочувствительности Phoenix 100 («Becton Dickinson», США).
Для стандартизированного диско-диффузионного метода использовали диски, импрегнированные антибиотиками, агар Мюллера–Хинтона и диспенсеры для нанесения дисков Bio-Rad (США).
Внутренний контроль качества определения чувствительности к антибиотикам осуществляли с использованием контрольных штаммов (ATCC – American Type Culture Collection), рекомендуемых МУК 4.2.1890-04 МЗ РФ серии LyfoCults Plus (bioMérieux, Франция). Внешний контроль качества осуществляли путем регулярного участия в соответствующих циклах федеральной внешней оценки качества.
Микрофлора была исследована в динамике за 5 лет – с 2009 по 2013 г., суммарно изучен 2621 штамм.
Результаты. Сопоставление основного спектра уропатогенной микрофлоры в динамике и между двумя центрами приведено в таблице.
Как следует из таблицы, пропорция выделенных микроорганизмов крайне нестабильна как в течение времени, так и при сравнении двух соседних областей. На обеих территориях максимальные показатели встречаемости грамотрицательной микрофлоры были в 2009 г.: 66,3% – в Новосибирске и 83% – в Барнауле; наименьшими – в 2011 и 2010 гг.: 35 и 36,4% соответственно. Минимальная доля грамположительных кокков была в 2009 г. в Барнауле (17%), максимальная – 63,6%, что в 3,7 раз выше буквально на следующий год в том же городе. В Новосибирске таких резких всплесков не отмечено, но двукратное увеличение доли грамположительных кокков среди уропатогенов с 25,7% в 2009 г. до 52,6% в 2011 г. также имело место.
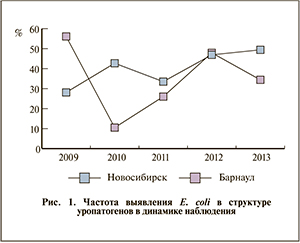
Вопреки распространенному мнению, будто основной возбудитель УГИ – E. coli, в нашем исследовании ее роль оказалась небольшой. В Барнауле максимальная доля E. coli среди всех уропатогенов составила 56,1% в 2009 г. (с 5-кратным падением на следующий год до 10,5%). В Новосибирске доля E. coli выросла с 28,1 в 2009 г. до 49,4% в 2013-м с необъяснимым провалом до 33,5% в 2011 г. (рис. 1).
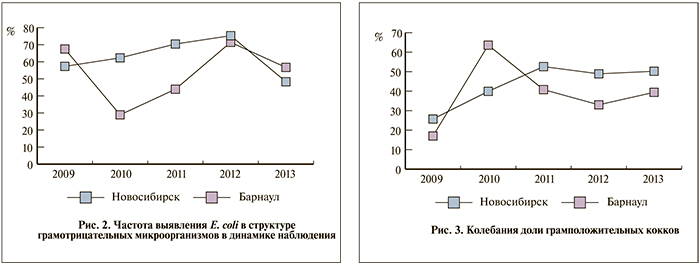
Вероятно, более корректно будет оценивать долю E. coli не в общей структуре микроорганизмов, вызывающих воспаление мочевых путей, а среди грамотрицательной микрофлоры. В этом аспекте также выявлены существенные колебания: доля E. coli была минимальной в 2010 г. в Барнауле (28,9%), максимальной (75,3%) – в 2012-м также в Барнауле; дать логичное объяснение подобному почти трехкратному всплеску не представляется возможным.
В Новосибирске уровень встречаемости E. coli демонстрировал небольшой, но уверенный рост с 2009 по 2012 г., однако в 2013 г. кривая неожиданно резко пошла вниз (рис. 2).
В отношении грамположительных кокков, если не считать всплеска в Барнауле в 2010 г., соотношение примерно одинаковое с преобладанием в Новосибирске (рис. 3).
В отношении пропорций грамположительных кокков тоже не удалось выявить какой-либо закономерности. В течение двух лет (2009–2010) в обоих центрах в структуре преобладали Enterococcus spp., за исключением 2011 г., когда ситуация поменялась на диаметрально противоположную с выходом на лидирующие позиции Staphylococcus spp. – также синхронно в обоих центрах. В 2012 г. пропорция восстановилась с преобладанием Enterococcus spp., а в 2013 г. соотношение между стафилококком и энтерококком практически уравнялось.
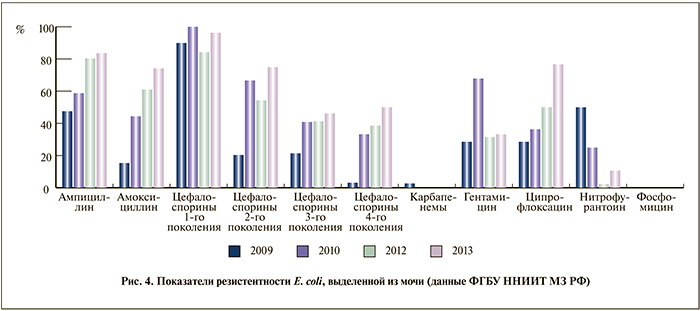
В лечении урогенитальных инфекций, особенно при выборе препарата для эмпирической терапии, прежде всего следует учитывать резистентность микроорганизмов к антибактериальным средствам. Поскольку основным возбудителем принято считать E. coli (хотя данные нашего исследования опровергают этот постулат), мы проследили динамику ее чувствительности за последние 5 лет (рис. 4).
Как видно из представленной диаграммы, отмечаются необъяснимые всплески резистентности в отдельные годы, например к гентамицину – в 2010 г. с возвращением в 2011 г. к исходным цифрам. Для нитрофурантоина зарегистрирована наибольшая резистентность в 2009 г. с постоянным снижением в течение всего срока наблюдения. Однако для прочих групп антибиотиков получен неуклонный рост устойчивости. Так, резистентность микрофлоры к цефалоспоринам 2-го поколения увеличилась в 3 раза, к ципрофлоксацину – в 2, к амоксициллину – в 7 раз. Вместе с тем практически не было штаммов, устойчивых к карбапенемам, и отмечена нулевая резистентность к фосфомицину – все штаммы в течение 5 лет сохраняли чувствительность к этому антибиотику.
Заключение. Видовой состав возбудителей УГИ в двух соседних регионах подвержен существенным колебаниям в отсутствие какой-либо закономерности. Уровень резистентности микрофлоры, напротив, логично нарастал – за пять лет увеличился по основным антибиотикам до 7 раз при сохранении низкой резистентности к нитрофурантоину, гентамицину и имипенему и нулевой – к фосфомицину.
Результаты проведенного исследования согласуются с международными данными о частичной утрате кишечной палочкой роли ведущего уропатогена, все большее значение приобретают грамположительные кокки, что необходимо учитывать при выборе препарата для эмпирической терапии. По-прежнему оптимальными антибиотиками и уросептиками для лечения больных острым неосложненным циститом остаются фосфомицин и нитрофурантоин, как это было показано нами ранее [6].


