Данные исследований, посвященных изучению экскреции гликозаминогликанов (ГАГ) с мочой при цистите различной этиологии, представленные в современной научной литературе, имеют противоречивый характер. С одной стороны, имеются работы, в которых указывается на повышение экскреции этих соединений с мочой при интерстициальном цистите [1–3] у человека и животных. Повышенная экскреция ГАГ отмечена также при ишемии мочевого пузыря, сопровождающейся гиперактивностью сфинктера [4]. В других публикациях авторами не выявлено существенного изменения экскреции ГАГ при интерстициальном цистите, сопровождающемся абдоминальным болевым синдромом [5]. Некоторые авторы указывают на невозможность точной дифференциации повреждения или регенерации эпителия мочевого пузыря по уровню экскреции с мочой сульфатированных ГАГ (с-ГАГ) [6].
Положительный опыт применения экзогенных источников с-ГАГ в качестве элемента заместительной терапии воспалительных процессов в мочевом пузыре известен с начала 1980-х гг. [7]. Кроме того, имеются рекомендации по применению препаратов, содержащих хондроитина сульфат для перорального использования, в качестве протекторов повреждения эпителиоцитов мочевого пузыря и экзогенного источника с-ГАГ при интерстициальном цистите [8]. Отмечено, что препараты ГАГ, в частности гиалуронат цинка, при внутрипузырном введении животным с экспериментальным интерстициальным циститом повышают функциональную активность эпителиоцитов и их способность к физиологической регенерации [9]. Таким образом, в настоящее время исследователями признается перспективность перорального применения препаратов, содержащих с-ГАГ для заместительной терапии воспалительного процесса в мочевом пузыре. Однако в научной литературе отсутствует информация о применении подобных препаратов в терапии геморрагического цистита, а также по уровню экскреции с-ГАГ при геморрагическом цистите как в эксперименте, так и при спонтанно протекающей патологии у человека и животных.
 Целью настоящего исследования явилось изучение экскреции ГАГ с мочой у крыс при экспериментальном геморрагическом цистите, индуцированном циклофосфамидом, а также при заместительной терапии препаратами гликозаминогликанов.
Целью настоящего исследования явилось изучение экскреции ГАГ с мочой у крыс при экспериментальном геморрагическом цистите, индуцированном циклофосфамидом, а также при заместительной терапии препаратами гликозаминогликанов.
Материалы и методы. Моделирование геморрагического цистита проведено на 35 белых лабораторных крысах. По принципу пар-аналогов было сформировано 7 групп животных, по 5 голов в каждой группе. Крыс группы 0 использовали как интактный контроль. Животным группы 0/2 внутрибрюшинно (в/б) вводили циклофосфамид (Эндоксан©) в дозе 80 мг на 1 кг массы тела однократно, после чего в течение 4 дней внутрижелудочно (в/ж) 1 р/день вводили комплексный препарат, содержащий сульфат хондроитина и глюкозамина гидрохлорид (ГГХ+ХС 1) в дозе 10 мг/кг. Крыс группы 1 использовали как позитивный контроль, им однократно в/б вводили циклофосфамид в дозе 100 мг/кг. Крысам группы 2 однократно в/б вводили циклофосфамид в дозе 100 мг/кг и далее в течение 4 дней в/ж 1 р/день препарат, содержащий глюкозамина гидрохлорид (ГГХ 50) в дозе 50 мг/кг. Животным 3-й группы однократно в/б вводили циклофосфамид в дозе 100 мг/кг и далее в течение 4 дней в/ж 1 р/день препарат, содержащий глюкозамина гидрохлорид (ГГХ 100) в дозе 100 мг/кг.
У крыс группы 4 моделировали субхроническую форму цистита, для чего производили четыре в/б инъекции циклофосфамида с интервалом 24 ч в дозе 50 мг/кг. Продолжительность наблюдения за животными группы 4 после последней инъекции циклофосфамида составила 72 ч. Крысам 5-й группы в/б однократно вводили циклофосфамид в дозе 100 мг/кг, после чего в течение 4 дней в/ж 1 р/день вводили комплексный препарат, содержащий сульфат хондроитина и глюкозамина гидрохлорид (ГГХ+ХС 3) в дозе 100 мг/кг.
Отбор проб суточной мочи от животных всех групп производили трехкратно, в том числе до начала эксперимента (точка 0), через 24 ч после индуцирования цистита и через 96 ч от начала эксперимента у животных групп 0, 0/2, 1, 2, 3, 5. Крысам группы 4 проводили отбор мочи с интервалом 24 ч непосредственно после инъекций раствора циклофосфамида (5 точек). Гликозаминогликаны в моче определяли спектрофотометрическим методом [10], адаптированным для 96-луночного планшета, используемого для иммуноферментного анализа. Метод основан на метахроматическом окрашивании раствора, содержащего сульфатированные ГАГ с 1,9-диметил-метиленовым синим (C18H22CINaS 0,5ZnCl2) «Голубой Тайлора», DMMB, (Sigma-Aldrich©). Для определения ГАГ использовали микропланшетный спектрофотометр Biotek Epoch (США).
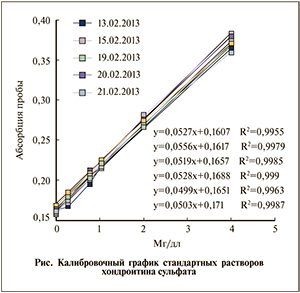
Для приготовления калибровочных растворов ГАГ использовали препарат Хондролон® (Микроген, Россия), содержащий 100 мг хондроитина сульфата. Для приготовления растворов 10 мг препарата растворяли в 100 мл деионизированной воды. Растворяли в течение 10 минут на магнитной мешалке и хранили в емкости из темного стекла с притертой пробкой. Маточный раствор содержал ГАГ в количестве 10мг/дл. Далее готовили растворы разной концентрации ГАГ, необходимые для построения калибровочного графика (табл. 1).
Раствор DMMB готовили растворением 11 мг препарата в 1 л 0,05 М ацетатном буфере. Для приготовления буферного раствора 6,8 г натрия уксуснокислого трехводного растворяли в 950 мл деионизированной воды и смешивали на магнитной мешалке в течение 15 мин до полного растворения. Уровень рН 4,75 устанавливали капельным добавлением 0,1 М соляной кислоты или 1 М гидроксида натрия. Конечный объем 1 л доводили деионизированной водой. Готовый раствор хранили в емкости из темного стекла с притертой пробкой. Для построения калибровочной кривой в лунки планшета вносили 250 мкл раствора DMMB и добавляли 25 мкл калибровочных растворов ГАГ. Показатели абсорбции считывали при длине волны 520 нм на микропланшетном спектрофотометре в течение 1 мин в трех повторах. Определяли средние значения абсорбции. Полученный калибровочный график сохраняет линейность до 4 мг/дл (см. рисунок).

Процедуру построения калибровочной кривой проводили перед определением ГАГ в пробах мочи. В качестве подготовительного этапа для определения ГАГ мочу центрифугировали в течение 10 мин при 2500 об/мин, супернатант использовали для проведения анализа. В лунки планшета вносили 250 мкл раствора DMMB и добавляли 25 мкл мочи. Показатели абсорбции считывали при длине волны 520 нм на микропланшетном спектрофотометре в течение 1 мин в трех повторах. Определяли средние значения абсорбции. В соответствии со значениями калибровочного графика определяли содержание с-ГАГ в моче в мг/дл.
Результаты. Основные результаты, отражающие концентрацию с-ГАГ в суточной моче животных в динамике эксперимента, представлены в табл. 2. Прием препаратов, содержащих ГАГ, в зависимости от вида препарата и применяемой дозы оказывает влияние на уровень экскреции ГАГ с мочой.
У животных групп 0/2 и 5, которые после индуцирования цистита принимали комплексный препарат ГАГ (ГГХ+ХС) в дозе 10 и 100 мг/кг, наблюдали статистически значимое повышение экскреции ГАГ в течение 24 ч (группа 0/2) или в течение 72 ч (группа 5).
При использовании высокой дозы препарата ГАГ 100 мг/кг регистрировали максимальный уровень выделения с-ГАГ с мочой – 3,03±0,26 мг/дл через 96 ч после индуцирования цистита и ежедневного приема препарата. Как показали наши исследования, при экспериментальном геморрагическом цистите использование для заместительной терапии только глюкозамина гидрохлорида в дозах 50 и 100 мг/кг в течение 72 ч после индуцирования геморрагического цистита практически не оказывает влияния на уровень экскреции с-ГАГ с выделяемой мочой. При этом наблюдается незначительное снижение уровня экскреции ГАГ с мочой (с 1,77 до 1,54 мг/дл и с 1,42 до 1,36 мг/дл соответственно).
Установлено снижение экскреции ГАГ в сроки от 0 до 72 ч после индуцирования острой формы цистита без терапии препаратами ГАГ (с 1,34 до 1,22 мг/дл). В модели хронического воспаления (группа 4) при многократном введении низких доз ЦФ (50 мг/кг) наблюдалось снижение уровня экскреции ГАГ в сроки от 0 до 72 ч (1,32±0,13 мг/дл) и повышение экскреции через 96 ч до концентрации 2,29±0,13 мг/дл после индуцирования цистита.
Обсуждение. Известно, что выделение с мочой ГАГ у человека и животных происходит преимущественно за счет с-ГАГ, и в частности хондроитина сульфата, в объеме до 2/3 от общего уровня выделения ГАГ [11]. Использование спектрофотометрического метода количественной оценки экскреции с-ГАГ по хондроитина сульфату в связи с этим является вполне обоснованным. Используя этот метод, зарубежные исследователи ранее выявили повышение уровня экскреции с-ГАГ при гломерулонефрите [12], мукополисахаридозе [13], ревматоидном артрите [14], а также у детей, больных первичным ночным энурезом [15]. Метод имеет предпосылки к дальнейшей оптимизации, что отмечается в работах, опубликованных в 2014 г. [16].

Повышение уровня экскреции с-ГАГ с мочой установлено при некоторых формах цистита, в частности при интерстициальном цистите [17]. Аналогичная информация в отношении неинфекционного геморрагического воспалительного процесса в мочевом пузыре в современной научной литературе не представлена. В наших исследованиях при экспериментальном геморрагическом цистите у крыс наблюдалось снижение экскреции с-ГАГ как при острой, так и при субхронической форме цистита в течение 72 ч после индуцирования цистита. Повышение уровня экскреции с-ГАГ констатировали при субхроническом течении воспалительного процесса не ранее чем через 96 ч после инициирования воспалительного процесса. Подобные факты, вероятно, являются отражением компенсационных процессов увеличения эндогенного синтеза ГАГ в ответ на развитие патологического процесса в мочевом пузыре.
Наблюдаемое в нашем эксперименте значительное увеличение уровня экскреции с-ГАГ с мочой при пероральном применении высоких доз препаратов ГАГ согласуется с результатами более ранних экспериментальных работ по оценке уровня экскреции с-ГАГ у кошек [18]. Авторами указанной работы было установлено, что ежедневный на протяжении 21 дня пероральный прием N-ацетил-глюкозамина в дозе 250 мг кошками, больными интерстициальным циститом, приводит к статистически значимому повышению концентрации с-ГАГ как в плазме крови, так и в моче [18].
Таким образом, впервые проведена количественная оценка экскреции сульфатированных гликозаминогликанов, в частности хондроитина сульфата, с мочой при геморрагическом цистите, индуцированном циклофосфамидом, и терапии различными препаратами ГАГ. Экспериментальный «циклофосфамидный цистит» у лабораторных животных в настоящее время считается допустимой моделью для изучения патогенеза острой формы интерстициального цистита [19], а также цистита, связанного с проведением химиотерапии новообразований препаратами алкилирующего типа, такими как циклофосфамид и ифосфамид [20].
Использование спектрофотометрического метода количественного определения с-ГАГ в моче при геморрагическом цистите в перспективе также может рассматриваться как инструмент первичного скрининга на содержание с-ГАГ при неинфекционном воспалительном процессе в мочевом пузыре у человека в ходе проведения заместительной терапии препаратами гликозаминогликанов.


