Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) – одно из наиболее распространенных заболеваний у мужчин пожилого и старческого возраста [1]. Несмотря на возможности современной медикаментозной терапии, до 30% мужчин за период от 40 до 80 лет переносят оперативное лечение по поводу ДГПЖ [2].
В российских урологических клиниках лечение ДГПЖ у 65–70% больных проводится хирургическим методом, при этом стандартом оперативного лечения остаются травматичная, связанная с высоким риском интра- и послеоперационных осложнений открытая аденомэктомия (27,2% операций) и трансуретральная резекция простаты (ТУРП) – 27,8%. Она наиболее эффективна и показана при объеме предстательной железы (ПЖ) от 30 до 80 см3 [3, 4].
Некоторые новые технологии позволяют выполнять операцию и при большем объеме ПЖ. Например, плазмокинетическая ТУРП, преимущество которой состоит в формировании вокруг режущей петли резектоскопа феномена плазменной короны, которая быстро и точно удаляет ткань, в то же время уплотняя подлежащую ткань с остановкой кровотечения и вапоризацией. Эффективный интраоперационный гемостаз позволяет за одно и то же время резецировать больший объем ткани. Однако все это не избавляет пациента от анестезиологического риска [5]. Учитывая то, что ДГПЖ – заболевание того жизненного периода мужчин, в котором с каждым годом прогрессивно увеличивается отягощенность сопутствующей патологией, вопрос о методе оперативного лечения больных ДГПЖ при объеме простаты более 80 см3 остается открытым.
За последние годы отмечается повышенный интерес врачей различных специальностей к эндоваскулярной хирургии. К достоинствам эндоваскулярных вмешательств относятся минимальная инвазивность, низкий операционный риск, быстрое восстановление пациентов, отсутствие необходимости в проведении анестезиологического пособия, возможность проведения пожилым людям и пациентам с тяжелой соматической патологией.
Первоначально эндоваскулярная эмболизация в урологии использовалась для остановки опасных для жизни кровотечений из мочевого пузыря и ПЖ [6].
В 2010 г. португальские исследователи во главе с J. Pisco представили данные по результатам нового метода лечения ДГПЖ – эмболизации артерий простаты. Метод оказался технически успешным для 14 (93,3%) из 15 пациентов [7]. Отечественные исследователи [8] в 2010 г. представили данные 40 больных с высоким риском оперативного вмешательства по эмболизации простатических артерий. Результатом эмболизации стало снижение выраженности клинических проявлений, уменьшение объема ПЖ на 50%, объем аденоматозного узла на 43%. О высокой эффективности эмболизации свидетельствуют работы и других авторов [9–11].
 В 2014 г. опубликованы результаты сравнительных исследований, посвященных оценке эффективности эндоваскулярной эмболизации (n=57) и трансуретральной резекции (n=57) при ДГПЖ. Эффект лечения был достигнут в 100% наблюдений в группе ТУРП и в 94,7% – в группе эмболизации [12].
В 2014 г. опубликованы результаты сравнительных исследований, посвященных оценке эффективности эндоваскулярной эмболизации (n=57) и трансуретральной резекции (n=57) при ДГПЖ. Эффект лечения был достигнут в 100% наблюдений в группе ТУРП и в 94,7% – в группе эмболизации [12].
Целью настоящего исследования было оценить эффективность и безопасность суперселективной эмболизации простатических артерий как самостоятельного метода лечения больных ДГПЖ, а также как метода предоперационной подготовки перед ТУРП.
Материалы и методы. С 2004 по 2014 г. на базе отделения рентгеноперационных методов диагностики и лечения Краевой клинической больницы обследованы и пролечены 59 пациентов с ДГПЖ. Возраст больных составил 68,2±6,2 года, объем ПЖ варьировался от 35 до 296 см3. Все пациенты были проинформированы о преимуществах и возможных осложнениях при проведении процедуры, об альтернативных методах лечения. Подавляющее большин-ство пациентов имели сопутствующие заболевания – сахарный диабет, избыточную массу тела, патологию сердечно-сосудистой системы, что в значительной степени увеличивало риск оперативного лечения общепринятыми методами.
Пациенты подвергались анкетированию по международной системе суммарной оценки симптомов при заболеваниях ПЖ (I-PSS), оценке качества жизни QoL. Объем ПЖ и узла определяли в ходе трансректального УЗИ (ТРУЗИ). Перед оперативным вмешательством у всех больных определяли уровень простатспецифического антигена (ПСА) в крови, в сомнительных случаях выполняли пункционную биопсию ПЖ.
Для анализа качества мочеиспускания проводили урофлоуметрию.
Критерии исключения для проведения эмболизации:
- непереносимость рентгенконтрастных веществ;
- наличие острых инфекционно-воспалительных заболеваний;
- декомпенсированные заболевания внутренних органов (сердечно-сосудистой системы, паренхиматозных органов);
- декомпенсированная патология эндокринной системы;
- нарушения сердечного ритма независимо от причины;
- тяжелая форма бронхиальной астмы;
- состояние после перенесенного инфаркта миокарда или острого нарушения мозгового кровообращения в срок до 6 мес;
- наличие флотирующих тромбов в бассейне вен нижних конечностей;
- анемия тяжелой и средней степени;
- окклюзионно-стенотические поражения подвздошных сосудов;
- аномалии анатомического строения подвздошных сосудов, не позволяющие выполнять операцию.
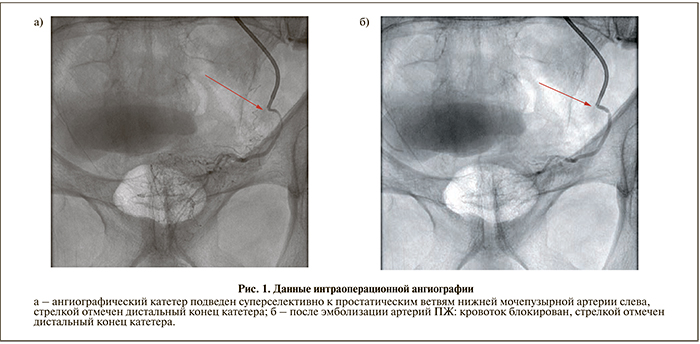
Эмболизация простатических артерий проведена под местной анестезией трансфеморальным либо чресплечевым доступом по методике Сельдингера. Под рентгеновским контролем выполнена суперселективная катетеризация ветвей внутренней подвздошной артерии (рис. 1 а). Затем осуществлена эмболизация сосудов, питающих ПЖ, с использованием микрокатетерной техники с введением микросфер EmboGold (Merit Medical Systems Inc., США) размером 100–300 мкм или 300–500 мкм до полной блокады кровотока (рис. 1 б).

Диаметр микросфер определен диаметром артерий, питающих предстательную железу. Для катетеризации применены катетеры конфигурации Roberts5F или Cobra5F, которые выступали в роли проводникового катетера. Через просвет проводникового катетера провели микрокатетер на микропроводнике. После эмболизации артерий простаты с одной стороны проводниковый катетер 5F установили в контра- либо ипсилатеральную артерию в зависимости от доступа и процедуру повторили. В ряде случаев требовалась пункция обеих бедренных артерий с проведением проводникового катетера контралатерально.
Эффективность лечения оценивали через 6, 12 и 24 мес после процедуры.
 Для предупреждения и уменьшения выраженности болевого синдрома перед вмешательством и после операции в течение 7 дней больным назначали нестероидные противовоспалительные препараты в стандартных дозировках.
Для предупреждения и уменьшения выраженности болевого синдрома перед вмешательством и после операции в течение 7 дней больным назначали нестероидные противовоспалительные препараты в стандартных дозировках.
Данные подвергали статистической обработке посредством программы Statistica 10.0 и пакета прикладных программ, встроенного в программную среду Microsoft Exel 2010.
Результаты. При поступлении все пациенты имели симптомы нижних мочевых путей различной степени выраженности, не купируемые лекарственными препаратами. Индекс I-PSS в среднем составил 18 баллов, уровень общего ПСА – 1,52 нг/мл. При урофлоуметрии констатировали «обструктивный» тип кривой, максимальная скорость мочеиспускания (Qmax) составила 5,9 мл/с, объем ПЖ по данным ТРУЗИ – 104,56±53,7 см3, объем узла – 70,34±21,2 см3.
В послеоперационном периоде у 63% больных наблюдались явления так называемого постэмболизационного синдрома, проявлявшегося умеренными болями в области промежности, резями по ходу уретры при мочеиспускании, в небольшом проценте случаев – субфебрилитетом не более суток. Остальные (47%) больные не испытывали никакого дискомфорта в послеоперационном периоде.
У 1 больного в послеоперационном периоде развилась острая задержка мочеиспускания, что потребовало троакарной цистостомии.
К 6-му месяцу наблюдения статистически значимо снизилась оценка по шкале I-PSS, увеличилась максимальная скорость мочеиспускания (см. таблицу). Эта тенденция сохранилась и в течение последующего полугодового периода. По результатам наблюдения за пациентами в течение 24 мес после эмболизации констатирован стабильный эффект. Объем предстательной железы и узлового образования в среднем уменьшился на 53 и 47% соответственно; максимальный эффект – уменьшение объема ПЖ на 82%.
По истечении срока наблюдения выделилась группа из 17 (28,8%) пациентов. Соматический статус этих пациентов не позволял выполнять открытое оперативное вмешательство, но после эмболизации стало возможным проведение ТУРП за счет уменьшения объема железы менее 80 см3 благодаря эмболизации простатических артерий. Помимо редукции объема ПЖ критериями включения в данную группу стали наличие нижеуказанных факторов или их сочетание: сохранение выраженных СНМП (I-PSS более 15 баллов), Qol более 3, значение Qmax менее 12 мл/с.
У всех больных данной группы мочеиспускание восстановлено не позднее 2 сут после вмешательства, результаты долгосрочного наблюдения – 6 и более мес достоверно не отличались от таковых после стандартной ТУРП по данным других исследований.
Приводим клиническое наблюдение.
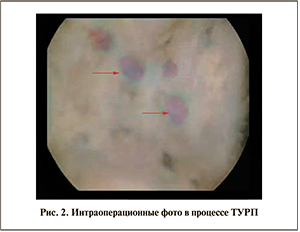
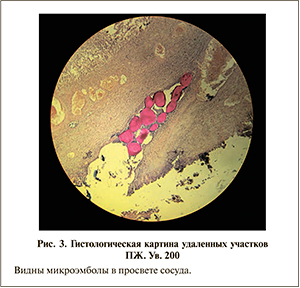
Б о л ь н о й Ш. 74 лет поступил в отделение рентгенологических методов диагностики и лечения № 2 Алтайской краевой клинической больницы с жалобами на ноктурию, ослабление струи мочи, ощущение неполного опорожнения мочевого пузыря. Данные обследования на амбулаторном этапе: объем ПЖ 116 см3, размер узла 58,81 см3, васкуляризация образования средняя. Множественные дивертикулы мочевого пузыря. Объем остаточной мочи 299,4 мл, уровень общего ПСА 4,4 нг/мл. Консервативная терапия в течение более 6 мес без эффекта. Сопутствующие заболевания: гипертоническая болезнь II стадии III степени, риск 4, гипертрофия левого желудочка. Язвенная болезнь двенадцатиперстной кишки, ремиссия. От предложенной чреспузырной аденомэктомии больной отказался, в связи с чем было предложено выполнить суперселективную эмболизацию артерий ПЖ. Процедура была успешно выполнена по описанной выше методике, проявлений постэмболизационного синдрома больной не отметил. За 1-е сутки после эмболизации развилась острая задержка мочеиспускания, консервативным путем мочеиспускание восстановить не удалось, поэтому была выполнена троакарная цисто-стомия. При обследовании через 2 мес констатирована выраженная редукция объема ПЖ с 116 до 54 см3. С учетом положительной динамики цистостомический свищ был заживлен, мочеиспускание восстановлено, однако качество мочеиспускания, несмотря на значительное улучшение (значение индекса I-PSS снизилось с 25 до 12), не устраивало больного. В связи с чем больному была предложена ТУРП с учетом уменьшения размера ПЖ. Оперативное вмешательство проходило с минимальной кровоточивостью резецируемой ткани, периодически визуализировались микроэмболы, заполнявшие просвет кровеносных сосудов (рис. 2). Гистологическое заключение: доброкачественная железисто-стромальная гиперплазия простаты. Часть сосудов с эмболами, эпителий ацинусов десквамирован, некротизирован, очаговые некрозы фиброзной ткани с лимфолейкоцитарной инфильтрацией (рис. 3). Результаты контрольного обследования через 2 мес: Qmax 18 мл/с, индекс I-PSS 3, QoL 1. В настоящее время пациент находится под динамическим наблюдением.
Обсуждение. Эмболизация простатических артерий при ДГПЖ – относительно новый и эффективный метод лечения, расширяющий возможности оказания медицинской помощи различным группам пациентов. Причем она продемонстрировала свою эффективность и безопасность не только как метод лечения при ДГПЖ, но и как способ предоперационной подготовки пациентов с большим объемом железы, позволяющий расширить показания к выполнению эндоскопических вмешательств. Кроме того, по данным исследований зарубежных авторов, выполнение эмболизации простатических артерий не сопровождается развитием такого побочного явления, характерного для других методов хирургического лечения, как ретроградная эякуляция, что позволяет рассматривать данную методику как метод выбора в лечении молодых пациентов, желающих сохранить физиологичную репродуктивную функцию [11]. В данном направлении необходимы дополнительные исследования.
Дальнейшее изучение этого метода позволит отработать методику, точно определить показания и противопоказания к применению, широко внедрить в практическое здравоохранение.


