Введение. Изучение механизмов регуляции мочеобразования при симптомах нижних мочевых путей (НМП), широко распространенных в популяции как среди мужчин, так и среди женщин разного возраста, остается актуальной проблемой. У женщин такие симптомы связаны с анатомическими особенностями НМП, их функционированием в течение жизни, из-за чего не всегда обеспечивается надежное удержание мочи [1, 2]. У мужчин основной причиной возникновения симптомов НМП служит доброкачественная гиперплазия предстательной железы [3].
 К одной из наиболее частых причин нарушения мочеиспускания относится синдром гиперактивного мочевого пузыря (ГАМП). По данным исследований, проведенных в Европе и США, симптомы ГАМП отмечаются не менее чем у 17% населения после 40 лет, причем частота симптомов увеличивается с возрастом и достигает 50% у лиц старше 70 лет [4]. Гиперактивный мочевой пузырь значительно снижает качество жизни и заставляет ограничивать социальную активность.
К одной из наиболее частых причин нарушения мочеиспускания относится синдром гиперактивного мочевого пузыря (ГАМП). По данным исследований, проведенных в Европе и США, симптомы ГАМП отмечаются не менее чем у 17% населения после 40 лет, причем частота симптомов увеличивается с возрастом и достигает 50% у лиц старше 70 лет [4]. Гиперактивный мочевой пузырь значительно снижает качество жизни и заставляет ограничивать социальную активность.
Основная часть исследований по проблеме ГАМП посвящена лечению лиц с данным синдромом, тогда как причины его возникновения остаются малоизученными [5, 6].
Среди теорий возникновения ГАМП основными являются нейрогенная и миогенная [7–9].
За последнее время все чаще стали появляться данные о том, что индивидуальные показатели исходного тонуса вегетативной нервной системы (ВНС) служат решающим фактором развития той или иной патологии [10].
И.И. Григорашвили (2009), изучая значение дисфункции ВНС при идиопатическом ГАМП, обнаружила преобладание надсегментарных симпатических влияний и охарактеризовала вегетативный баланс при ГАМП как напряженный с участием эрготропных систем и снижением вагальных механизмов регуляции [19].
Кроме того, существуют работы, посвященные оценке влияния дефицита эстрогенов на развитие симптомов НМП [6, 11, 12]. В то же время в доступной нам литературе мы не обнаружили исследований, целью которых было изучение гормональных влияний на развитие симптомов ГАМП.
Вследствие недостаточной изученности патогенеза данного заболевания возникают сложности в его терапии, которая носит эмпирический характер и далеко не всегда оказывается эффективной [13].
Таким образом, высокая распространенность синдрома ГАМП, нежелание современных женщин мириться с данной проблемой и недостаточная изученность механизмов регуляции определили тему этого исследования.
 Цель исследования: изучить индивидуальные параметры гормонального фона у женщин с синдромом ГАМП в разные периоды репродуктивной функции, имеющих различный исходный тонус вегетативной нервной системы.
Цель исследования: изучить индивидуальные параметры гормонального фона у женщин с синдромом ГАМП в разные периоды репродуктивной функции, имеющих различный исходный тонус вегетативной нервной системы.
Материалы и методы. Исследования проведены на базе лаборатории «Физиология экстремальных состояний» кафедры анатомии и физиологии человека Курганского государственного университета в 2010–2013 гг. Урологическое обследование выполнено в урологическом отделении Курганской областной клинической больницы и в городской больнице № 5 г. Кургана.
В исследовании приняла участие 121 женщина в возрасте 23–65 лет. В основную группу были включены 59 женщин с синдромом ГАМП. Контрольную группу составили 62 здоровые женщины. Все исследования проведены при обязательном письменном согласии обследуемых в строгом соответствии и с соблюдением биоэтических норм, рекомендованных Российским комитетом по биоэтике при Комиссии РФ по делам ЮНЕСКО. В каждой группе были выделены две подгруппы: первую составили женщины репродуктивного периода в возрасте от 23 до 45 лет, вторую – периода мено- и постменопаузы в возрасте 46–65 лет.
Критериями включения в основную группу было соответствие характеристикам ГАМП, изложенным в определении ISC (2002): наличие ургентных позывов и/или ургентного недержания, учащенного мочеиспускания, а также продолжительность заболевания не менее полугода. Критерии невключения: симптомы стрессового недержания мочи, острые и хронические воспалительные заболевания НМП, камни, опухоль мочевого пузыря, наличие остаточной мочи (более 40 мл) по данным УЗИ, лучевая терапия на тазовую область в анамнезе, заболевания эндокринной системы, органическое поражение центральной и периферической нервной системы, беременность, применение в течение последних 3 месяцев препаратов, оказывающих влияние на симптомы ГАМП и деятельность ВНС (М-холиноблокаторы, М-холиномиметики, α-адреноблокаторы, β-адреноблокаторы, антидепрессанты, нейролептики, транквилизаторы, блокаторы кальциевых каналов).
С целью выявления женщин, соответствующих вышеперечисленным критериям, всем женщинам проведено комплексное урологическое, неврологическое и гинекологическое обследование с применением клинических, лабораторных и инструментальных методов.
После подробного выяснения анамнеза все женщины заполнили дневник мочеиспускания и ответили на вопросы шкалы Международной системы суммарной оценки заболеваний предстательной железы (I-PSS) и опросника OAB awareness tool (опросник для оценки симптомов ГАМП).
План обследования в обязательном порядке предусматривал общий анализ мочи и бактериологическое исследование мочи по стандартной методике, определение уровня глюкозы в крови натощак. Кроме того, с целью исключения других урологических заболеваний с симптоматикой, схожей с таковой при ГАМП, выполнено УЗИ почек, мочевого пузыря с определением количества остаточной мочи после мочеиспускания, оценкой размеров почек, состояния паренхимы почек, чашечно-лоханочной системы, контура мочевого пузыря, его содержимого.
По результатам всех вышеперечисленных исследований была сформирована группа из 59 женщин с синдромом ГАМП.
Тонус ВНС оценен методом ритмокардиографии. Результаты анализировали согласно рекомендациям Европейского кардиологического общества, Северо-Американского общества по электрофизиологии и методическим рекомендациям российских экспертов [14, 15].
 На основании показателей вариабельности сердечного ритма были выделены подгруппы женщин в зависимости от преобладающего исходного тонуса ВНС: ваготоники, нормотоники и симпатотоники.
На основании показателей вариабельности сердечного ритма были выделены подгруппы женщин в зависимости от преобладающего исходного тонуса ВНС: ваготоники, нормотоники и симпатотоники.
Согласно цели исследования, всем женщин осуществлен забор крови из локтевой вены в утренние часы натощак. В сыворотке крови с помощью иммуноферментного фотометра Эфос и реактивов определена концентрация лютеинизирующего гормона, фолликулостимулирующего гормона, кортизола, тестостерона, пролактина, прогестерона, окситоцина, вазопрессина («Алкор-Био», Россия), адренокортикотропного гормона – АКТГ («Biomerica», США), эстрадиола, альдостерона («DRG», Германия) и электролитов К+ и Na+ ионоселективным методом на аппарате Easystyle (США).
Полученные данные обработаны методом вариационного анализа (Лакин Г. Ф., 1990; пакет программ Statistica 5.11).
Результаты. Полученные нами результаты математического анализа вариабельности сердечного ритма позволили охарактеризовать фоновый уровень вегетативного статуса у обследованных женщин. В отношении симпатотоников и ваготоников преобладали симпатические и парасимпатические влияния соответственно, тогда как у нормотоников их вклад был равнозначным.
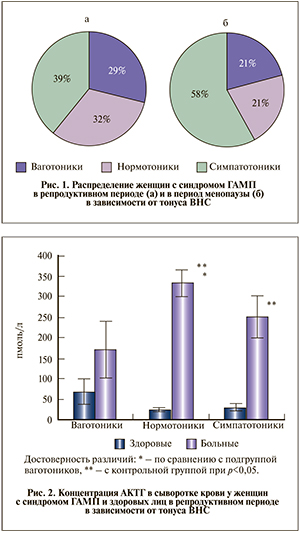
Установлено, что у женщин с ГАМП симпатический тонус ВНС преобладает как в репродуктивном периоде, так и в период мено- и постменопаузы, когда его влияние становится максимальным. Так, в репродуктивном периоде выявлено 39% женщин-симпатоников (рис. 1, а), тогда как в период менопаузы симпатический тонус преобладал уже у 58% женщин с синдромом ГАМП (рис. 1, б). Полученные результаты позволили оценить вегетативный тонус при ГАМП как напряженный со снижением вагальных механизмов регуляции.
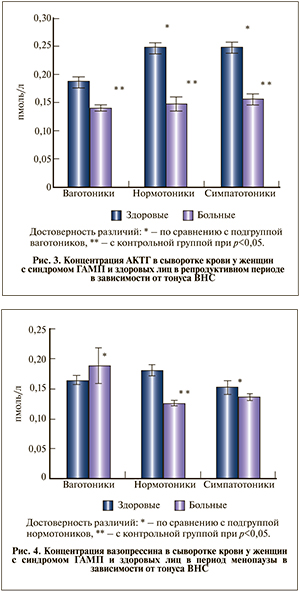
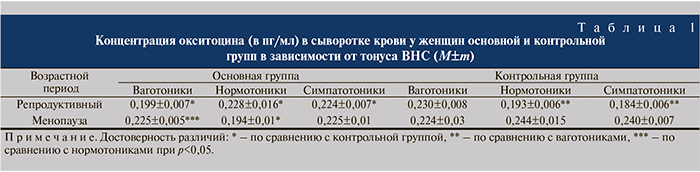
Уровень АКТГ в сыворотке крови женщин в репродуктивном периоде во всех подгруппах был многократно повышен (p<0,05; рис. 2). Максимальных значений концентрация АКТГ достигла в группе нормотоников – 332,18±32,28 пмоль/л и была статистически значимо выше значений контрольной группы – 25,9±4,49 пмоль/л. Таким образом, у женщин с ГАМП в репродуктивном периоде отмечается напряжение механизмов регуляции, которое ассоциируется с высокой секрецией АКТГ. При этом секреция вазопрессина, находящаяся под прямым контролем нервных импульсов, была снижена (рис. 3). Так, уровень вазопрессина в подгруппе ваготоников был достоверно ниже, чем у здоровых лиц данной подгруппы, – 0,140±0,005 и 0,186±0,010 пмоль/л соответственно. В подгруппе нормотоников концентрация вазопрессина у женщин с ГАМП составила 0,148±0,012 пмоль/л, а у женщин контрольной группы – 0,247±0,009 пмоль/л. В группе симпатотоников уровень исследуемого гормона у женщин с ГАМП 0,156±0,009 пмоль/л был также достоверно ниже, чем у здоровых женщин, – 0,248±0,010 пмоль/л. Хорошо известна способность вазопрессина высвобождать АКТГ, дисбаланс вегетативных влияний при синдроме ГАМП проявляется в модуляции активности ядер гипоталамуса и нарушении регуляции диуреза.
Нам не удалось выявить межгрупповых различий в зависимости от исходного тонуса ВНС у женщин с синдромом ГАМП. Полученные данные свидетель ствуют о том, что главенствующую роль в генезе синдрома в репродуктивном периоде играет гуморальная регуляция выработки гормона.
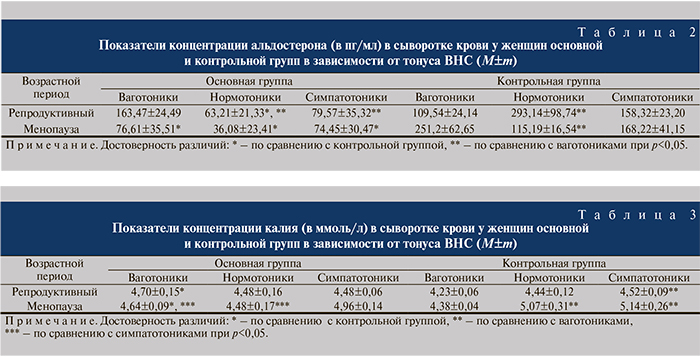
Если у женщин с синдромом ГАМП в репродуктивном периоде во всех исследуемых группах независимо от тонуса ВНС отмечен дефицит выработки вазопрессина, то в период мено- и постменопаузы достаточный уровень гормона констатировали при ваготонии – 0,188±0,029 пмоль/л (рис. 4).
Таким образом, с возрастом и инволюцией репродуктивной системы происходит и изменение концентрации вазопрессина в зависимости от модуляции ядер гипоталамуса. В репродуктивном возрасте имеют место нарушения гуморальных механизмов регуляции вазопрессина, тогда как в период менопаузы решающее значение отводится нервному механизму регуляции мочевыделения.
Окситоцин – нейрогипофизарный гормон, который синтезируется в супраоптическом и паравентрикулярном ядрах гипоталамуса. Окситоцин является многофункциональным гормоном, посредством выработки которого организм соответствующим образом реагирует на изменения окружающей среды.

Установлено, что концентрация окситоцина в сыворотке крови здоровых лиц репродуктивного возраста преимущественно определялась влиянием парасимпатической нервной системы, а при синдроме ГАМП чаще констатировали нормо- и симпатотонус, при этом колебания уровня данного гормона незначительны. Максимальный же уровень окситоцина у женщин с ГАМП в период мено- и постменопаузы ассоциирован с ваготонусом в отличие от женщин репродуктивного периода (табл. 1).
Кортизол – гормон коркового слоя надпочечников обнаружил рост концентрации у женщин с синдромом ГАМП репродуктивного периода в ряду ваготоники–нормотоники–симпатотоники вне зависимости от периода репродуктивной функции. Максимальный уровень кортизола был ассоциирован с симпатическим тонусом ВНС как в репродуктивном периоде (494,9±48,3 нмоль/л), так и в период мено- и постменопаузы (495,38±50,15 нмоль/л; р<0,05). Активация симпатико-адреналовой системы способствует увеличению выведения воды и электролитов.
Альдостерон – минералокортикоидный гормон, регулирующий водно-солевой обмен в организме. Уровень альдостерона у женщин репродуктивного возраста с ГАМП в подгруппе нормотоников был статистически значимо ниже, чем в контрольной группе, составив 63,21±21,33 и 293,14±98,74 пг/мл соответственно. Кроме того, наблюдалась тенденция к снижению концентрации альдостерона при синдроме ГАМП у женщин-симпатотоников (табл. 2). Содержание альдостерона в сыворотке крови женщин с синдромом ГАМП в период мено- и постменопаузы было значимо ниже такового у здоровых женщин независимо от тонуса ВНС. Итак, гипосекреция альдостерона отмечена у женщин с синдромом ГАМП как в репродуктивном периоде, так и в период мено- и постменопаузы. При недостатке альдостерона ионы натрия и вода выводятся из организма, что обусловливает повышение диуреза и частоты мочеиспускания, имеющих место, в частности, при синдроме ГАМП. Снижение уровня циркулирующего альдостерона может рассматриваться как истощение коры надпочечников у больных ГАМП в результате высокой секреции АКТГ.
Концентрация калия в сыворотке крови у женщин в репродуктивном периоде в подгруппе ваготоников была статистически значимо выше у женщин с ГАМП – 4,70±0,15 против 4,23±0,06 ммоль/л в контрольной группе. Необходимо также отметить, что тенденция к гиперкалиемии при синдроме ГАМП просматривалась и у женщин с симпатическим тонусом ВНС в период мено- и постменопаузы (табл. 3).
Таким образом, склонность к повышению уровня калия в сыворотке крови наряду с гипоальдостеронизмом указывает на роль этих факторов в генезе синдрома ГАМП. Достоверных различий концентрации ионов натрия в зависимости от тонуса ВНС в сыворотке крови женщин с синдромом ГАМП мы не обнаружили ни в репродуктивном периоде, ни в период мено- и постменопаузы. Однако у женщин с синдромом ГАМП в период менопаузы имелась тенденция к снижению уровня ионов натрия в сыворотке крови, что также подтверждает теорию гипоальдостеронизма при синдроме ГАМП (рис. 5).
По результатам наших исследований, минимальные значения прогестерона при синдроме ГАМП у женщин в репродуктивном периоде были ассоциированы с симпатическим тонусом ВНС. Так, концентрация прогестерона в группе симпатотоников у женщин с синдромом ГАМП составляла лишь 4,85±0,75 нмоль/л, что в 6 раз ниже, чем у женщин контрольной группы – 30,51±6,49 нмоль/л (р<0,05). В период мено- и постменопаузы уровень прогестерона не зависел от исходного тонуса ВНС; также не выявлено достоверных различий с показателями здоровых женщин (табл. 4).
Таким образом, женщины-симпатотоники с синдромом ГАМП в репродуктивном периоде страдают дефицитом выработки прогестерона.
Низкое содержание гормона может обусловливать повышенное выделение натрия, хлоридов и воды из организма, что сопровождается нарушением регуляции мочеиспускания.
Выводы
- Исходный вегетативный тонус играет важную роль в реализации синдрома ГАМП. Установлена преобладающая роль симпатических влияний как в репродуктивном периоде – 39% от общего числа женщин с ГАМП, так и в период мено- и постменопаузы – 58%.
- У женщин с синдромом ГАМП нарушены гормональные механизмы мочевыделения. Выработка вазопрессина статистически значимо снижена у женщин в репродуктивном периоде независимо от преобладающего тонуса ВНС. В период мено- и постменопаузы повышенная концентрация гормона обусловлена повышением тонуса парасимпатического отдела ВНС.
- У женщин с синдромом ГАМП в репродуктивном периоде и в период мено-, а также постменопаузы отмечается гипоальдостеронизм, сочетающийся с гиперкалиемией при доминировнии ваготонуса, что обусловливает симптоматику ГАМП.
- Женщины в репродуктивном периоде с исходно повышенным симпатическим тонусом страдают дефицитом прогестерона, что определяет выведение натрия, хлоридов и воды и поддерживает клинические симптомы при синдроме ГАМП. Кроме того, дефицит прогестерона при синдроме ГАМП может приводить к усилению секреции ФСГ в репродуктивном периоде.
- У женщин с синдромом ГАМП в репродуктивном периоде отмечается напряжение механизмов регуляции мочеобразования, ассоциированное с высокой секрецией АКТГ.


