Введение. Наблюдательная программа, или неинтервенционное клиническое исследование, – вид клинического исследования, в котором все клинико-диагностические процедуры и схемы лечения общеупотребительны в клинической практике и назначаются по решению лечащего врача. Наблюдательные программы нацелены на сбор данных о существующей врачебной практике, а не на исследование новых режимов терапии. Плюсом такого способа сбора материала служит возможность изучения методов диагностики и лечения, применяющихся в реальной жизни, в т.ч. в условиях поликлинической терапии, а не в камерной обстановке научно-исследовательских учреждений, что, безусловно, более масштабно и детально отражает сложившуюся клиническую ситуацию. При мультицентровом характере исследования, большом объеме выборки, адекватном статистическом анализе результатов, полученные данные – весомый аргумент в пользу того или иного положения.
Хроническое и острое воспаление простаты – наиболее часто встречающееся урологическое заболевание у мужчин в возрасте до 50 лет, тогда как у пациентов старше 50 лет оно занимает третье место по распространенности после ДГПЖ и рака простаты [1].
 Согласно рекомендациям Европейской ассоциации урологов и Российского общества урологов, для лечения больных хроническим простатитом и/или синдромом хронической тазовой боли (ХП/СХТБ) большинство урологов назначают антимикробную терапию препаратами первого ряда (фторхинолоны) на протяжении 4 недель. Зачастую, это проводится эмпирически, без верификации первичного бактериального агента и определения его чувствительности. Оценив возможности применения традиционного бактериологического исследования и ПЦР-диагностики в протоколе обследования пациентов с хроническим простатитом, Y.S. Choi и соавт. [2] показали в 40% случаев выявление атипичных микроорганизмов (Chlamydia, Mycoplasma и Ureaplasma) в сочетании с E. coli, Ps. aerugionosa и кокковой флорой. Подобное комплексное исследование биоматериала для больных хроническим простатитом в амбулаторной практике – большая редкость, а потому адекватная терапия, как правило, не проводится, что считается причиной инверсии бактериального простатита в «абактериальный» и как следствие – неизлеченности пациента. Частое выявление C. trachomatis и U. urealyticum у пациентов с хроническим простатитом подтверждается и другими источниками [3, 4].
Согласно рекомендациям Европейской ассоциации урологов и Российского общества урологов, для лечения больных хроническим простатитом и/или синдромом хронической тазовой боли (ХП/СХТБ) большинство урологов назначают антимикробную терапию препаратами первого ряда (фторхинолоны) на протяжении 4 недель. Зачастую, это проводится эмпирически, без верификации первичного бактериального агента и определения его чувствительности. Оценив возможности применения традиционного бактериологического исследования и ПЦР-диагностики в протоколе обследования пациентов с хроническим простатитом, Y.S. Choi и соавт. [2] показали в 40% случаев выявление атипичных микроорганизмов (Chlamydia, Mycoplasma и Ureaplasma) в сочетании с E. coli, Ps. aerugionosa и кокковой флорой. Подобное комплексное исследование биоматериала для больных хроническим простатитом в амбулаторной практике – большая редкость, а потому адекватная терапия, как правило, не проводится, что считается причиной инверсии бактериального простатита в «абактериальный» и как следствие – неизлеченности пациента. Частое выявление C. trachomatis и U. urealyticum у пациентов с хроническим простатитом подтверждается и другими источниками [3, 4].
Согласно рекомендациям Европейской ассоциации урологов, при наличии непереносимости фторхинолонов, устойчивости к терапии проводится бактериологическое исследование постмассажной мочи и смена препарата в соответствии с чувствительностью (например, на триметоприм) [5]. По данным F. Wagenlehner, обследовавшего и лечившего в 2011 г. 243 пациента с хроническим простатитом, эффективность приема ципрофлоксацина была отмечена у 93,5% [6]. Однако, T. Cai и соавт. при сравнении динамики выявленных за последние 10 лет уропатогенов, отметили снижение роли кишечной палочки и увеличение роли энтерококка в этиологии хронического простатита, а также снижение чувствительности микрофлоры к ципрофлоксацину [7]. В свою очередь, E. Vicari [8] сообщил, что у половины пациентов при исследовании секрета простаты были выделены штаммы микоплазм (U. urealyticum и M. hominis), 59,5% которых характеризовались высокой резистентностью к ципрофлоксацину, тогда как показатели устойчивости к доксициклину и джозамицину были наименьшими (0,0–1,7%). Низкая чувствительность микоплазм к офлоксацину и эритромицину (29,4 и 54,8%) была показана в исследовании Z.H. Yan и соавт., в то время как чувствительность их к доксициклину, пристинамицину, джозамицину и тетрациклину сохранялась на уровне 94,3%, 96,6, 86,5 и 97,4% соответственно [9]. Таким образом, препаратом первой линии по-прежнему считаются фторхинолоны, а триметоприм, макролиды и тетрациклины применяются в лечении хронического простатита лишь как альтернативные препараты. Г.А. Восканян и соавт. в 2014 г. в своем обзоре литературы [10], посвященном современному видению консервативной терапии хронического простатита, говорят о необходимости поиска новых индивидуальных подходов к терапии простатита и оценке ее эффективности с учетом длительности заболевания и возможности микст-инфицирования атипичными возбудителями.
Затруднения в адекватном индивидуальном выборе антибактериального препарата для лечения больных хроническим простатитом, упрощенное назначение эмпирического лечения, конечно же, делают последнее более привлекательным для врача. Добавим к этому низкую комплаентность пациентов к терапии, большой риск микст-инфекций, невысокий уровень санитарно-гигиенической культуры населения (необязательность обследования полового партнера и использования средств барьерной контрацепции, лечение партнеров одними и теми же препаратами, отсутствие контрольного обследования после терапии), экономические (высокая стоимость препаратов и молекулярно-биологических методов диагностики при низких доходах, необходимость оплачивать курсы физиотерапевтических воздействий) и поведенческие факторы (наличие нескольких половых партнерш у мужчин репродуктивного возраста, сложность принятия решения обратиться к врачу, распространенность самолечения); становится понятным, что количество недолеченных пациентов колоссально. Неудовлетворенность лечением, частые рецидивы заболевания нередко заставляют пациентов уходить из-под контроля или менять врачей, что приводит к дальнейшей хронизации воспаления, ухудшению прогноза и появлению таких осложнений хронического простатита, как инфравезикальная обструкция, эректильная дисфункция и различные виды соматоформных расстройств (11). Вышеперечисленные моменты подвигли группу исследователей к необходимости оценить эффективность и безопасность применения при хроническом простатите альтернативных схем терапии, потенциально действующих как на классическую флору, так и на «атипичных» возбудителей простатита.
Материалы и методы. С декабря 2013 по май 2014 г. в российских лечебных учреждениях был проведен набор пациентов в проспективную наблюдательную программу по оценке эффективности применения макролидов и тетрациклинов у мужчин с хроническим простатитом (TAURUS). Исследование осуществлено практикующими врачами-урологами в условиях амбулаторных клинических центров. Целями программы стала оценка эффективности (первичная цель) и безопасности (вторичная цель) применения макролидов и тетрациклинов у мужчин с хроническим простатитом. В исследуемую группу вошли 1218 мужчин с хроническим простатитом, у которых оценивались демографические, клинические и лабораторные данные, критерии эффективности и безопасности применения макролидов и тетрациклинов. В качестве макролида применялся джозамицин (Вильпрафен®), в качестве антибиотика тетрациклинового ряда – доксициклина моногидрат (Юнидокс Солютаб®), а в случае комбинированной терапии пациенты получали комбинацию указанных препаратов с длительностью терапии от 2 до 6 недель (согласно решению лечащего врача). Необходимо оговорить, что пациент включался в наблюдательную программу после диагностирования воспаления простаты и принятия урологом решения по назначению макролида и/или тетрациклина для лечения простатита при условии подписания информированного согласия об участии в программе. Схемы лечения определялись врачом и соответствовали рекомендуемым, согласно инструкциям по медицинскому применению: доксициклина моногидрат назначался по 100 мг 2 раза в день, джозамицин – по 500 мг 3 раза в день.
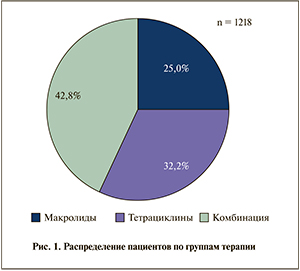
В дальнейшем включенные в исследование пациенты, согласно плану статистического анализа, были разделены на три группы терапии:
- макролидами (304 пациента, 25,0%);
- тетрациклинами (393 пациента, 32,2%);
- группа комбинированной терапии (521 пациент, 42,8%).
Данные по лечению мужчин с хроническим простатитом собирались на исходном уровне (визит 1) и после лечения (визит 2). Объем обследования пациентов соответствовал обычному обследованию в соответствии со Стандартом медицинской помощи больным простатитом [12].
Во время первого и повторного визитов проведены:
- регистрация жалоб и анамнеза в соответствии с Индексом шкалы симптомов хронического простатита (NIH-CPSI);
- пальцевое ректальное исследование (оценка объема, болезненности и плотности предстательной железы);
- ультразвуковое исследование почек, мочевого пузыря и предстательной железы (с регистрацией объема остаточной мочи и объема предстательной железы);
- общий анализ средней порции мочи (содержание бактерий и лейкоцитов) до и после проведения массажа предстательной железы;
- общий анализ секрета предстательной железы (содержание бактерий и лейкоцитов);
- бактериологическое исследование мочи и ПЦР-исследование секрета простаты.
На основании динамики изменений вышеперечисленных критериев урологом оценивалась эффективность лечения пациента. Врач оценивал эффективность терапии макролидами и тетрациклинами во время визита 2, указав один из следующих исходов терапии:
- выздоровление (полное разрешение клинических признаков и симптомов);
- улучшение (частичное разрешение признаков и симптомов);
- отсутствие эффекта (неадекватный ответ на терапию и необходимость в дополнительном лечении антибиотиками);
- невозможно оценить (пациент потерян для последующего наблюдения).
О безопасности терапии судили на основании частоты развития нежелательных явлений (НЯ) и серьезных НЯ [13].

По окончании исследования с учетом типа переменной (количественной или качественной) для всех групп (группы монотерапии макролидами, группы монотерапии тетрациклинами, группы сочетанной терапии) проведен статистический анализ с помощью пакета программ обработки статистических данных SPSS® версии 17.0 для всех анализируемых параметров. Данные в статье представлены в виде среднего и среднеквадратичного отклонения (М±m) или в виде медианы и интерквартильного размаха Ме (Q1; Q3).
Для оценки достоверности различий групп выполнялось попарное и межгрупповое сравнение различий. Оценивалась вероятность (p) ошибки при отклонении от нулевой гипотезы. Если p<0,05, проведены попарные сравнения для уточнения различий между отдельными группами. Если p>0,05, то различий между группами терапии не было выявлено и поэтому попарные сравнения не проводились (рис. 1).
Средний возраст пациентов составил 39,7±12,7 года, а медиана длительности хронического простатита в популяции пациентов – 36 мес. Анализируя данные по проведенному ранее лечению по поводу диагноза «хронический простатит», на протяжении предшествующих 3 месяцев терапию получили только 178 (14,6%) пациентов. По данным оценки анамнестических данных и первичной медицинской документации, сопутствующие заболевания были выявлены у 343 (28,2%) пациентов. Из сопутствующих заболеваний наиболее часто встречалась гиперплазия предстательной железы, выявленная у 107 (21,1%) пациентов. Вторым по частоте встречаемости заболеванием была эссенциальная (первичная) гипертензия, выявленная у 66 (13,0%) пациентов, третьим – стенокардия, выявленная у 22 (4,3%) пациентов.
В рамках данного исследования сопутствующую терапию между визитами получили 395 (32,4%) пациентов. В структуре препаратов сопутствующей терапии наиболее часто применяемым лекарством явился тамсулозин, который был назначен 227 (30,1%) больным, вторым по частоте назначения препаратом был диклофенак – 112 (14,9%) назначений, третьим – целекоксиб, назначенный 50 (6,6%) пациентам. Частое назначение пациентам тамсулозина и нестероидных противовоспалительных препаратов (диклофенак, кетопрофен, целекоксиб), вероятно, обусловлено сочетанием с ДГПЖ (107 больных – 21,1%) и наличием болевого синдрома при хроническом простатите.
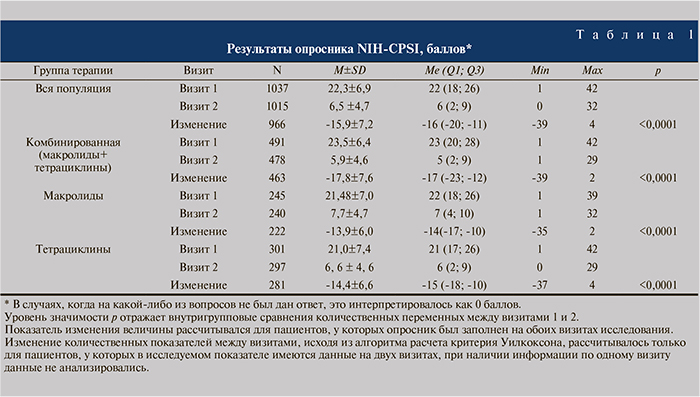
Результаты исследования. В ходе исследования собиралась и анализировалась динамика по трем разделам опросника NIH-CPSI – боль, симптомы нарушенного мочеиспускания и качество жизни. Обобщенные показатели представлены в табл. 1.
Как видно из табл. 1, по данным опросника NIH-CPSI медиана балла NIH-CPSI во всей популяции на исходном уровне (визит 1) составила 22 (18; 26) балла. К визиту 2 это значение уменьшилось на 16 (11; 20) баллов и составило 6 (2; 9) баллов. В группе терапии макролидами исходное значение 22 (18; 26) уменьшилось к визиту 2 на 14 (10; 17) баллов и составило 7 (4; 10) баллов. В группе терапии тетрациклинами исходный уровень 21 (17; 26) балла также уменьшился на 15 (10; 18) и к визиту 2 составил 6 (2; 9). В группе комбинированной терапии значение на визите 1 составило 23 (20; 28) балла и изменилось к визиту 2 на 17 (12; 23) баллов, снизившись до уровня 5 (2; 9) баллов. Полученные в динамике различия количества баллов по отдельным шкалам в группах были статистически значимыми (р<0,0001).
Таким образом, по всем группам шкалы опросника NIH-CPSI ко второму визиту наблюдалось уменьшение количества баллов как в общем по всей популяции, так и в отдельных группах терапии.
Болезненность предстательной железы за время проведения исследования статистически значимо уменьшилась как в популяции в целом, так и по группам терапии: с 974 (80,0%) случаев на визите 1 до 144 (11,8%) (-68,2%) на визите 2 для всей популяции, с 233 (76,6%) случаев до 21 (6,9%) (-69,7%) в группе терапии макролидами, с 300 (76,3%) случаев до 46 (11,7%) случаев (-64,6%) в группе терапии тетрациклинами и с 441 (84,6%) случая до 77 (14,8%) (-69,9%) в группе комбинированной терапии. Попарные сравнения групп терапии по динамике изменения болезненности предстательной железы не выявили статистически значимых различий по числу пациентов с положительной или отрицательной динамикой болезненности предстательной железы между визитами, однако обнаружили статистически значимое преимущество группы комбинированной терапии по сравнению с группами монотерапии по числу пациентов без боли.
По данным анализа результатов ультразвукового исследования объем остаточной мочи во всей популяции в среднем уменьшился на 12,2±22,1 мл, и вновь группа комбинированной терапии отличалась более значимым изменением объема мочи между визитами (различия статистически достоверны). У пациентов, получавших комбинированную терапию, наблюдалась более выраженная положительная динамика – в среднем -2,8±2,7 см3 в отношении уменьшения объема предстательной железы по сравнению как с макролидами (р=0,0002), так и с тетрациклинами (р<0,0001), в то время как различия при сравнении динамики изменений в группах макролидов и тетрациклинов не были достоверными (р=0,3269).
Уменьшение симптомов боли, нарушенного мочеиспускания и качества жизни гораздо более ощутимо и ценно для пациента, чем незаметное для него уменьшение объема остаточной мочи и предстательной железы. Именно исходя из изменений субъективных параметров, уролог оценивает динамику заболевания на фоне терапии, может высказаться в отношении эффективности лечения, долгосрочного прогноза болезни, а, косвенно, и о нарушении функции изгнания мочи, наличии инфравезикальной обструкции и ее связи с воспалительным компонентом (отек простаты), и, как следствие, о наличии риска острой ишурии (особенно при сочетании воспаления и доброкачественного увеличения простаты). Лабораторное исследование мочи перед массажем предстательной железы было проведено 936 (76,9%) пациентам на визите 1 и 817 (67,1%) пациентов на визите 2, лабораторное исследование мочи после массажа предстательной железы – 633 (52,0%) пациентам на визите 1 и 581 (47,7%) на визите 2, а лабораторное исследование секрета предстательной железы – у 1179 (96,8%) пациентов на визите 1 и у 1161 (95,3%) пациента на визите 2.
При исследовании мочи до массажа простаты было выявлено наличие бактерий в моче у 141 (15,1%) пациента на визите 1 и у 8 (1,0%) на визите 2 (-94,3%), также подтверждено наличие лейкоцитурии у 490 (52,4%) пациентов на визите 1 и у 298 (36,5%) на визите 2 (-39,2%), т.е. доказано статистически достоверное уменьшение числа пациентов с лейкоцитурией и бактериурией на фоне проведенной терапии. Возбудители в моче при этом были выделены у 32 (3,4%) пациентов на визите 1 и у 2 (0,2%) на визите 2.
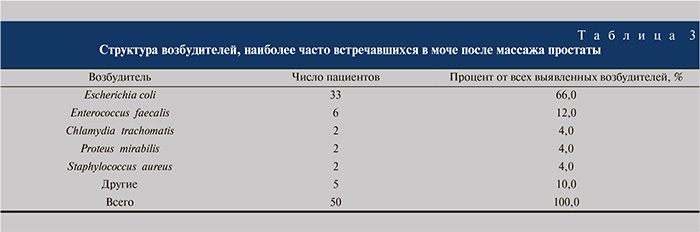
Структура наиболее часто встретившихся нам возбудителей представлена в табл. 2.
После массажа простаты бактериурия выявлена у 197 (31,1%) пациентов на визите 1 и у 18 (3,1%) на визите 2 (-90,9%), лейкоцитурия – у 498 (78,7%) пациентов на визите 1 и у 256 (44,1%) на визите 2 (-48,6%). Возбудители в моче при этом были выделены у 50 (7,9%) пациентов на визите 1 и у 7 (1,2%) на визите 2.
Таким образом, после проведенного лечения (при исследовании мочи после массажа простаты) наблюдалось уменьшение выделения бактерий и лейкоцитов ПЖ как во всей популяции, так и в группах монотерапии.
Структура возбудителей, наиболее часто встречавшихся в моче после массажа простаты, представлена в табл. 3.
Отметим, что процент выявления Escherichia coli после массажа простаты практически не изменился и наличие в структуре наиболее часто встретившихся «атипичных» возбудителей – Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma genitalium, Mycoplasma hominis – еще раз подтвердило теорию об участии внутриклеточных микроорганизмов в генезе хронического воспаления простаты. Безусловно также и то, что, несмотря на трудности в лабораторном подтверждении микст-инфекций (необходимость использования живой культуры Mccoy [14] с соответствующим увеличением стоимости диагностики), использование в лечении препаратов, действующих на внутриклеточные патогены, становится необходимым. По результатам бактериологического исследования в ходе лечения была достигнута полная эрадикация внутриклеточных возбудителей, для этой цели применялась как монотерапия, так и комбинация препаратов.
Динамика уровня лейкоцитов и бактериальной нагрузки на фоне проводимой терапии представляется чрезвычайно интересной. Так, до лечения массаж простаты приводил к увеличению бактериурии у 16,2% пациентов, тогда как после лечения – лишь у 2,1%. Аналогичная ситуация наблюдалась с лейкоцитурией: до лечения увеличение частоты ее регистрации после массажа простаты составило 26,3%, а после – 7,6%. Наиболее приемлемым представляется следующее объяснение: на фоне проводимого лечения уменьшилась частота встречаемости лейкоцитурии и бактериурии, что говорит об эффективности применяемых препаратов и схем лечения. Улучшение дренирования простаты обеспечило снижение частоты выявления лабораторных симптомов после массажа (своеобразной провокации для «недренированных» ацинусов предстательной железы). Лабораторное исследование секрета предстательной железы было проведено у 1179 (96,8%) пациентов на визите 1 и у 1161 (95,3%) пациента на визите 2.
Наличие бактерий в секрете предстательной железы было выявлено у 765 (64,9%) пациентов на визите 1 и у 73 (6,3%) на визите 2 (-90,6%), лейкоциты в секрете предстательной железы выявились у 1097 (93,0%) пациентов на визите 1 и у 732 (63,1%) на визите 2 (-33,3%).
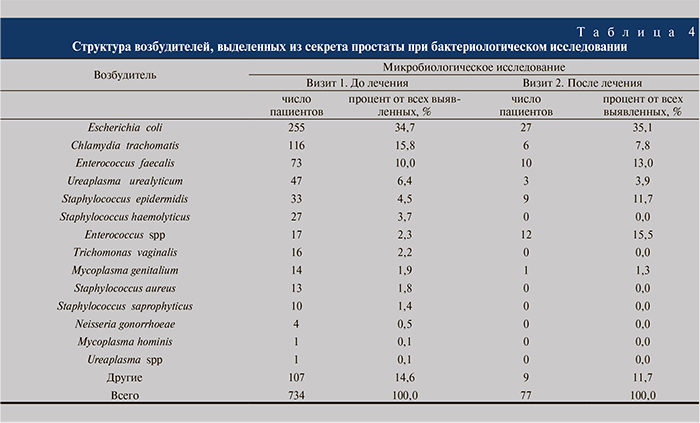
При микробиологическом исследовании в секрете предстательной железы у 734 (62,3%) пациентов на визите 1 и у 77 (6,6%) на визите 2 выделены возбудители, представленные в табл. 4.
При исследованиях с помощью метода ПЦР микроорганизмы выделены у 379 (55,3%) пациентов на визите 1 и у 35 (8,1%) на визите 2.
Отметим меньшее выделение Escherichia coli в секрете простаты (34,7%) относительно постмассажной мочи (66,0%). Из данных табл. 4 следует, что у 179 (24,4%) пациентов в секрете простаты выявлены внутриклеточные возбудители; после лечения эрадикация Chlamydia trachomatis отмечена у 110 (94,8%) пациентов, Mycoplasma genitalium – у 13 (92,9%), Ureaplasma urealyticum – у 44 (93,6%).
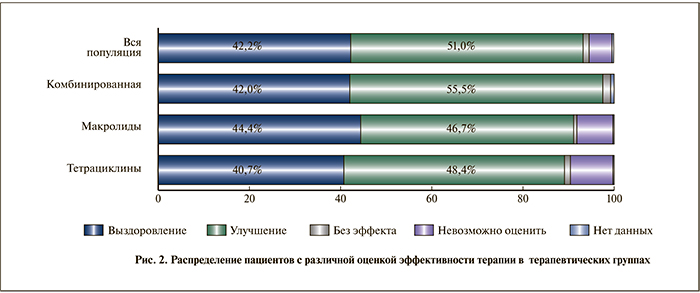
Данные по эффективности терапии, которую оценивали врачи, представлены на рис. 2. Врачи отметили исход назначенной терапии как «выздоровление» у 42,2% во всей популяции, у 42,0% в группе комбинированной терапии, у 44,4% в группе терапии макролидами и у 40,7% в группе терапии тетрациклинами. «Улучшение» было отмечено у 51,0% во всей популяции, у 55,5% в группе комбинированной терапии, у 46,7% в группе терапии макролидами и у 48,4% в группе терапии тетрациклинами. Исход терапии был расценен врачами как «без эффекта» у 1,3% пациентов во всей популяции, у 1,7% в группе комбинированной терапии, у 0,7% в группе терапии макролидами и у 1,3% в группе терапии тетрациклинами. Процент эффективных исходов терапии («улучшение» и «выздоровление») составил соответственно 93,2% во всей популяции, 97,5% в группе комбинированной терапии, 91,1% в группе терапии макролидами и 89,1% в группе терапии тетрациклинами. По проценту эффективных исходов было отмечено статистически значимое превосходство группы комбинированной терапии перед обеими группами монотерапии (p<0,0001)
По данным проведенной оценки безопасности терапии, общая частота зарегистрированных НЯ составила 2,6% и была сопоставимой во всех группах. Наиболее часто встречающейся нежелательной реакцией во всех терапевтических группах были симптомы со стороны желудочно-кишечного тракта. Патогенез антибиотикоассоциированной диареи, связанный с дисбиотическими изменениями микробиоценоза кишечника, хорошо изучен, и способы ее коррекции были с эффектом применены урологами. Основные нежелательные реакции, отмеченные исследователями в ходе программы, в целом соответствовали профилю безопасности доксициклина моногидрарта и джозамицина (табл. 5).
Обсуждение. Проспективная наблюдательная эпидемиологическая программа TAURUS продемонстрировала высокую эффективность макролидов Вильпрафен® (джозамицин) и тетрациклинов Юнидокс Солютаб® (доксициклина моногидрат) у мужчин с хроническим простатитом в рутинной клинической практике. Терапия, исследуемая в настоящей программе, по оценке врачей, была эффективной у 93,2% пациентов. Неэффективность лечения была отмечена всего у 1,3% пациентов, еще у 5,5% было недостаточно данных для проведения оценки.

Для оценки эффективности терапии были применены современные и классические методы оценки состояния пациентов, а также методы статистического анализа данных. Среди исследуемых терапевтических групп, по мнению врачей-исследователей и по данным проведенной динамической оценки клинических лабораторно-инструментальных показателей, наиболее выраженная положительная динамика отмечена в группе комбинированной терапии, в которой суммарная частота выздоровления и улучшения состояния пациентов статистически значимо превышала таковую в группах монотерапии макролидами или тетрациклинами.
Профиль безопасности при применении макролидов и тетрациклинов может быть расценен как благоприятный. Во всей популяции нежелательные реакции возникли всего у 2,6% пациентов, из них серьезные – у 0,7% пациентов. Исследуемые группы в целом характеризовались сопоставимой частотой возникновения НР и серьезных НР, в том числе у пациентов, получавших комбинированную терапию, нежелательные реакции регистрировались не чаще, чем у пациентов, получавших монотерапию. Наиболее частой нежелательной реакцией во всех терапевтических группах была диарея. У всех пациентов развившиеся НР заканчивались выздоровлением или улучшением состояния.
На основании полученных данных можно сделать заключение о перспективности применения макролидов и тетрациклинов при лечении хронического, в том числе «абактериального», простатита, однако для более определенных выводов требуется дополнительное изучение данных групп препаратов в отношении пациентов с ХП/СХТБ, в том числе с учетом паттернов эпидемиологии и резистентности к антибиотикам на территории Российской Федерации.
Проведенное исследование подтверждает важность гибкого и индивидуального подхода к терапии хронического простатита, необходимость постоянной оценки эффективности лечения, мониторинга и критического подхода к существующим схемам терапии, значимости приверженности пациента к лечению и динамического наблюдения врачом-урологом в рамках повседневной клинической практики.
Выводы. По результатам проведенной проспективной наблюдательной программы TAURUS были проанализированы данные 1218 пациентов с хроническим простатитом, получавших лечение макролидами и/или тетрациклинами в условиях реальной клинической практики. Было показано, что режимы терапии макролидами, тетрациклинами и их комбинацией оцениваются подавляющим большинством врачей как эффективные и хорошо переносимые, что позволяет рекомендовать их для лечения пациентов с хроническим простатитом в амбулаторной клинической практике в РФ.
9 Исследование TAURUS было проведено при поддержке компании «Астеллас Фарма» Б.В. Юроп группой российских урологов: Винаров А.З., Аверинский Д.В., Блакитная М.А., Бутин П.С., Григорьева Ю.В., Козырев С.В., Кузьменко А.В., Кур-батов Д.Г., Назаров И.А., Неймарк А.И., Ощепкова И.Г., Патрикеев А.А., Попов С.Л., Пугачев Э.В., Самсонов А.А., Степанов К.А., Стецик О.В., Стой-лов С.В., Суриков В.Н., Терещенко С.А., Трещилов И.М., Фаниев М.В., Чабан А.В., Чиквиладзе З.В., Шевченко Н.П., Шпиленя Е.С., Шульгин А.С.


