Начало развития метода визуализации было положено немецким физиком, Нобелевским лауреатом Вильгельмом Конрадом Рентгеном, который в 1895 г. открыл Х-лучи, а уже менее чем через 100 лет американский физик Годфри Хаунфилд создал первый прототип компьютерного томографа. Стремительное развитие компьютерных технологий привело к столь значительным переменам в понимании патологических процессов, что теперь специалисты различных профилей имеют возможность анализировать трехмерные реконструкции интересуемой анатомической области, органа. Более того, на сегодняшний день трехмерная обработка снимков, полученных на мультиспиральных томографах, является основой не только для анализа на этапе планирования оперативного пособия, но и на этапе собственно его виртуального и реального выполнения, а также обучения начинающих специалистов [1]. На основании данных компьютерной (КТ), магнитно-резонансной (МРТ) или позитронно-эмиссионной томографии (ПЭТ) выполняется трехмерное моделирование органа/патологического процесса [2–5]. Тщательный анализ трехмерной анатомии помогает предугадать те технические сложности, которые могут возникать на этапе выполнения оперативного пособия. Более того, многократное выполнение операции в виртуальном режиме позволяет определять оптимальный доступ, а также перечень и последовательность хирургических манипуляций.
Трехмерное моделирование получает все большее распространение практически по всем урологическим направлениям – начиная от чрескожных вмешательств, заканчивая робот-ассистированными операциями.
Чрескожная пункционная нефролитотомия служит «золотым» стандартом в лечении крупных множественных камней или конкрементов, расположенных в чашечно-лоханочной системе (ЧЛС) [6]. Однако выбор наиболее подходящего способа извлечения камня из собирательной системы органа нередко представляет определенную сложность [7, 8], в особенности в ситуации, когда у пациента имеются конкремент подковообразной почки, коралловидный камень или множественные конкременты. В подобных случаях в ходе выполнения чрескожного пособия нередко возникают осложнения в виде кровотечения и повреждения смежных анатомических образований – плевральной полости, ободочной кишки, селезенки, печени [9–12].
 Чаще всего чрескожная пункционная нефролитотомия выполняется под ультразвуковым либо рентгенологическим контролем. Отметим, что оба способа визуализации позволяют получать только двухмерное изображение мочевых путей, смежных органов и тканей с ограниченной разрешающей способностью. Детальное представление об особенностях взаимоотношения конкрементов с ЧЛС и как результат – выбор наименее инвазивного доступа к камню – можно получать, выполнив мультиспиральную компьютерную томографию (МСКТ) с трехмерной реконструкцией [13–15]. Как показано в работе [16], трехмерная визуализация артериальных почечных сосудов и ЧЛС помогает избегать повреждения сегментарных артерий при проведении чрескожной нефролитотрипсии (ЧНЛТ).
Чаще всего чрескожная пункционная нефролитотомия выполняется под ультразвуковым либо рентгенологическим контролем. Отметим, что оба способа визуализации позволяют получать только двухмерное изображение мочевых путей, смежных органов и тканей с ограниченной разрешающей способностью. Детальное представление об особенностях взаимоотношения конкрементов с ЧЛС и как результат – выбор наименее инвазивного доступа к камню – можно получать, выполнив мультиспиральную компьютерную томографию (МСКТ) с трехмерной реконструкцией [13–15]. Как показано в работе [16], трехмерная визуализация артериальных почечных сосудов и ЧЛС помогает избегать повреждения сегментарных артерий при проведении чрескожной нефролитотрипсии (ЧНЛТ).
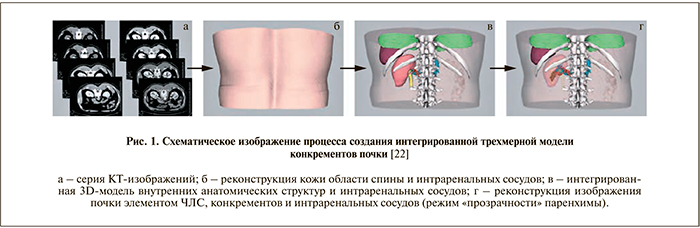
Стремительное развитие навигации в хирургии и подтверждение возможности ее технической реализации в урологии [17–19] привели к тому, что при выполнении ЧНЛТ специалисты все чаще используют трехмерные реконструкции патологического процесса в почке наряду со специальными платформами для наведения пункционной иглы. Сравнительно недавно было показано, что для трехмерного планирования точки для пункции и направления нефростомического канала возможно использование технологии дополненной реальности, заключающейся в использовании лазерного и iPad-ассистированного наведения [20, 21]. Тем не менее крупномасштабных клинических испытаний с применением указанных технологий немного. H. Li и соавт. [22] предприняли попытку трехмерной реконструкции с применением 3D-Doctor и Mimics программного обеспечения. Получить совпадение при наложении исходных снимков с интраоперациоными авторам удалось благодаря тому, что было тщательно выверено положение и дыхание пациента как во время МСКТ, так и при ЧНЛТ. Интраоперационная визуализация сосудов, ЧЛС и конкрементов почки обеспечивалась благодаря наличию режима «прозрачности» паренхимы органа. Наибольшее внимание авторы уделили тщательному изучению расположения сегментарных артерий, поскольку их повреждение сопряжено с риском массивного кровотечения [23, 24]. H. Li и соавт. наглядно продемонстрировали роль трехмерного моделирования при планировании и выполнении чрескожных вмешательств у пациентов с подковообразной почкой, коралловидными камнями и множественными конкрементами органа [22]. В ходе исследования пациентам было выполнено нативное и контрастированное МСКТ с интервалом в 0,5 мм. В дальнейшем КТ-изображения группировались таким образом, чтобы при построении трехмерного изображения в него вошли паренхима почки, интраренальные артерии и вены, конкременты, элементы собирательной системы почки, позвоночный столб, ребра, легкие, печень, селезенка. Используя режим прозрачности почечной паренхимы на трехмерной модели, можно получить полное представление о взаиморасположении конкрементов и смежных структур (рис. 1).
Предоперационное планирование ЧНЛТ было проведено хирургом с использованием программы Mimics 12.1 (Materialise, Leuven, Бельгия). Виртуальная 3D-пункционная игла внедрялась в трехмерную модель для того, чтобы наметить канал для пункции. Функция «симуляция–репозиция» позволяет продвигать и вращать иглу в толще трехмерной модели при помощи компьютерной мыши таким образом, чтобы одновременно получать выход на максимальное количество конкрементов, избегать повреждения интраренальных сосудов и прилежащих анатомических структур.
С помощью указанной программы также осуществлена запись объема и свойств поверхности камня [8]. Кроме того, произведен расчет глубины пункционного канала (от поверхности кожи до чашечек), горизонтального расстояния от предполагаемой точки для пункции и срединной линией, образованной позвоночным столбом, а также вертикального расстояния до XII ребра.
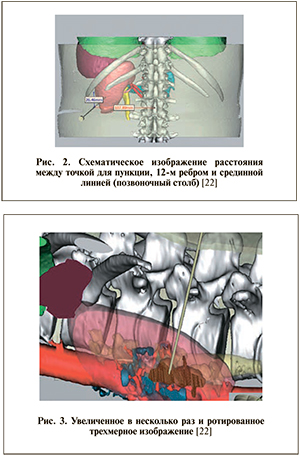
На операционном столе пациент располагался в той же позиции, что и при выполнении МСКТ: на животе с подушечкой для ЧНЛТ в области проекции почки на переднюю брюшную стенку. На монитор отдельного компьютера, за которым находился ассистент хирурга, выведено трехмерное изображение почки с камнями. В соответствии с линиями, полученными при анализе трехмерной модели, на спине у пациента намечалась предполагаемая точка для пункции (рис. 2).
Затем трехмерное изображение увеличивали в несколько раз и разворачивали таким образом, чтобы визуализировалась ранее намеченная точка для пункции (рис. 3).
Затем хирург настраивал работу ультразвукового аппарата в B-режиме и, ориентируясь на 3D-картину, вручную отмечал точку для пункции и на ультразвуковом изображении. Вкол пункционной иглы осуществлен в области предполагаемой точки для пункции, отмеченной на коже спины пациента в направлении к ЧЛС вдоль линии, обозначенной на ультразвуковом изображении. Во время выполнения литотрипсии у хирурга есть возможность ориентироваться на трехмерное изображение конкрементов в собирательной системе почки, что позволяет рассматривать камни с различных сторон и, что не менее важно, оценивать расстояние от края конкремента до сосудистых структур почки. На серии следующих снимков показаны варианты планирования оптимального направления иглы для проведения ЧНЛТ (рис. 4).
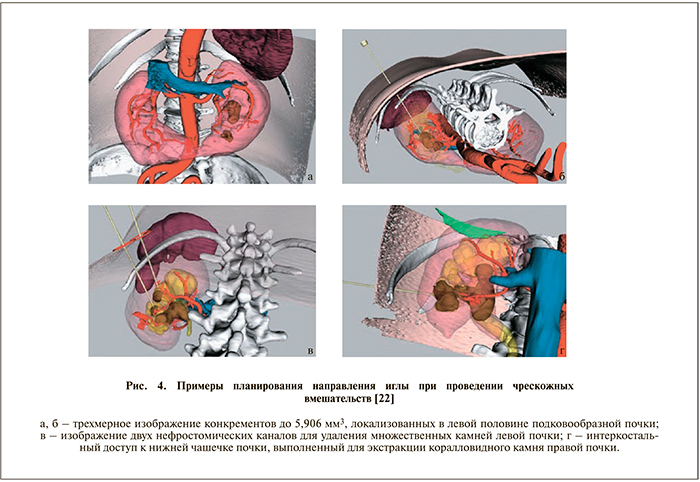
Применение трехмерной реконструкции при наличии возможности совмещения и раздельного анализа всех фаз МСКТ позволило выполнить ЧНЛТ всем 15 пациентам, причем ни одному из них не потребовались дополнительные манипуляции. Интраоперационных осложнений не выявлено. 93,3% пациентов ЧНЛТ выполнена одномоментно. Лишь одному пациенту потребовался повторный сеанс в связи с резидуальным камнем.
На сегодняшний день трехмерные технологии позволяют не только получать трехмерное изображение на дисплее и вращать его на 360° с использованием различных фильтров, но и печатать на специальном оборудовании объемную модель, к примеру, почки, которую можно в дальнейшем использовать в качестве адекватного макета для тренировки как оперирующим урологом, так и начинающими докторами [25]. В недавней публикации [26] представлено описание трехмерной модели ЧЛС, предназначенной для выполнения «пробных» чрескожных вмешательств перед реальной операцией. Автор подчеркивает, что желательно, чтобы навык выполнения чрескожных вмешательств вырабатывался не непосредственно в операционной, а на недорогих моделях в симуляционных центрах. На начальном этапе проведена виртуальная трехмерная реконструкция элементов чашечно-лоханочной системы. Затем данные модели были распечатаны в виде водорастворимых пластиковых биомоделей на специальном 3D-принтере (рис. 5).

Полученные модели ЧЛС были включены в силиконовую основу, причем в дальнейшем произведено растворение модели ЧЛС, а в силиконовой конструкции оставалась точная полая модель ЧЛС. После этого ЧЛС силиконовой модели наполнили рентгеноконрастным веществом и герметизировали (рис. 6).
В дальнейшем при симуляции чрескожного вмешательства для воссоздания эффекта наличия мягких тканей между почкой и поверхностью кожи вокруг силиконовой модели размещали слой из плотного губчатого вещества. По результатам использования данной силиконовой модели была показана ее практическая пригодность, поскольку ее применение позволяет выполнять чрескожное вмешательство на огромном количестве всевозможных анатомических вариантов строения ЧЛС, снижая частоту повторных вмешательств на органе, а также количество интра- и послеоперационных осложнений.
В заключение отметим, что трехмерные технологии вносят неоценимый вклад в обучение начинающих специалистов, а также процесс принятия решения об оптимальной тактике лечения пациента.


