Введение. Стрессовое недержание мочи (СНМ) является одной из главных проблем современной урогинекологии. Не будучи летальным заболеванием, СНМ значительно снижает качество жизни пациенток. В настоящее время СНМ является наиболее распространенным урогинекологическим заболеванием [1]. Несмотря на значительное число терапевтических и хирургических методов лечения данного состояния, проблема до сих пор не нашла окончательного решения [2].
В последние годы активно разрабатываются новые методы лечения СНМ, прежде всего основанные на инъекционном введении объемообразующих препаратов, однако единый подход к выбору адекватной и воспроизводимой модели заболевания до сих пор отсутствует. Хорошо известно, что СНМ – это заболевание со сложным и многофакторным патогенезом. В основе его могут лежать травматичные роды, нарушение функционирования уретральных сфинктеров, в частности, из-за нарушения иннервации, дисплазии соединительной ткани и, как следствие – слабости мочеполовой диафрагмы. К сожалению, учесть все патогенетические механизмы в рамках одной экспериментальной модели не представляется возможным, поэтому перед исследователями стоит задача выбора модели, максимально отвечающей конкретным целям. Нами проведен анализ релевантности моделей СНМ и проведено экспериментальное исследование по сравнению двух наиболее часто применяемых способов моделирования данного заболевания, связанных с денервацией уретры.
В современной научной литературе описано несколько экспериментальных моделей СНМ с использованием мелких лабораторных животных. Все экспериментальные модели можно подразделить на те, которые обеспечивают обратимое, быстро подвергающееся регрессу недержание, и те, результатом которых является необратимое персистирующее более 3 мес недержание [3]. Среди всех известных подходов по моделированию СНМ следует выделить модели, связанные с растяжением влагалища, уретролизом, инъекцией токсинов в сфинктер, сфинктеротомией и периуретральной каутеризацией, травматизацией или пересечением полового нерва.
В качестве одной из первых моделей СНМ было предложено использовать длительное перерастяжение влагалища при введении баллонного катетера [4]. Данная модель предназначена в первую очередь для воспроизведения недержания мочи вследствие родовой травмы. Однако попытки воспроизвести СНМ путем перерастяжения тканей малого таза у крыс не сопровождаются стабильным развитием СНМ [5]. При этом данный метод в сочетании с повреждением полового нерва [6] также не показал снижения уродинамических показателей. Кроме того, посредством указанной модели невозможно в полной мере воспроизводить процессы, связанные с родовой травмой, так как у женщин, перенесших травматические роды, СНМ может впервые появиться спустя 5 лет после родов и наиболее часто – при достижении менопаузы. Столь продолжительно наблюдать за экспериментальными животными не представляется возможным.
 Моделирование СНМ путем уретролиза (отделение уретры от влагалища, внутренней фасции и лобковой кости) приводит к резкому снижению LPP (leak point pressure – давление вытекания первой капли мочи), уменьшению на 65% мышечного слоя уретры [7]. Данное повреждение различных экспериментальных животных приводило к тяжелому недержанию мочи длительностью от 8 до 13 нед [8, 9]. Тем не менее при данном подходе моделируется недержание, в большей степени соответствующее таковому, возникающему у мужчин после радикальной простатэктомии, нежели СНМ, развивающемуся у женщин.
Моделирование СНМ путем уретролиза (отделение уретры от влагалища, внутренней фасции и лобковой кости) приводит к резкому снижению LPP (leak point pressure – давление вытекания первой капли мочи), уменьшению на 65% мышечного слоя уретры [7]. Данное повреждение различных экспериментальных животных приводило к тяжелому недержанию мочи длительностью от 8 до 13 нед [8, 9]. Тем не менее при данном подходе моделируется недержание, в большей степени соответствующее таковому, возникающему у мужчин после радикальной простатэктомии, нежели СНМ, развивающемуся у женщин.
Известны модели СНМ, связанные с введением различных токсинов, например нотексина [10] или ботулинистического [11] в периуретральную область. Однако в первом случае эффекта получено не было, а при использовании последнего эффективность оценена в течение только 1 мес. Данный способ достаточно редко используется для моделирования СНМ.
Модели, связанные с повреждением уретрального сфинктера, показали свою эффективность при моделировании СНМ у собак [12] и мышей [10].
В последней работе авторы сравнивали продольную сфинктеротомию, холодовое повреждение сфинктера и периуретральную инъекцию нотексина, при этом только сфинктеротомия вызывала устойчивое недержание мочи до 21 сут. Тем не менее данный способ моделирования СНМ не учитывает многофакторность данного заболевания, в том числе роль недостаточности соединительной ткани и нарушения иннервации уретрального сфинктера после травматичных родов.
 Наибольшее распространение получили модели СНМ, основанные на использовании различных вариантов повреждения полового нерва, к которым можно отнести двустороннее иссечение и электрокаутеризацию/электрокоагуляцию нервных стволов.
Наибольшее распространение получили модели СНМ, основанные на использовании различных вариантов повреждения полового нерва, к которым можно отнести двустороннее иссечение и электрокаутеризацию/электрокоагуляцию нервных стволов.
Существует несколько подходов, при которых применяют различные хирургические доступы и способы разрушения нерва [14]. Чаще всего встречаются эксперименты с хирургическим иссечением полового нерва при переднем доступе через срединную лапаротомию [15]. При этом нервы с обеих сторон пересекают или иссекают на протяжении нескольких миллиметров, или повреждают мягкие ткани, окружающие среднюю и верхнюю треть уретры, с помощью электорокоагулятора. Поиск и визуализация полового нерва у мелких лабораторных животных сами по себе являются сложной задачей, требующей использования микроскопической техники. Кроме того, сучетом индивидуальной вариабельности расположения рабдомиосфинктера и его иннервации (от средней до проксимальной трети уретры) [15], возможную регенерацию полового нерва при его пересечении или электрокоагуляции не всем исследователям удается добиваться воспроизводимого и стабильного проявления СНМ. Объективным показателем наличия СНМ является снижение LPP – уродинамического показателя, позволяющего судить об эффективности работы сфинктера [5].
В нашем эксперименте по отработке экспериментальной модели мы также пытались иссекать (n=6) и электрокоагулировать (n=4) половой нерв при переднем доступе, при этом уретру сепарировали на протяжении средней и верхней третях, полностью разрушали мягкие ткани, окружающие орган. Лишь у двух животных после билатеральной электрокоагуляции удалось добиться снижения LPP с 78±6,9 до 71,3±8,2 мм рт.ст.
В редких публикациях исследователи для пересечения полового нерва применяют задний доступ [16], где в области подвздошно-крестцовой ямки можно выявить ветвления седалищного нерва, в том числе и отхождение полового нерва. Только при использовании данного доступа при повреждении всех ветвей, отходящих от седалищного нерва, нам удалось получить воспроизводимое стабильное снижение LPP. Для окончательной отработки модели, определения объема выборки основного эксперимента и определения критериев верификации результатов лечения был проведен пилотный эксперимент.
Материалы и методы. Использовали половозрелых самок крыс Spraque Dawley массой 290–330 г. Животных содержали в комнате барьерного типа. Условия содержания соответствовали стандартам, указанным в руководстве The Guide for Care and Use of Laboratory Animals [17]. До операции животных содержали по 5 особей, после – по одной в поликарбонатных клетках на подстиле. Корм и профильтрованную водопроводную воду давали ad libitum. В комнатах содержания животных поддерживали 12-часовой цикл освещения и 10-кратную смену объема воздуха в час. Все процедуры и манипуляции, проводимые с животными, были одобрены институтской комиссией по гуманному обращению с животными (IACUC).
Животные были разделены на две группы по 6 особей: группу ложнооперированных и группу тех, у кого было смоделировано СНМ.
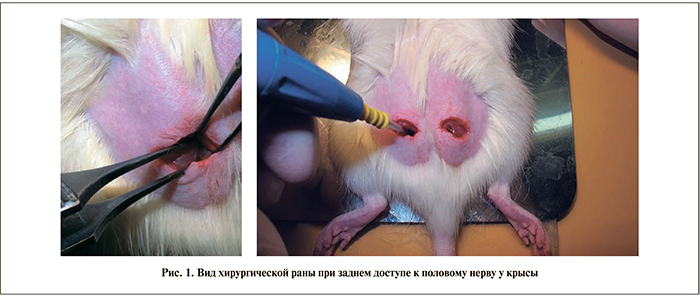
Экспериментальная модель. Доступ к половому нерву осуществляли с двух сторон. Для этого наркотизированным животным делали двусторонние надрезы над большой ягодичной мышцей, препарировали ягодичную мышцу, обеспечивая доступ к нервным отросткам, отходящим от седалищного нерва (рис. 1). При помощи электрокоагулятора при мощности коагуляции 50 ЕД коагулировали нервные отростки, среди которых находится и половой нерв. Для этого у животного удаляли шерсть с области живота (примерно 2 см2), смачивали кожу на месте удаления шерсти и помещали животное на специальную пластину, обеспечивающую увеличение электропроводности при использовании ножа-коагулятора. Вводили нож коагулятора в рану на задней поверхности туловища в подвздошно-крестцовую ямку и коагулировали нервные окончания, выходящие из позвоночного столба, в течение 10–15 с. После этого рану ушивали и внутримышечно вводили антибиотик байтрил в объеме 0,1 мл.
В группе ложнооперированных животных делали двусторонние разрезы кожи над ягодичной мышцей и ушивали.
Уродинамическое исследование. У всех животных перед моделированием СНМ через 7 и 14 сут (перед эвтаназией) регистрировали давление в мочевом пузыре, необходимое для истечения первой капли мочи из мочевого пузыря (LPP). Для этого животных предварительно наркотизировали смесью золетил 100: рометар (1:3) в объеме 30 мкл смеси на 100 г массы тела животного и катетеризировали мочевой пузырь через уретру (катетер РЕ 50). Объем мочевого пузыря измеряли как максимальный объем воды, вводимый в мочевой пузырь, при котором происходило мочеиспускание. Данный показатель необходим для определения объема жидкости, вводимой в мочевой пузырь при измерении LPP. LPP измеряли следующим образом: в мочевой пузырь вводили половину объема мочевого пузыря, а затем осторожно надавливали на переднюю брюшную стенку. Регистрировали давление, которое было достигнуто при появлении первой капли мочи в устье уретры при помощи датчика давления (MLT0670, «ADInstruments», США) и системы регистрации давления PowerLab PL3504 и мостикового усилителя FE224 («ADInstruments», США). Проводили последовательно 5 измерений LPP.
 Гистологическое исследование. После эвтаназии осуществляли забор уретры вместе с мочевым пузырем, которые помещали в 10%-ный раствор формалина, затем заливали в парафин и делали серийные поперечные срезы толщиной 5–7 мкм на 15 уровнях от дистального конца уретры до шейки мочевого пузыря. Препараты окрашивали гематоксилином, эозином и пикросириусом красным.
Гистологическое исследование. После эвтаназии осуществляли забор уретры вместе с мочевым пузырем, которые помещали в 10%-ный раствор формалина, затем заливали в парафин и делали серийные поперечные срезы толщиной 5–7 мкм на 15 уровнях от дистального конца уретры до шейки мочевого пузыря. Препараты окрашивали гематоксилином, эозином и пикросириусом красным.
Для морфологического подтверждения СНМ проводили морфометрическое исследование поперечных срезов уретры при увеличении объектива 5 с измерением площади просвета уретры (Sпросвет) и площади области уретры в пределах наружного периметра циркулярного (наружного) мышечного слоя (Sуретра). Рассчитывали индекс площади просвета уретры (ISпросвета) как отношение Sпросвет/Sуретра·100, который рассматривали как морфометрический показатель, отражающий наличие СНМ. Данный способ оценки, на наш взгляд, более достоверно отражает зияние просвета уретры, чем определение абсолютной площади просвета [15]. При этом оценка абсолютных значений площади просветов любых полых органов может быть искажена, так как при гистологической проводке возможны отклонения просвета и стенок органа относительно центральной оси. В связи с этим при морфометрическом исследовании необходимо оценивать именно соотношение двух измеряемых показателей (Sпросвет/Sуретра), что нивелирует ошибки измерений, которые возникают при получении нестрого поперечных срезов уретры, деформирующейся при фиксации (рис. 2), и позволяет получать более достоверные данные.
Результаты. Животные удовлетворительно переносили проводимые хирургические манипуляции, летальность отсутствовала.
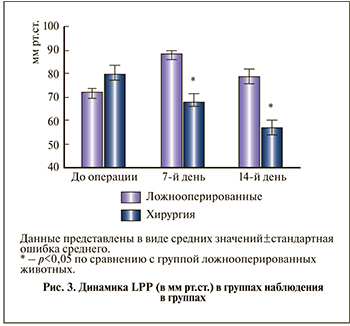
Динамика LPP. В опытной группе наблюдали статистически значимое снижение LPP при надавливании на переднюю брюшную стенку. По сравнению с исходным значением (79,8±3,6 мм рт.ст.) через 7 сут этот показатель снизился до 67,9±3,5 мм рт.ст., а через 14 сут – до 57,0±3,4 (р<0,05). В группе ложнооперированных животных этот показатель статистически значимо увеличивался на 7-й день (р<0,05), а на 14-й день не отличался от исходного (рис. 3).
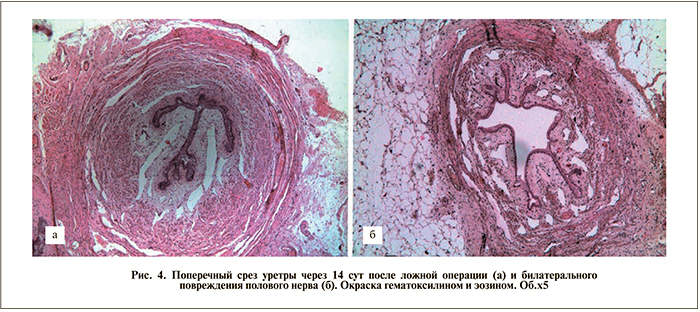
Гистоморфометрическое исследование. Для гистоморфометрического исследования были отобраны серийные поперечные срезы проксимальной и средней третей уретры (10–17 срезов на каждое животное) [15]. Ни в той, ни в другой группе каких-либо патологических изменений в стенке уретры обнаружено не было (рис. 4).
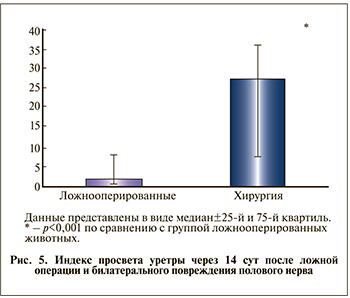
Выраженного истончения циркулярного слоя мышц выявлено также не было. Просвет органа четко определялся в обеих группах, и площадь его была статистически значимо больше в опытной группе (рис. 5).
Таким образом, наличие СНМ у животных с использованием экспериментальной модели, описанной выше, было подтверждено соответствующей динамикой уродинамического показателя (LPP) и увеличением просвета уретры при морфометрии. Данная модель состоятельна и воспроизводима, что позволяет использовать ее при дальнейших доклинических исследованиях.
Обсуждение. Экспериментальные модели СНМ, предусматривающие введение различных токсинов, использование баллонной дилатации влагалища и сфинктеротомию, не релевантны и не обеспечивают получение воспроизводимых результатов по уродинамическим и морфометрическим показателям. Модель с использованием уретролиза высокотравматична и не соответствует механизмам развития СНМ у женщин.
Помимо воспроизводимости уродинамических и морфометрических показателей важным условием для большинства исследований является длительное сохранение СНМ для изучения отсроченных результатов лечебных воздействий. Согласно приведенным данным литературы, модели с персистирующим СНМ создаются путем иссечения половых нервов. Однако и здесь отсутствует единый стандарт выполнения хирургических манипуляций, что затрудняет сопоставление результатов, полученных разными исследователями. В нашем эксперименте, представленном в настоящей статье, не отмечено достоверного снижения уровня LPP у всех животных при использовании наиболее часто встречаемого в литературе переднего доступа к половым нервам у крыс. Вероятно, это связано с индивидуальной вариабельностью локализации рабдомиосфинктера и, соответственно, половых нервов, а возможно, и с быстрой регенерацией последних. При использовании заднего доступа и повреждении проксимальной части полового нерва, отходящей от седалищного нерва, нам удалось получить воспроизводимое стабильное снижение LPP и расширение просвета уретры (по данным гистоморфометрического исследования). На наш взгляд, данная экспериментальная модель, являясь более простой в хирургическом исполнении, может быть наиболее востребованной при проведении доклинических исследований безопасности и эффективности объемообразующих препаратов, тканеинженерных конструкций и клеточных технологий коррекции СНМ. К достоинства данного подхода относятся воспроизводимость результатов и сохранение симптомов СНМ в течение длительного времени, необходимое для оценки эффективности новых лечебных тактик.
Таким образом, на основании проведенных анализа литературы и собственного экспериментального исследования обоснован выбор оптимальной экспериментальной модели СНМ, характеризующейся разрушением проксимального отдела полового нерва в области его непосредственного отхождения от седалищного нерва при заднем хирургическом доступе и воспроизводимым снижением уродинамических показателей и соответствующих морфологических изменений уретры.
Работа выполнена при финансовой поддержке РФФИ по проекту 13-04-12031 офи_м и по гранту Президента Российской Федерации для государственной поддержки молодых российских ученых №14.120.14.540-МД.


