Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) – полиэтиологическое заболевание, возникающее вследствие разрастания периуретральной железистой зоны простаты, приводящего к обструкции нижних мочевыводящих путей. Основной контингент больных составляют мужчины старше 50 лет.
Гиперплазия простаты проявляется рядом симптомов (их часто объединяют под общим названием – симптомы нижних мочевыводящих путей [СНМП]): уменьшением напора струи мочи, необходимостью просыпаться ночью для мочеиспускания, ощущением неполного опорожнения мочевого пузыря, наличием ургентных позывов к мочеиспусканию, ургентного недержания мочи, увеличением времени и длительности мочеиспускания, натуживанием при начале мочеиспускания (особенно в утренние часы) [1].
Наиболее существенным фактором риска, ассоциированным с развитием СНМП, является возраст [2]. Средний возраст появления симптомов заболевания – 60 лет, однако симптомы ДГПЖ появляются у 40% мужчин в возрасте от 50 до 60 лет. С возрастом частота развития ДГПЖ увеличивается. Так, в возрасте 90 лет симптомы гиперплазии простаты проявляются у 90% мужчин. Несмотря на то что СНМП часто рассматривают в качестве особенности старения мужчин, некоторые изменения в поведении могут приводить к увеличению этого риска (например, избыточный прием кофеин-содержащих напитков, прием жидкости преимущественно в вечернее время и пр.). Физическая активность способствует снижению риска развития СНМП на 29%, в то время как индекс массы тела больше 30 повышает риск развития СНМП у мужчин на 41% [3]. Однако увеличение размера предстательной железы клинически проявляется не всегда: к 60 годам ДГПЖ в разной степени проявляется у 60% мужчин. Симптомы нижних мочевыводящих путей встречаются не только при ДГПЖ, но и при инфекциях нижних мочевыводящих путей, нейрогенных расстройствах мочеиспускания, стриктуре уретры, раке простаты, раке мочевого пузыря, хроническом простатите [4].
Диагностика ДГПЖ основывается на жалобах, анамнезе, данных физикального обследования, лабораторных и инструментальных методов. Жалобы больных выявляют и анализируют с помощью Международной шкалы оценки симптомов предстательной железы (IPSS – International Prostate Symptom Score); пальцевое ректальное исследование (ПРИ) проводят с целью определения размеров простаты, признаков рака. Также выполняют общий анализ мочи, оценивают концентрацию креатинина и мочевины, простатспецифического антигена (ПСА), в обязательном порядке проводят УЗИ простаты с определением объема остаточной мочи, урофлоуметрию [4].
Подходы к лечению ДГПЖ зависят от стадии заболевания и клинических проявлений, возраста, сопутствующей патологии.
Медикаментозную терапию начинают с применения α-адреноблокаторов (α-АБ) – лечения, направленного на расслабление гладкой мускулатуры мочевыводящих путей и облегчение процесса мочеиспускания. Больным с объемом простаты более 40 мл дополнительно назначают ингибиторы 5α-редуктазы для снижения риска оперативного лечения и острой задержки мочеиспускания [5]. Антагонисты мускариновых рецепторов назначают пациентам с умеренными и тяжелыми СНМП с преобладанием симптомов накопления.
Согласно рекомендациям Европейской ассоциации урологов α1-адреноблокаторы (α1-АБ) являются препаратами первой линии (степень рекомендации А, уровень доказательства 1а) для лечения пациентов с СНМП, вызванными ДГПЖ [6]. Цель подобного лечения – уменьшить выраженность ирритативной (ноктурия, ургентные, учащенные позывы к мочеиспусканию) и обструктивной (затрудненное мочеиспускание, ослабление струи мочи, ощущение неполного опорожнения мочевого пузыря) симптоматики.

Поскольку на данный момент доступно немало препаратов данной группы, актуален вопрос выбора оптимального из них. Многие непрямые сравнения между плацебо-контролируемыми исследованиями, так же как и не столь многочисленные прямые сравнительные исследования, продемонстрировали одинаковую клиническую эффективность α1-АБ при использовании их в адекватных дозировках [7]. Однако α1-АБ характеризуются разной переносимостью, что связано с их селективностью по отношению к различным подтипам адренорецепторов. Это особенно важно с точки зрения риска развития нежелательных реакций со стороны сердечно-сосудистой системы [8].
Силодозин является высокоселективным антагонистом α1А-адренорецепторов, одобренным для лечения пациентов с симптомами и признаками ДГПЖ. Фармакологический профиль силодозина отличается рядом преимуществ, как то: самая высокая уроселективность, возможность приема 1 раз в день стандартной дозы 8 мг, которая не требует коррекции в зависимости от возраста, возможность одновременного применения без коррекции дозы с ингибиторами фосфодиэстеразы 5-го типа (ФДЭ-5) и с антигипертензивными препаратами. Согласно исследованиям in vitro, сродство силодозина к α1A-рецепторам более чем в 160 раз превосходит таковое к α1B-рецепторам и более чем в 50 раз – к α1D-рецепторам [9]. Селективность силодозина к α1A-рецепторам примерно в 17 раз выше, чем у тамсулозина [10]. Для силодозина характерно быстрое развитие эффекта, его можно применять всем пациентам, страдающим ДГПЖ и имеющим показания к приему α-АБ. Благодаря своей селективности, превосходящей все имеющиеся на рынке аналоги, силодозин обладает преимуществами по безопасности при лечении ДГПЖ у пациентов, страдающих гипотензией, тахикардией, тахиаритмией, особенно на фоне ИБС [11, 12], язвенной болезнью желудка и двенадцатиперстной кишки, гиперацидным гастритом. Силодозин не повышает риск развития гипотензии у пациентов, которые принимают антигипертензивную терапию (препараты, действующие на ренин-ангиотензиновую систему, β-блокаторы, блокаторы кальциевых каналов и диуретики). Силодозин совместим со всеми группами гипотензивных препаратов, кроме вазоактивных α-АБ. При совместном назначении силодозина и гипотензивной терапии коррекции дозировок не требуется [7]. Однако этой категории больных силодозин должен назначаться с учетом пожеланий и предупреждений компании-производителя о возможных взаимодействиях с другими лекарственными веществами.
Измерение максимальной скорости мочеиспускания (Qmax) в клинических исследованиях показало, что действие препарата наступает спустя 2–6 ч после приема первой дозы силодозина; результаты заполнения шкалы симптомов нарушения мочеиспускания в ходе первой недели после начала лечения указывают на то, что изменение суммарного балла по шкале IPSS по сравнению с исходным наступает уже через 3–4 дня [14].
По сравнению с плацебо силодозин способствует значительному улучшению показателей при оценке по шкале IPSS, увеличению Qmax), препарат обладает потенциально лучшим профилем сердечно-сосудистой безопасности, однако сопряжен с более высоким риском развития нарушений эякуляции [13].
Цель настоящего исследования: оценить лечебный эффект силодозина 8 мг 1 раз в сутки для больных симптоматической ДГПЖ.
Первичная цель: подтвердить эффективность силодозина при лечении СНМП/ДГПЖ, основываясь на суммарном балле по шкале «Международная шкала суммарной оценки симптомов предстательной железы» (IPSS).
Вторичные цели: оценить изменение суммы баллов в анкете IPSS (раздельно суммарный балл по оценке симптомов мочеиспускания и удержания мочи и суммарный балл по оценке качества жизни), получить дополнительные данные по безопасности силодозина.
Данный проект являлся неинтервенционным (наблюдательным) многоцентровым проспективным исследованием, предполагавшим наблюдение за больными ДГПЖ и СНМП, которым проводилось лечение силодозином.
Материалы и методы. В исследовании приняли участие 40 врачей из 39 клинических центров различных регионов России (13 центров в Москве, 6 – на Урале, 3 – на Дальнем Востоке, 3 – в Центральном регионе, 2 – в Приволжском округе, 5 – на Юге России, 4 – в Сибири и 3 – в Северо-Западном регионе), которые использовали анкету IPSS в своей повседневной практике*. Выбор метода лечения и методов обследования пациента осуществлялся врачом, наблюдающим пациента, в соответствии с принятой практикой лечебного учреждения, без какой-либо связи с фактом проведения какого-либо (в том числе данного) научного проекта. Таким образом, собранные данные должны отражать реальную практику диагностики и лечения больных ДГПЖ в России.
Пациентов обследовали в соответствии с практикой лечебного учреждения и по усмотрению врача. Пациентов осматривали в среднем через 4 (визит 2) и 8 (визит 3) недель после включения в исследование. Всего в рамках данного исследования было предусмотрено 3 визита пациента. Силодозин назначался в дозе 8 мг 1 раз в сутки перорально во время приема пищи.
Критерии включения в исследование: мужчины в возрасте 50 лет и старше с наличием СНМП, обусловленными ДГПЖ, пациенты, которым назначено лечение силодозином и которые подписали информированное согласие на обработку персональных данных. В исследование не включали пациентов, которым силодозин противопоказан, или тех, которые не подписали информированное согласие.
На каждом визите исследователь регистрировал все сопутствующие препараты, который пациент принимал с прошлого визита, помимо силодозина, препараты для лечения нежелательных явлений (НЯ) и др. Протокол не оговаривает каких-либо специальных условий или терапии, которые были бы запрещены в данном исследовании.
Изменение балла IPSS относительно исходного уровня тестировалось с использованием парного теста Стьюдента или знакового критерия Вилкоксона (в зависимости от нормальности распределения данных изменения). Тест Манна–Уитни использовали для тестирования изменений в точке последнего доступного наблюдения для сравнения между группами.
Оценку качества жизни (QoL) анализировали аналогично первичной переменной эффективности. К эпидемиологическим данным относятся данные анамнеза и терапии ДГПЖ.
Всего в данное неинтервенционное исследование планировалось включить 1000 пациентов, получавших лечение в условиях обычной клинической практики, для обеспечения репрезентативности выборки пациентов с упомянутым диагнозом.
В статистический анализ должны быть включены пациенты, имеющие хотя бы одно обследование, удовлетворяющие критериям включения и подписавшие информированное согласие. Популяция для анализа составила 1000/1000 (100%) пациентов.
Результаты. В исследование были включены 1000 пациентов (как и планировалось). Популяция для анализа безопасности также составила 1000 пациентов. Средний возраст пациентов составил 64,99±8,07 года (медиана – 64,5 года), средняя длительность ДГПЖ – 3,64±5,058 года (медиана – 1,1 года). Представителей европеоидной расы было 980 человек, монголоидной – 20.
Демографические и другие исходные показатели обследованных пациентов представлены в табл. 1.
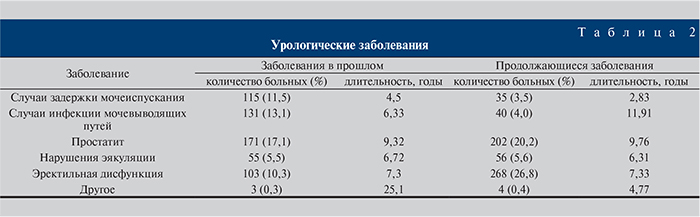
В табл. 2 представлены сведения об урологическом анамнезе пациентов, включая данные о заболеваниях, имевших место в прошлом и продолжавшихся на момент сбора информации.
Из данных анамнеза жизни в разделе перенесенных ранее заболеваний с наибольшей частотой встречались острый инфаркт миокарда – 39/1000 (3,9%) пациентов и нарушения мозгового кровообращения – 39/1000 (3,9%) пациентов. Другие предшествующие заболевания по частоте не достигали 3%.
Сопутствующих заболеваний было отмечено больше, чем предшествующих. Артериальная гипертензия наблюдалась у 441/1000 (44,1%) пациентов. Сопутствующие сердечно-сосудистые заболевания были зарегистрированы у 205/1000 (20,5%) пациентов. Сахарный диабет имел место у 137 (13,7%) пациентов.
Досрочно выбыли из исследования 12 (1,2%) мужчин: у 4 пациентов развилась нежелательная лекарственная реакция, 1 пациент отозвал информированное согласие, 7 были потеряны для наблюдения.
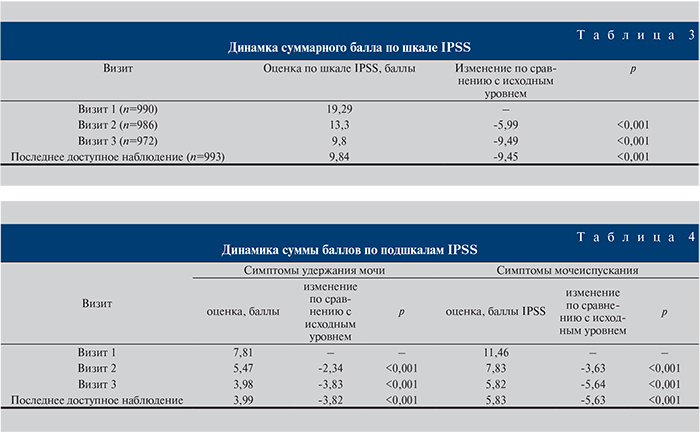
Первичной переменной эффективности было принято изменение суммарного балла по шкале IPSS (табл. 3). Вторичной переменной был анализ подшкал опросника IPSS.
Был проведен анализ подшкал опросника IPSS. Сумма баллов, полученных при ответах на вопросы 2, 4, 7, характеризует симптомы удержания мочи, на вопросы 1, 3, 5, 6 – симптомы мочеиспускания.
Динамика суммы баллов подшкал IPSS представлена в табл. 4.
Результаты оценки качества жизни (QoL) с помощью опросника IPSS (табл. 5) свидетельствовали о положительной динамике показателя.
Малоинвазивный метод лечения (радиочастотная термотерапия) был использован 7 (0,7%) пациентами, трансуретральная резекция предстательной железы – 51 (5,1%), простатэктомия – 4 (0,4%) пациентами.
Препараты группы α-АБ ранее принимали 368 (36,8%) пациентов, из них 240 (2,4%) – тамсулозин, финастерид/дутастерид ранее получали 50 (5%) обследованных. На период сбора данных финастерид/дутастерид принимали 57 (5,7%) мужчин. 303 (30,3%) пациента получали сопутствующую терапию по поводу различных заболеваний. Чаще всего участники исследования принимали препараты для лечения сахарного диабета (4,5%), препараты, влияющие на ренин-ангиотензиновую систему (12,2%), препараты для лечения урологических заболеваний (3,9%), антибиотики (3,8%).
В рамках исследования осуществлен сбор данных об урологических обследованиях, которые прошли пациенты в рамках рутинной клинической практики. На визите 1 у 7 (0,7%) пациентов наблюдались отклонения от нормы по результатам биопсии простаты. На момент последнего доступного наблюдения ситуация не изменилась.
За время исследования у 12 (1,2%) пациентов было зарегистрировано 13 НЯ, из них у 9 НЯ соответствовали легкой степени тяжести, у 2 средней и у 1 пациента информация о степени тяжести НЯ отсутствовала. Почти все НЯ были связаны с принимаемым препаратом (силодозин); в двух случаях информации о связи с препаратом не было.
Встречались следующие НЯ: головокружение – 4 пациента (по 2 случая легкой и средней степеней тяжести), нарушение эякуляции – 8 пациентов (легкая степень тяжести), заложенность носа – 1 пациент (нет данных о тяжести). К моменту завершения участия в исследовании у 3 пациентов НЯ разрешилось без последствий, у 4 на момент сбора данных НЯ разрешалось, пациенты выздоравливали, у 3 исход НЯ неизвестен, от 2 пациентов нет данных (на усмотрение исследователя возможные ответы были «нет данных» и «неизвестно»). Градация степеней тяжести определялась непосредственно лечащими врачами.

Обсуждение. Препараты разных поколений α-АБ различаются не столько эффективностью, сколько переносимостью. Селективность, определяющая поколение α-АБ, выражается в основном в частоте побочных реакций при сопоставимых показателях клинической эффективности. Так, к α-АБ, даже самым первым, никогда не было нареканий на предмет низкой эффективности. В настоящее время к данным препаратам предъявляются повышенные требования в плане селективности при состояниях, клинически схожих с побочными действиями α-АБ. Например, склонность к гипотензии в анамнезе, особенно на фоне ИБС (α-АБ повышают потребность миокарда в кислороде и могут спровоцировать приступ аритмии или стенокардии), до недавнего времени была поводом для отказа от лечения ДГПЖ α-АБ.
С учетом возраста больных ДГПЖ (СНМП) старше 50 лет фактор безопасности в отношении сердечно-сосудистой системы при сочетанном приеме α-АБ с гипотензивными препаратами, а также с ингибиторами ФДЭ-5 становится особенно актуальным.
Тахикардия и тахиаритмия в настоящее время неплохо корригируются медикаментозно, однако если необходимо назначить данному больному α-АБ, то селективность нужна более высокая. Тем самым снижается риск рецидива нарушения ритма и стенокардии. В силу своей наивысшей уроселективности силодозин предпочтителен, если пациент принимает гипотензивные препараты, а также ингибиторы ФДЭ-5 (силденафил, тадалафил). Кроме того, α-АБ могут усиливать желудочную секрецию и моторику желудочно-кишечного тракта. Гастроэнтерологические противопоказания присутствуют в аннотациях далеко не всех препаратов этой группы. Однако, если пациент страдает язвой или эрозиями желудка, пищевода, двенадцатиперстной кишки, рецидивирующим гиперацидным гастритом и одновременно имеет показания к приему α-АБ, препаратом выбора будет наиболее селективный из них – силодозин.
Заключение. Таким образом, положительный эффект лечения больных ДГПЖ силодозином в дозе 8 мг 1 раз в сутки подтвержден статистически значимой положительной динамикой субъективных показателей качества мочеиспускания, доказана безопасность данного препарата. С учетом эффективности, безопасности, быстроты наступления эффекта после первого приема препарата (на основании различных клинических исследований и согласно данным компании производителя), а также его экономической доступности силодозин может рассматриваться как препарат выбора в лечении ДГПЖ, особенно для пациентов с сопутствующей патологией сердечно-сосудистой системы и желудочно-кишечного тракта с учетом пожеланий и предупреждений компании-производителя о возможных взаимодействиях препарата с другими лекарственными веществами.



