Введение. По данным Американского онкологического общества, в 2013 г. диагностировано 238 810 новых случаев рака предстательной железы (РПЖ), что делает его самой распространенной злокачественной опухолью у мужчин [1]. У среднего мужчины в США риск развития РПЖ в течение жизни превышает 16% [2]. Несмотря на то что радикальная простатэктомия (РПЭ) является довольно сложной в техническом отношении процедурой, только в 2010 г. было выполнено более 138 тыс. подобных вмешательств [1].
По мере совершенствования хирургической техники РПЭ снижается частота осложнений, однако неблагоприятные результаты остаются стандартным явлением. Одним из последствий РПЭ являются стриктуры везико-уретрального анастомоза (ВУА). Рубцовая ткань в зоне ВУА приводит к стенозированию шейки мочевого пузыря, а следовательно, к повышению риска развития обструктивных симптомов нижних мочевыводящих путей (СНМП). Наиболее широко используемые урологами эндоскопические методы лечения этого осложнения позволяют восстанавливать мочеиспускание, но в то же время могут обусловливать появление проблем инконтиненции.
 По мере совершенствования техники выполнения оперативного вмешательства, в частности, с использованием марсупилизации слизистой оболочки шейки мочевого пузыря регистрируют стенозы ВУА все реже. Действительно, частота этого осложнения после РПЭ снизилась с 10–20% [3, 4] в 1990 г. до приблизительно 1–3% в настоящее время [5, 6]. В то же время стеноз ВУА остается одним из самых распространенных осложнений после РПЭ [7], который, как показывает опыт, появляется в течение первых 5 мес. в после операции [5, 8–10].
По мере совершенствования техники выполнения оперативного вмешательства, в частности, с использованием марсупилизации слизистой оболочки шейки мочевого пузыря регистрируют стенозы ВУА все реже. Действительно, частота этого осложнения после РПЭ снизилась с 10–20% [3, 4] в 1990 г. до приблизительно 1–3% в настоящее время [5, 6]. В то же время стеноз ВУА остается одним из самых распространенных осложнений после РПЭ [7], который, как показывает опыт, появляется в течение первых 5 мес. в после операции [5, 8–10].
В качестве факторов, которые могут выступать в роли причин возникновения стриктуры ВУА, рассматривают образование гематомы, методику восстановления шейки мочевого пузыря, послеоперационный мочевой затек и продолжительность катетеризации после РПЭ [3, 11]. Кроме того, было установлено, что на риск развития стриктуры ВУА влияют такие связанные с больным факторы, как ожирение, возраст, курение и хронические заболевания (гипертензия, сахарный диабет) [11, 12]. В конечном итоге стриктура ВУА, вероятно, имеет многофакторный характер.
Вместе с тем механизмы возникновения стенозирующего процесса в зоне ВУА полностью не изучены [13]. Так, результаты статистического анализа не выявили достоверной корреляционной связи между развитием стеноза ВУА и возрастом больного, объемом кровопотери, длительностью операции, назначением неоадьювантной терапии, предшествовавшей трансуретальной резекции предстательной железы, сохранением сосудисто-нервных пучков и стадией РПЖ [14].
Целью нашей работы стало изучение воспалительных изменений в препарате удаленного при РПЭ органокомплекса.
Материалы и методы. За 2013–2014 гг. одним хирургом были прооперированы 120 пациентов, которым была выполнена РПЭ, у 5 больных имело место развитие стеноза ВУА в сроки от 6 мес. до года после РПЭ. Больные с благополучным течением послеоперационного периода составили 1-ю группу, а пациенты, у которых имело развитие стеноза ВУА (в сроки от 6 мес. до 1 года) после РПЭ, – 2-ю (рис. 1).
В 1-й группе основная доля пациентов имела клиническую стадию Т1с: сТ0 – 1,5% наблюдений; сТ1а – 1,5%; сТ1с – 59,9%; сТ2а – 12,2%; сТ2b – 7,6%; сТ2с – 17,3%. При определении патологической стадии после РПЭ отмечен феномен «миграции» стадии болезни почти в 50% случаев: рТ2а – 9,2%; рТ2b – 10,7%; рТ2с – 32,2%; рТ3а – 28,1%; рТ3b – 15,3%; рТ4 – 4,5%.
Во 2-й группе у 3 пациентов исходно диагностирована стадия сТ1с, у 2 – сТ2а и сТ2с. Гистологическая стадия после РПЭ у двоих пациентов с ранее диагностированной стадией сТ1с была определена как рТ3а, у других троих имел место локальный рак.
По остальным параметрам: возрасту, уровню простатспецифического антигена, объему простаты, процентному содержанию опухолевой ткани в столбике биоптата при биопсии простаты, индексу Глисона после РПЭ, процентному содержанию опухоли в макропрепарате, достоверных различий между группами больных не выявлено (см. таблицу).

Морфологический материал фиксировали в растворе нейтрального 10%-ного забуференного формалина (PBS буфер) с экспозицией не более 24 ч. Вырезка хирургического материала осуществлена согласно алгоритму приема предстательной железы при РПЭ с маркировкой зон вырезки и присвоению каждому фрагменту отдельного номера. После этого проводку материала осуществляли в автоматическом гистопроцессоре Sacura, далее материал заливали в парафиновые блоки, готовили срезы толщиной 4–5 мкм и окрашивали гематоксилином и эозином по стандартной методике.
Гистологический материал оценивали согласно алгоритму описания при опухолях предстательной железы с определением формы РПЖ с указанием распространенности опухоли по зонам и долям, суммы Глисона, на наличие сосудистой и периневральной инвазии, врастания/прорастания псевдокапсулы железы, оценки хирургических краев резекции. Кроме этого проведена оценка изменений ткани предстательной железы вне опухоли, выявлены доброкачественные гиперпластические процессы, зоны некрозов, фиброза, а также признаки воспаления. При наличии воспалительного инфильтрата оценивали зональность распространения (область основания, апикальная область, доли), объем распространения (очаговое или диффузное поражение) и характер воспалительного инфильтрата.
 Для верификации воспалительного процесса использовали следующие морфологические признаки: 1) наличие в ткани простаты воспалительных инфильтратов, состоящих преимущественно из лимфоидных элементов с включением макрофагов, гистиоцитов и эозинофилов и расположенных чаще вокруг ацинусов и кровеносных сосудов, реже диффузно; 2) наличие в инфильтратах плазматических клеток; 3) фиброзирование стромы железы; 4) склеротические изменения стенок кровеносных сосудов железы.
Для верификации воспалительного процесса использовали следующие морфологические признаки: 1) наличие в ткани простаты воспалительных инфильтратов, состоящих преимущественно из лимфоидных элементов с включением макрофагов, гистиоцитов и эозинофилов и расположенных чаще вокруг ацинусов и кровеносных сосудов, реже диффузно; 2) наличие в инфильтратах плазматических клеток; 3) фиброзирование стромы железы; 4) склеротические изменения стенок кровеносных сосудов железы.
Степень плотности воспалительного инфильтрата оценивали при увеличении объектива 40, окуляра 10 в трех полях зрения. В случае незначительного разброса количественных показателей в разных полях зрения определяли среднее арифметическое значение. При наличии 0–5 лимфоидных клеток в поле зрения говорили об отсутствии воспаления (-); от 5 до 10 – о слабо выраженном воспалении (+), от 10 до 30 – об умеренно выраженном (++) и свыше 30 лимфоидных клеток – о резко выраженном воспалительном процессе (+++).
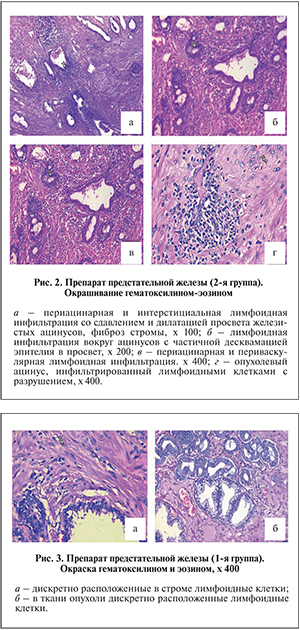
Результаты. При исследовании гистологических препаратов пациентов 2-й группы были выявлены воспалительные изменения в ткани простаты, характерные для хронического интерстициального неспецифического простатита формы. Эти изменения выражались в диффузно-очаговой воспалительной инфильтрации стромы предстательной железы, локализующейся во всех зонах железы (апикальной области, основании, в периферических и центральных отделах), преимущественно вокруг ацинарных железистых структур и протоков периваскулярно. Воспалительный инфильтрат локализовался как интерстициально, так и в железистых ацинарных структурах в виде внутриэпителиальных микроабсцессов с частичным разрушением ацинусов. Воспалительный инфильтрат по зонам распределялся неравномерно, его интенсивность варьировалась от выраженной степени (+++) до слабой (+). Воспаление в ткани предстательной железы было представлено лимфоидными клетками с морфологией малого лимфоцита, а также гистиоцитами, немногочисленными плазматическими клетками и единичными эозинофильными и нейтрофильными лейкоцитами. Периацинарная инфильтрация сопровождалась дилатацией ацинусов с выраженной десквамацией простатического эпителия (рис. 2, а, б), и в большей части ацинусов просвет был выполнен перерожденными амилоидными тельцами. При этом воспалительная инфильтрация локализовалась как в зоне опухолевого процесса (рис. 2, г), так и в ткани железы на остальном протяжении (рис. 2, а, б).
В сосудах стромы определялись явления васкулита (рис. 2, в), стенки были утолщены, отечны, эндотелиальные и адвентициальные клетки гиперплазированы. Отмечено парапростатическое распространение воспалительного инфильтрата в периферических зонах предстательной железы, апикальной области и в основании.
У всех пациентов данной группы имела место фибротизация стромы железы, которая выражалась в утолщении и уплотнении коллагеновых волокон межуточной ткани, межмышечном фиброзе и гиалинозе, дистрофии и атрофии гладкомышечных волокон, периваскулярном фиброзе. Особенно ярко этот процесс был выражен в области основания железы и парапростатических тканях области шейки мочевого пузыря, где анатомически строма более плотная за счет гипертрофии мышечных клеток, поэтому фиброз и ангиоматоз стромы можно было четко верифицировать.
У 4 пациентов в препарате простаты отмечено резко выраженное воспаление с примесью единичных эозинофильных лейкоцитов, локализующееся преимущественно в периферических отделах, апикальной зоне, в области основания с инфильтрацией псевдокапсулы железы и выходом воспалительной инфильтрации в парапростатические ткани.
У 1 пациента преобладало хроническое воспаление умеренно выраженной степени; с той же зональностью распределения, что у остальных в группе, распространение воспалительного инфильтрата в парапростатические ткани носило очаговый характер. Острого воспаления не отмечено ни у одного пациента 2-й группы.
У всех пациентов 2-й группы был отмечен фиброз стромы железы, более выраженный в области основания: межмышечный фиброз, периваскулярный фиброз с признаками распространения на перипростатические ткани, которые оценивались по хирургическим краям резекции.
При исследовании гистологических препаратов пациентов 1-й группы была выявлена умеренная и слабовыраженная степень воспалительной инфильтрации в ткани простаты. При этом распределение воспалительного инфильтрата в ткани железы носило преимущественно очаговый характер и при подсчете воспалительных клеток исследовалось 5 полей зрения с увеличением ×400 с последующим определением среднего арифметического значения степени инфильтрации. Клетки воспалительного инфильтрата лежали дискретно в строме (рис. 3, а) и в виде очаговых неравномерно расположенных лимфоидных инфильтратов, локализующихся преимущественно в зонах гиперплазии и в периуретральной части простаты. Фиброзирование стромы не было выражено.
По сравнению со 2-й группой пациентов в 1-й группе воспалительный инфильтрат преимущественно не затрагивал зон роста опухоли или был слабо выражен (рис. 3, б). Распространения очагов воспаления за пределы псевдокапсулы простаты, в перипростатической зоне отмечено не было у большинства пациентов, за исключением единичных больных со слабовыраженной ограниченной воспалительной инфильтрацией в указанных зонах. Фиброзирование стромы железы было неравномерным с очаговостью распределения, преимущественно в периферической зоне и в области основания (периваскулярно и межмышечно), при этом отмечена гипертрофия мышечных клеток в основании железы и парапростатических тканях шейки мочевого пузыря.
Обсуждение. Серьезную озабоченность хирургов после радикальной простатэктомии вызывают такие осложнения операции, как эректильная дисфункция и недержание мочи. Однако не менее значимой проблемой является стриктура ВУА, которая может развиваться даже в опытных руках, в том числе при применении видеоэндоскопической техники [15].
Воспаление простаты сильно коррелирует с развитием СНМП, и ряд исследователей показали, что простатический фиброз играет важную роль в патогенезе инфравезикальной обструкции. L. Wong и соавт. [16] высказали предположение, будто воспаление предстательной железы вызывает фиброзные изменения, но эти причинно-следственные взаимоотношения не имеют в литературе объективной оценки. В исследовании авторов изучена фиброзная реакция как ответ на воспаление в простате мышей при индуцированном хроническом бактериальном простатите. Показано значительное увеличение содержания коллагена и гидроксипролина в ткани простаты. Корреляционный анализ продемонстрировал прямую зависимость тяжести воспаления с накоплением коллагена в простате. Иммуногистохимически при гиперпродукции коллагена в большом количестве в воспаленной ткани предстательной железы определялись фиброциты. Эти данные указывают на то, что хроническое воспаление предстательной железы индуцирует образование коллагена и как следствие – подразумевает развитие фиброзного процесса в простате [16].
Не менее интересно исследование J. Ma и соавт. [17], в котором установлена зависимость фибротических изменений в простате и периуретральных тканях и СНМП. Были изучены простата и периуретральные ткани 28 мужчин, подвергнутых РПЭ. Проводили механическую оценку жесткости простаты. Фиксированные слои тканей были оценены на содержание коллагена и эластина в группах с наличием и отсутствием СНМП. Ткань простаты у мужчин с СНМП была значительно жестче (р=0,0016) и содержала больше коллагена (р=0,0038), чем у мужчин без СНМП. Авторы показали, что формирование внеклеточной соединительнотканной матрицы и фиброз ткани простаты в парауретральной зоне у мужчин с СНМП могут указывать на то, что фиброз может выступать как фактор, способствующий развитию СНМП.
В работе А. М. Пшихачева [18] показано, что при длительном течении воспалительного процесса в простате обнаруживается плоскоклеточная метаплазия эпителия ацинусов и протоков. Среди клеточных элементов воспалительных инфильтратов отмечаются лимфоидные и плазматические клетки с примесью макрофагов. Обращает на себя внимание, что показатели всех факторов роста в секрете простаты имеют повышенные величины при внеклеточном инфицировании. Это служит объективным показателем того, что именно при внеклеточном инфицировании доминируют так называемые противовоспалительные цитокины. В то же время указанные цитокины (факторы роста) одновременно являются факторами, стимулирующими процесс пролиферации. С позиций фазности течения воспалительного процесса становится понятно, что они стимулируют процесс регенерации, т.е. заживления, поэтому недостаточность факторов роста, обусловленная любой причиной, является основой хронизации воспалительного процесса, поскольку прерывает процесс репаративной регенерации. Наблюдается также плоскоклеточная метаплазия эпителия ацинусов и протоков; длительное течение воспалительного процесса сопровождается фибротизацией паренхимы и капсулы [18].
Таким образом, принимая во внимание данные, полученные другими авторами, можно утверждать, что перипростатическое воспаление простаты с вовлечением в процесс шейки мочевого пузыря и мышечных структур верхушки предстательной железы может коррелировать со стенотическими осложнениями в зоне ВУА после РПЭ.
Заключение. В ходе настоящего исследования нами верифицированы особенности воспалительно-фибротических изменений в препарате предстательной железы после РПЭ, сопутствующие простатической онкопролиферации. Представляется справедливым утверждение, будто воспалительные изменения в предстательной железе коррелируют с распространенностью фиброза в простате и в перипростатической зоне. Более выраженная воспалительная реакция в простате с экстракапсуляризацией процесса и вовлечением мышечнотканных перипростатических структур у пациентов, у которых после РПЭ развился стеноз ВУА, по сравнению с теми, у кого стеноз ВУА не отмечен, позволяет рассматривать данный феномен как фактор риска развития стенотических осложнений в зоне пузырно-уретрального сегмента после РПЭ.
В статье представлены результаты работ, выполненных при финансовой поддержке Министерства образования и науки Российской Федерации в рамках Соглашения о предоставлении субсидии № 14.607.21.0099, уникальный идентификатор прикладных научных исследований и экспериментальных разработок (проекта) RFMEFI60714X0099, ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы».


