Введение. За последнее время, по данным ВОЗ, частота бесплодия в браке не только не уменьшается, но продолжает расти. Установлено, что доля мужской инфертильности за последние 20 лет увеличилась с 8–10 до 30–40% всех случаев бесплодия [1]. Одна из причин мужского бесплодия – крипторхизм – аномалия, связанная с неопущением одного или двух яичек в мошонку. Дислокация яичка – распространенное нарушение развития репродуктивной системы, встречающееся у 30% недоношенных и 4% доношенных новорожденных [2]. В связи с этим в течение многих лет крипторхизм и его осложнения находятся в центре внимания исследователей и врачей [3].
Традиционные методы лечения крипторхизма недостаточно эффективны. Так, гормональная терапия (с использованием хорионического гонадотропина) – метод лечения, который широко применяется уже более 30 лет, но эффективность его оценивается неоднозначно [4] и по сравнению с группой плацебо не превышает 10% [5]. Другой метод – операция орхипексии (опущение яичка в мошонку) – часто не обеспечивает ожидаемого восстановления сперматогенеза, особенно при двусторонних формах крипторхизма, и проводится больше в профилактических целях.
В настоящее время появляются новые подходы к восстановлению сперматогенеза, пока находящиеся на стадии разработки на лабораторных животных. Один из таких подходов – искусственный гаметогенез – дифференцировка мужских половых клеток из эмбриональных стволовых клеток (ЭСК) или индуцированных плюрипотентных стволовых клеток in vitro. В ряде работ ЭСК в культуре под действием специфических индукторов удавалось дифференцировать в гаплоидные мужские половые клетки, которые затем использовали для искусственного оплодотворения [6, 7]. Однако существующие методы искусственного гаметогенеза характеризуются низкой эффективностью: только 0,01% всех клеток достигает гаплоидного состояния. К существенным недостаткам описанного подхода относятся нарушения дифференцировки половых клеток [8, 9], которые происходят из-за отсутствия in vitro естественного микроокружения.
Другой подход к восстановлению мужской фертильности предполагает использование сперматогониальных стволовых клеток (ССК). Разработаны методики выделения, культивирования ССК [10–12] и их трансплантации в семенники животных с нарушенным сперматогенезом [13, 14]. В случае повреждения только половых клеток трансплантации ССК способны восстановить сперматогенез [15]. Однако в случае с крипторхизмом нарушение в значительной степени затрагивает не ССК, а их микроокружение – клетки Сертоли (КС) [16–18]. Клетки Сертоли – соматические клетки семенника, поддерживающие развитие половых клеток; являются основой структуры семенных канальцев, источником многих факторов роста и дифференцировки для половых клеток, выполняют трофическую функцию и многие другие. Без этих клеток развитие половых клеток невозможно.
 В литературе отсутствуют данные о восстановлении сперматогенеза после крипторхизма у животных путем аллогенной клеточной трансплантации. Тем не менее на другой модели – локального облучения семенников крыс (так же как и крипторхизм, необратимо нарушающий функцию КС [19]) путем аллогенной трансплантации в интерстициальную ткань семенника недифференцированных КС [НКС]) 12–13-суточных крысятам удалось достичь частичного восстановления сперматогенеза в семенных канальцах реципиента [20].
В литературе отсутствуют данные о восстановлении сперматогенеза после крипторхизма у животных путем аллогенной клеточной трансплантации. Тем не менее на другой модели – локального облучения семенников крыс (так же как и крипторхизм, необратимо нарушающий функцию КС [19]) путем аллогенной трансплантации в интерстициальную ткань семенника недифференцированных КС [НКС]) 12–13-суточных крысятам удалось достичь частичного восстановления сперматогенеза в семенных канальцах реципиента [20].
Цель настоящей работы: исследовать влияние аллогенной трансплантации НКС на восстановление сперматогенеза после моделирования двустороннего абдоминального крипторхизма.
Материалы и методы. В работе были использованы 50 крысят линии Вистар: 30 животным в возрасте 15 дней (возраст выбирали, основываясь на результатах наших предыдущих исследований [3]) проводили операцию по фиксации семенников в брюшной полости (реципиенты), 20 крысят в возрасте 10 дней использовали как доноров НКС для трансплантации. Крыс содержали в стандартных условиях вивария с режимом день/ночь 12 ч/12 ч, воду и корм животные получали ad libitum.
Животные были разделены на 6 групп по 4–5 крыс в каждой.
Контрольная группа (К) – контроль состояния сперматогенной ткани после крипторхизма, крыс выводили из эксперимента на момент низведения семенников из брюшной полости в мошонку через 90 сут. после моделирования крипторхизма.
 Контрольная группа (КО-1) – животным после смоделированного 90-суточного двустороннего абдоминального крипторхизма проводили орхипексию и выводили из эксперимента через 1 мес. после операции.
Контрольная группа (КО-1) – животным после смоделированного 90-суточного двустороннего абдоминального крипторхизма проводили орхипексию и выводили из эксперимента через 1 мес. после операции.
Контрольные группы (КВ-1 и КВ-3) – животным после смоделированного 90-суточного двустороннего абдоминального крипторхизма проводили орхипексию и вводили в интерстициальную ткань семенника среду без клеток, крыс выводили из эксперимента через 1 и 3 мес. после операции соответственно.
Опытные группы (О-1 и О-3) – животным после смоделированного 90-суточного двустороннего абдоминального крипторхизма во время орхипексии вводили суспензию клеток, содержавшую НКС. Крыс выводили из эксперимента через 1 и 3 мес. после операции соответственно.
Моделирование двустороннего абдоминального крипторхизма. Ввиду отсутствия на сегодняшний день животных моделей врожденного крипторхизма в настоящей работе крипторхизм моделировали путем искусственного помещения семенника из мошонки внутрь тела с последующей фиксацией его там. Методика подробно описана нами ранее [3]. После наркотизации животного выполняли нижнесрединную лапаротомию. Семенник выводили в операционную рану, фиксировали его к париетальной брюшине передней брюшной стенки за край капсулы нитями Prolene 5/0 («Johnson & Johnson», США) с помощью атравматической иглы. После выполнения аналогичной фиксации семенника с другой стороны операционную рану передней брюшной стенки послойно зашивали наглухо.
Получение суспензии клеток для трансплантаций. Суспензию НКС получали из семенников 10-суточных крысят (линия Вистар). Животных декапитировали, выделяли семенники, помещали в раствор Хэнкса (без Ca2+ и Mg2+), снимали белочную оболочку и разрыхляли ткань семенника. Затем семенники переносили в 14-миллилитровые центрифужные пробирки со стерильным раствором Хэнкса и добавляли 20 мкл/мл (1:50) пенициллин/стрептомицина (Пан-Эко), инкубировали с антибиотиками 5 мин. За это время семенники опускались на дно. Надосадочную жидкость отбирали и заменяли на раствор коллагеназы IV 1 мг/1,5 мл с ДНКазой I 0,04%. Инкубировали в растворе 15 мин при 34°С. После инкубации с коллагеназой освобожденные от интерстициальной ткани семенные канальцы промывали 3 раза раствором Хэнкса. Затем добавляли к канальцам 5 мл раствора трипсина (0,25%)+1 мМ ЭДТА («Invitrogen», США), инкубировали 15 мин при 34°С. После инкубации для остановки действия трипсина в раствор добавляли 5% ФСК (фетальная сыворотка плодов коровы, HyClone), затем промывали канальцы 3 раза раствором Хэнкса, разбивали канальцы на отдельные клетки пипетированием. Суспензию клеток пропускали через фильтры размером пор ~200−300 мкм, а затем 40 мкм, промывая раствором Хэнкса. Клетки осаждали центрифугированием при 300 g 10 мин. Отбирали надосадочную жидкость, наливали 2,9 мл Хенкса, ресуспендировали осадок и добавляли гипотонический раствор (0,7 мл Хенкса и 6,4 мл деионизированной стерильной воды), центрифугировали при 300 g 5 мин. В результате гипотонической обработки суспензии клеток разрушались почти все половые клетки и эритроциты. Надосадочную жидкость убирали и ресуспендировали осадок в среде (ДМЕМ:F12 1:1), подсчитывали число клеток в камере Горяева. Затем для обогащения суспензии клеток для трансплантации НКС клетки высаживали на чашки Петри, покрытые желатиной в среде (α-MEM:F12, 5% FBS, 2% Пен./Стреп., L-глутамин [1:50], пируват натрия [1:100, раствор 1,1 мг/мл]) в концентрации 0,3∙106 клеток на 1 см2. Культивировали клетки в течение 1 сут. За это время к желатину прикреплялись все жизнеспособные НКС. Через 1 сут. готовили суспензию клеток в среде (DMEM, 10% ДНКаза I [2 мг/мл], 5% витального красителя трипанового синего [0,4%-ный раствор]).
 Трансплантация клеточных суспензий. Семенники выводили в операционную рану. Клеточную суспензию вводили с помощью поршневого микроинъектора через капилляр (диаметр кончика – 60 мкм). Перед введением капилляра иглой размером 20G в белочной оболочке семенника делали перфоративное отверстие. Клетки вводили в интерстициальную ткань семенника небольшими порциями, добиваясь ее равномерного распределения. Контроль введения осуществлен по окраске ткани семенника трипановым синим. В каждый семенник опытной группы крыс вводили по 150 мкл суспензии клеток, в которой содержалось 2∙106 клеток. Контрольным животным (группы КВ-1 и КВ-3) вводили среду того же состава и объема, но без НКС. Введение осуществляли под микроскопом при общем увеличении в 16 раз.
Трансплантация клеточных суспензий. Семенники выводили в операционную рану. Клеточную суспензию вводили с помощью поршневого микроинъектора через капилляр (диаметр кончика – 60 мкм). Перед введением капилляра иглой размером 20G в белочной оболочке семенника делали перфоративное отверстие. Клетки вводили в интерстициальную ткань семенника небольшими порциями, добиваясь ее равномерного распределения. Контроль введения осуществлен по окраске ткани семенника трипановым синим. В каждый семенник опытной группы крыс вводили по 150 мкл суспензии клеток, в которой содержалось 2∙106 клеток. Контрольным животным (группы КВ-1 и КВ-3) вводили среду того же состава и объема, но без НКС. Введение осуществляли под микроскопом при общем увеличении в 16 раз.
После завершения трансплантации яичко низводили в мошонку с соблюдением мер предосторожности, выполняли аналогичную трансплантацию с другой стороны, послеоперационную рану ушивали наглухо.
Качественный и количественный гистологический анализ состояния сперматогенной ткани. Животных выводили из эксперимента путем передозировки диэтилового эфира в эксикаторе, извлекали семенники и взвешивали, фиксировали в 4%-ном параформальдегиде (pH 7,4), проводили через восходящий градиент спиртов и ксилол и заключали в парафин. Готовили срезы толщиной 7 мкм и окрашивали их гематоксилином и эозином. Для качественной оценки состояния сперматогенной ткани срезы просматривали и фотографировали на микроскопе Leica DM5000B (США). Для количественной оценки на трех срезах семенника (расстояние между срезами ~200 мкм) подсчитывали общее количество канальцев, количество канальцев, содержащих все типы дифференцирующихся половых клеток (канальцы с нормальной структурой сперматогенного эпителия), количество канальцев без сперматид, количество канальцев без сперматид и сперматоцитов и количество канальцев без половых клеток (результаты подсчетов выражали в процентах).
Статистический анализ результатов. Количест-венные данные анализировали в статистическом пакете STATISTICA 8.0 («StatSoft», США). Сравнение средних значений контрольных и экспериментальных выборок проводили с использованием непараметрического критерия Mann–Whitney t при стандартном уровне значимости p≤0,05.
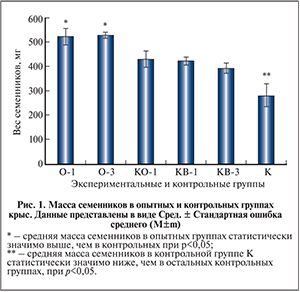
Результаты и обсуждение. Результаты измерения массы семенников. Средняя масса семенника у животных через 1 и 3 мес. после их низведения и трансплантации клеток составила соответственно 522 и 528 мг, что достоверно выше, чем у животных контрольных групп (рис. 1). У крыс контрольной группы К после 90-суточной экспозиции семенников в брюшной полости средняя масса семенника был значительно и достоверно меньше, чем у крыс других контрольных групп, и составляла 280 мг.
В контрольной группе КО-1 через 1 мес. после низведения семенников в мошонку его масса увеличилась и составила 428 мг. Такая же картина наблюдалась и в контрольной группе КВ-1 (через 1 мес. после низведения семенников и введения среды), в которой данный показатель составил 421 мг, через 3 мес. (группа КВ-3) он незначительно снижался в среднем до 392 мг.
Качественная гистологическая оценка состояния сперматогенной ткани. Для оценки эффекта аллогенной трансплантации НКС было выполнено гистологическое исследование сперматогенной ткани во всех группах животных.
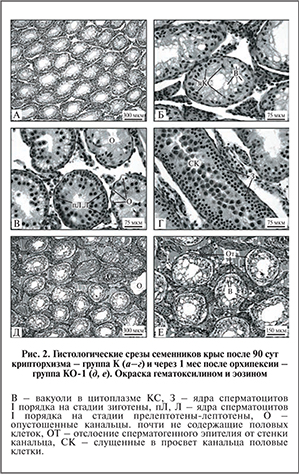
В контрольной группе К во всех семенных канальцах отсутствовали удлиняющиеся и округлые сперматиды (рис. 2, а), а в части канальцев также мейотические клетки (рис. 2, б, в), что свидетельствует о глубоком нарушении развития мужских половых клеток. Цитоплазма КС, в норме заметная только в области ядра, сильно разрасталась и была заполнена вакуолями. Ядра КС часто смещались к просвету канальца, что редко можно заметить в норме только на стадии спермиации (рис. 2, б). Во многих канальцах наблюдалась остановка (блок) сперматогенеза на стадии прелептотены-лептотены или зиготоны (рис. 2, в, г соответственно). Об этом свидетельствовало накопление ядер сперматоцитов I порядка на соответствующих стадиях дифференцировки, расположенных в 2−3 ряда, чего никогда не бывает в норме. Гибнущие половые клетки нередко слущивались в просвет канальца (см. рис. 2, г).
В семенниках контрольной группы КО-1 через 1 мес. после низведения семенников из брюшной полости в мошонку восстановления развития мужских половых клеток не происходило, напротив, нарушения структуры сперматогенной ткани становились более значительными. Во всех без исключения семенных канальцах полностью нарушался сперматогенез (рис. 2, д); из половых клеток в канальцах в большинстве случаев оставались лишь сперматогонии (рис. 2, е). В цитоплазме КС увеличивалось число вакуолей (рис. 3, в). Ядра КС и сперматогониальных клеток во многих канальцах покидали базальную мембрану. В некоторых канальцах полностью отсутствовал просвет (см. рис. 2, д). Происходящие изменения в сперматогенной ткани после опущения семенников назад в мошонку свидетельствуют о необратимости процессов нарушения сперматогенеза у крыс с искусственным крипторхизмом.
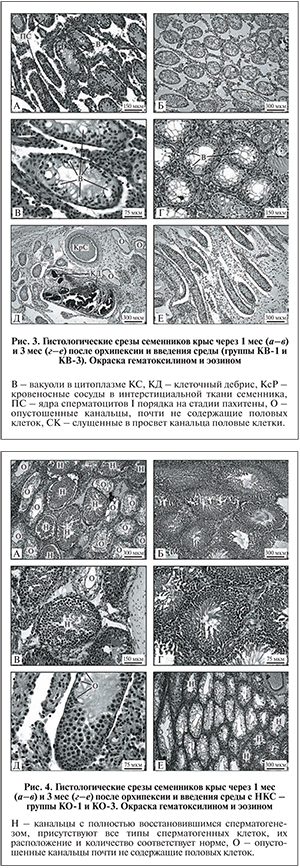
В семенниках контрольной группы КВ-1 через 1 мес. после орхипексии и введения среды без клеток картина сперматогенеза немного отличалась от таковой в группе КО-1, но в целом была схожей. Нарушение развития мужских половых клеток имело место во всех семенных канальцах (рис. 3, а).
В цитоплазме КС в некоторых канальцах присутствовали вакуоли (рис. 3, б). Число вакуолей в КС и число канальцев, содержащих такие клетки, было меньше, чем в контрольной группе КО-1. Во многих канальцах в герминативном эпителии можно было заметить ядра лишь сперматогониальных клеток и КС; ядра часто смещались в сторону просвета (см. рис. 3, б). Важным отличием от группы КО-1 было появление заметного числа канальцев с мейотическими клетками (см. рис. 3, а). В единичных семенниках происходило замещение интерстициальной ткани соединительной, увеличивались число и размер кровеносных сосудов, канальцы расходились друг от друга. В некоторых канальцах (1−2 на поперечный срез семенника) происходила гибель всех клеток, и канальцы содержали лишь клеточный дебрис. Встречались также остовы канальцев, не содержащих ни половых, ни соматических клеток (рис. 3, в).
В семенниках контрольной группы КВ-3 через 3 мес. после орхипексии и введения среды без клеток гистологическая картина изменений сперматогенеза была хуже, чем через 1 мес. после введения среды. Сперматогенез был нарушен во всех семенных канальцах (рис. 3, г). В сперматогенном эпителии присутствовали только КС и немногочисленные сперматогонии. Цитоплазма КС сильно вакуолизирована. В некоторых канальцах ядра половых и соматических клеток были беспорядочно разбросаны по всей толще сперматогенного эпителия, а не находились у базальной мембраны (рис. 3, д). Канальцы со сперматоцитами встречались редко. Интерстициальная ткань частично замещалась соединительной, канальцы расходились, увеличивалось число кровеносных сосудов (рис. 3, е).
В опытной группе крыс О-1 через 1 мес. после низведения семенников из брюшной полости и трансплантации НКС наблюдалось полное восстановление сперматогенеза в части семенных канальцев (рис. 4, а, б). В канальцах с восстановившимся сперматогенезом можно было наблюдать все типы дифференцирующихся половых клеток: от сперматогониальных клеток до удлиняющихся сперматид (на рис. 4, б представлен поперечный срез канальца на стадии спермиации). Половые клетки разных генераций в таких канальцах располагались концентрическими слоями, их число и положение в слоях соответствовало норме. Наряду с канальцами с полностью восстановленной структурой сперматогенного эпителия мы наблюдали также канальцы с частичным восстановлением эпителия (рис. 4, в), в канальце отсутствовали постмейотические половые клетки, число сперматоцитов было выше нормы, что может свидетельствовать о блоке сперматогенеза на этой стадии развития клеток. Встречались также канальцы без половых клеток и канальцы только со сперматогониальными клеткам, но их было немного.
В опытной группе О-3 через 3 мес. после проведения трансплантации нами также были обнаружены канальцы с полностью восстановившимся сперматогенезом (рис. 4, г, д). В отличие от опытной группы О-1 в этой группе в единичных семенниках мы наблюдали восстановление сперматогенеза в большинстве семенных канальцев. В то же время необходимо отметить наличие обширных зон опустошенных канальцев в некоторых семенниках (рис. 4, е), чего мы не наблюдали в группе О-1. Так же как и в опытной группе О-1, в канальцах с восстановившимся сперматогенезом определялись все типы дифференцирующихся половых клеток – от сперматогониальных клеток до удлиняющихся сперматид (см. рис. 4, д). Половые клетки разных генераций в таких канальцах располагались слоями, их число и положение соответствовали норме.
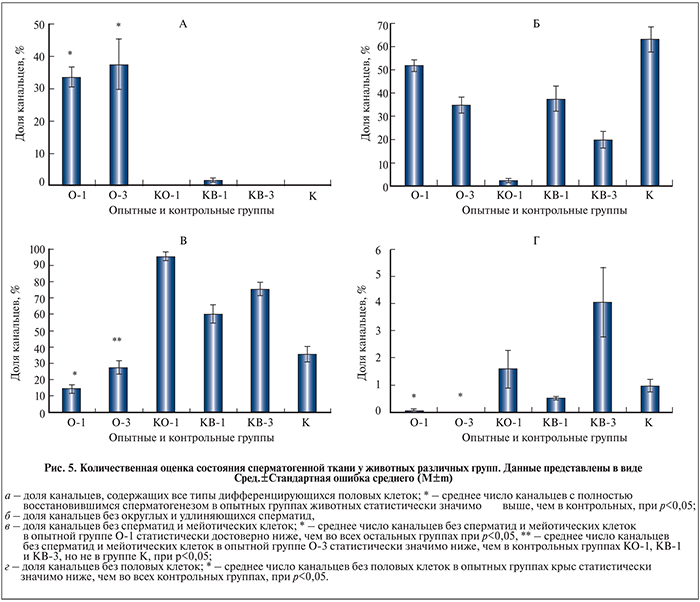
Количественный гистологический анализ состояния сперматогенной ткани. Для более полной оценки восстановления сперматогенной ткани после трансплантации НКС мы определили долю канальцев с разной степенью нарушения сперматогенного эпителия у животных из опытных и контрольных групп. Доля канальцев с нормальной структурой сперматогенного эпителия, содержащих все типы развивающихся половых клеток, у животных опытных групп О-1 и О-3 в среднем составила соответственно 33,7 и 37,5% (рис. 5, а). У крыс из контрольных групп К, КО-1 и КВ-3 нормальные сперматогенные канальцы в семенниках практически отсутствовали (0, 0,1 и 0,3% соответственно) и только в контрольной группе КВ-1 их доля составляла 2% от всех канальцев. Доля канальцев без сперматид у животных группы О-1 составила 51,9%, группы О-3 – 34,9% (рис. 5, б). У животных контрольных групп наименьшую долю канальцев без сперматид регистрировали через 1 мес. после опущения семенников в мошонку (2,6%, группа КО-1), а наибольшую – у животных через 3 мес. крипторхизма (63,4%, группа К), у животных через 1 и 3 мес. после опущения семенников и введения среды доля таких канальцев составляла 37,5 и 20% соответственно. Доля канальцев без сперматид и сперматоцитов у животных из опытных групп О-1 и О-3 составила соответственно 14,4 и 27,6 % (рис. 5, в). У животных из контрольных групп наименьшая доля таких канальцев была в группе К (35,6 %), а наибольшая – в группа КО-1 (95,7 %), у животных групп КВ-1 и КВ-3 доля канальцев без мейотических и постмейотических половых клеток составила 60,4 и 75,6% соответственно. Реже всего во всех группах животных в семенниках встречались канальцы без половых клеток, у которых на базальной мембране присутствовали только КС. У животных из опытных групп О-1 и О-2 такие канальцы были обнаружены в единичных семенниках (0,1%) только в первой группе (рис. 5, г). Такое же количество опустошенных канальцев было и в контрольной группе КВ-1, а через 3 мес. после опущения семенников в мошонку и введения среды, напротив, достигало максимального значения в 4%. У животных групп К и КО-1 доля таких канальцев составила 1 и 1,6% соответственно.
Как видно из результатов измерения массы семенников, качественной и количественной гистологической оценки сперматогенеза, трансплантация НКС в интерстициальную ткань семенников после 3-месячного моделирования крипторхизма способствует восстановлению развития мужских половых клеток в семенных канальцах реципиента. Восстановление сперматогенеза нельзя назвать полным, о чем в первую очередь говорят показатели массы семенников. Так, хотя у животных через 3 мес. после трансплантации масса семенника по сравнению с контрольной группой (К) увеличивалась почти в два раза, достигнув примерно 500 мг, она была значительно ниже нормальной (2–3 г для крыс в возрасте 6–7 мес.). Мы предполагаем, что масса семенника не достигала нормальных значений из-за недостаточного числа трансплантированных клеток, а также их неравномерного распределения по интерстициальной ткани семенника. Так, по данным [19], у крыс, подвергнутых локальному облучению семенников (γ-облучение, доза 6 Гр) с последующей трансплантацией НКС в интерстициальную ткань, сперматогенез в семенных канальцах реципиента восстанавливался только в тех участках канальца, где в интерстициальной ткани располагались клетки донора.
У животных контрольных групп КО-1, КВ-1 и КВ-3 также констатировали увеличение массы семенника, но не столь значительное, как после трансплантации клеток. Несмотря на это, наше гистологическое исследование не обнаружило восстановительного процесса в сперматогененной системе этих животных. Напротив, по данным количественного анализа, доля канальцев без сперматид снижалась по сравнению с контрольной группой К, тогда как доля канальцев без сперматид и мейотических клеток, а также канальцев без половых клеток увеличивалась. Эти данные свидетельствуют о продолжающейся деградации сперматогенеза у крыс даже после прекращения крипторхизма путем опущения семенников в мошонку. Увеличение же массы семенника, вероятно, связано с утолщением его белочной оболочки, а также разрастанием соединительной ткани в интерстиции. Восстановительный процесс в семенниках после трансплантации клеток хорошо иллюстрируется результатами количественной гистологической оценки сперматогенеза. Так, доля канальцев, содержащих все типы дифференцирующихся половых клеток, в обеих экспериментальных группах превышала 30%, тогда как у большинства контрольных животных такие канальцы отсутствовали. Также обращает на себя внимание значительное (в большинстве случаев статистически достоверное) снижение доли канальцев без сперматид и сперматоцитов, а также канальцев без половых клеток по сравнению с контрольными группами животных.
Обнаруженный нами восстановительный процесс после трансплантации НКС значительно превосходит результаты, полученные у крыс после облучения: по данным Z. Zhang и соавт. (2009) через 13 нед. после аналогичной трансплантации НКС в семенных канальцах реципиента сперматогенез восстанавливался только до стадии мейоза (7% канальцев), канальцы же со сперматидами отсутствовали [20]. Вероятно, это связано с тем, что облучение семенника наносило сперматогенной системе в целом и КС в частности больший, чем при крипторхизме, урон. Это позволяет предположить, что можно добиться и более значительных результатов в восстановлении сперматогенеза после крипторхизма (таких как восстановление фертильности) путем оптимизации условий трансплантации и подбора сроков крипторхизма.
Выводы
- На модели двустороннего абдоминального крипторхизма показано, что нахождение семенников в брюшной полости в течение 90 сут. ведет к необратимым дегенеративным процессам в семенниках крыс.
- Орхипексия, так же как и введение среды без клеток, не приводит к восстановлению сперматогенеза, наоборот, процессы деградации сперматогенной ткани нарастают.
- Трансплантация НКС способствует полному восстановлению сперматогенеза более чем в 30% семенных канальцев реципиента уже через 1 мес. поле операции.
Работы выполнена при поддержке гранта Программы фундаментальных исследований Президиума РАН «Фундаментальные исследования для разработки биомедицинских технологий» (2015 г.).



