Введение. Эректильная дисфункция (ЭД) – распространенное нарушение половой функции мужчины. Известно, что около 30% мужчин в возрасте от 18 до 59 лет имеют нарушения эректильной функции разной выраженности [1]. Установлена взаимосвязь ЭД и сахарного диабета (СД): среди пациентов с СД 2 типа эректильными нарушениями страдают более 40% пациентов, а риск возникновения ЭД при СД в 3 раза превышает таковой в основной популяции [2, 3]. Так, например, при оценке 1460 пациентов с СД 2 типа ЭД обнаружена у 34% больных, периодические расстройства сексуальной функции выявлены в 24% случаев и только 42% пациентов не имели никаких проблем в сексуальной жизни [4]. Существенную роль в развитии ЭД при СД играют заболевания сердечно-сосудистой системы. Показано, что при наличии ЭД риск развития коронарной болезни у пациентов средней возрастной группы достоверно выше [5]. Кроме того, существуют исследования, где авторами убедительно доказана корреляционная зависимость между нарушениями эрекции, с одной стороны, и количеством пораженных коронарных артерий и степенью их повреждения, с другой [6].
В последнее время активно изучается проблема ЭД на фоне возрастного гипогонадизма. Получены убедительные данные о влиянии дефицита общего тестостерона (Тобщ) сыворотки крови на развитие и тяжесть эректильных нарушений, в том числе и при СД [7, 8]. Однако, несмотря на то что патогенез ЭД при СД изучен довольно хорошо, остается много нерешенных вопросов, касающихся взаимовлияния сосудистой и эндокринной систем, возрастных нарушений, ЭД и взаимосвязи их с вариабельностью уровней сывороточного Тобщ, а также особенностей поражения мужских половых органов.
Основной целью исследования явилась оценка нарушений эректильной функции у мужчин, страдающих СД и имеющих возрастной гипогонадизм. Вторичными целями исследования были изучение влияния компенсации СД на уровень сывороточного тестостерона, определение возможной взаимосвязи тяжести нарушений эректильной функции с уровнями Тобщ сыворотки крови, а также выраженностью эндотелиальной дисфункции и вовлеченностью в этот процесс тестикул.
Материалы и методы. Для достижения поставленных целей нами проведено проспективное рандомизированное простое сравнительное исследование с участием 131 пациента мужского пола с СД 2 типа.
Протокол исследования одобрен Локальным независимым этическим комитетом (ЛНЭК) при Ростовском государственном медицинском университете. Всеми пациентами была подписана форма информированного согласия, одобренная ЛНЭК.
Было сформировано 4 группы. В 1-ю (n=15) и 2-ю (n=30) группы включены больные с вторичным дефицитом Тобщ, в 3-ю (n=23) и 4-ю (n=63) – пациенты с уровнем Тобщ более 12 нмоль/л. Разделение больных по уровню тестостеронемии произведено в соответствии с общепринятыми параметрами нормы Тобщ [9], а уровень Тобщ в 1-й, 2, 3 и 4-й группах составил <8; 8–11,99; 12–14,99 и >15 нмоль/л соответственно.
Клинические проявления эректильной функции оценивали по результатам заполнения пациентами валидного международного опросника IIEF-5 (международный индекс эректильной функции).
Артериальное кровоснабжение тестикул изучали посредством ультразвукового дуплексного картирования кровотока капсулярных артерий яичка, где регистрировали пиковую систолическую скорость кровотока (Vmax) и соответствующий ей индекс резистентности сосудистой стенки (Ri). За нормативные параметры принимали значения в интервале 5–23,4 см/с и 0,46–0,78 для Vmax и Ri соответственно [10]. Основанием использования методики послужили результаты ряда исследований, в которых было дано обоснование изучению именно этих сосудов для оценки именно артериального кровообращения яичек [10–15]. Перед дуплексным сканированием УЗИ проведено в серошкальном режиме с определением анатомических размеров тестикул [16, 17].
В качестве биохимических маркеров эндотелиальной дисфункции использованы оксид азота (NO), синтаза оксида азота 3-го типа (NOS-3), эндотелин и резистин. Для их исследования применены лабораторные наборы ИФА «eBioscience» (Австрия).
Определение содержания NO в сыворотке крови осуществлено расчетным методом путем вычисления уровня конечных метаболитов (нитритов NO2/нитратов NO3) как продуктов метаболизма NO в соответствии с рекомендациями производителя («Bayer»). За нормативные параметры принимали уровень NO от 37,2 до 87,2 мкМ, уровень эндотелина от 0,2 до 0,7 фмоль/мл, уровень резистина от 4,9 до 6,6 нг/мл [18–20]. Маркером компенсации СД служили уровень гликированного гемоглобина крови (HbA1c, норма <7%) и показатели инсулинорезистентности – индекс Caro (IС, норма ≥0,33 усл. ед.) и индекс HOMA (IH, норма <2,7 усл. ед.) [21, 22]. Для исследования биохимических показателей использован анализатор Bayer ADVIA 1650 («Siemens», Германия). Содержание Тобщ оценивали иммуноферментным методом с использованием тест-систем Elisa («DRG Diagnostics», Германия). Забор крови проведен с 8.00 до 9.00 натощак после 12-часового голодания. Биохимические исследования выполнены из свежей сыворотки крови. Для проведения ИФ-исследований кровь центрифугировали, сыворотку замораживали при -20 °С.
Статистический анализ результатов исследований проведен непараметрическими методами с использованием пакета прикладных программ STATISTICA (StatSoft 8.1). Распределение показателей представлено в виде медианы (Ме), нижнего (LQ) и верхнего (UQ) квартилей. Статистическую значимость различий между двумя независимыми группами оценивали с помощью U-теста Mann–Whitney, между множеством независимых групп — ANOVA-теста Kruskal-Wallis. Корреляционные связи признаков оценивали методом ранговой корреляции Spearman. О силе корреляции судили по значению коэффициента корреляции r: 0,20< |r| <0,29 – слабая корреляция; 0,30< |r| <0,49 — умеренная корреляция; 0,50< |r| <0,69 – средняя корреляция; |r| ≥0,70 – сильная корреляция.
Критический уровень значимости при проверке статистических гипотез принят равным 0,05 [23].
Результаты. Пациенты всех групп были подобраны по возрасту (р>0,18), росту (р>0,99), уровню глюкозы (р>0,89) и длительности течения СД (р>0,35). При этом между группами отмечены достоверные отличия по массе тела (р<0, 01) и индексу массы тела (р<0,01) пациентов, значения которых слабо коррелировали с уровнем Тобщ в 3-й и 4-й группах [0,126< |r| < 0,132, p >0,05], но умеренно достоверно коррелировали в 1-й и 2-й группах [0,356< |r| <0,427, p<0,05].
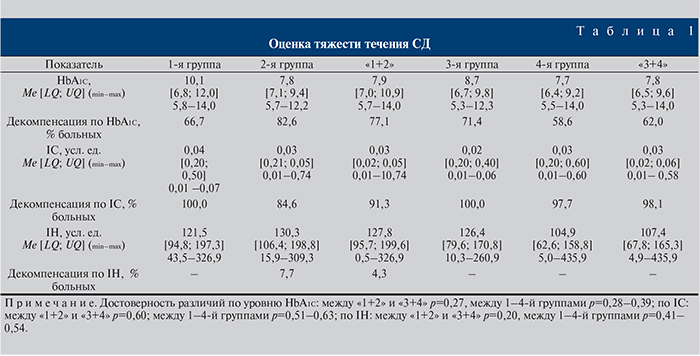
Несмотря на то что длительность течения СД и уровень глюкозы были сопоставимыми, степень компенсации заболевания имела корреляционную связь с уровнем сывороточного тестостерона. Так, параметры HbA1c были сравнимыми и достоверно не различались у пациентов с нормо- и гипотестостеронемией, но недостоверно отличались по значениям в группах. При этом абсолютное количество пациентов с повышенным содержанием HbA1c увеличивалось при снижении уровня Тобщ. Эти данные имели более значимое подтверждение при совокупной оценке по HbA1c, IC и IH.

Определена достоверная статистически значимая компенсация СД при изменении Тобщ: в 1-й группе по HbA1c |r|=0,246, p>0,05; по IC |r|=0,539, p<0,05; по IH |r|=0,491, p<0,05; во 2-й группе по HbA1c |r|=0,339, p>0,05; по IC |r|=0,597, p<0,05; по IH |r|=0,571, p<0,05; в 3-й группе по HbA1c |r|=0,068, p>0,05; по IC |r|=0,382, p<0,05; по IH |r|=0,373, p<0,05; в 4-й группе по HbA1c |r|=0,034, p>0,05; по IC |r|=0,306, p<0,05; по IH |r|=0,278, p<0,05 (табл. 1).
Установленные нами достоверные различия в группах по массе, индексу массы тела, а также данные по HbA1c, IC, IH и выявленные между ними коррелятивные связи свидетельствуют о том, что компенсация СД может определяться изменяющимся уровнем сывороточного Тобщ и оказываться наиболее слабой при его дефиците.
Ранее было установлено, что ЭД не только сопровождает течение СД, но может являться его предиктором в случае выраженного поражения элементов нервной и сосудистой систем [5, 7, 22]. Однако нами показано, что пациенты с нормо- и гипотестостеронемией подвержены ЭД в равной степени – 80 и 75,6% случаев соответственно. Вместе с тем наибольшее количество пациентов с ЭД (80,3%) имели сывороточный Тобщ ниже 15 нмоль/л. При сравнимом числе пациентов, указавших на наличие ЭД, именно при снижении Тобщ менее 8 нмоль/л отмечена большая частота симптомов ЭД и тяжесть течения эректильных нарушений.
В отсутствие статистически значимых различий частоты ЭД у мужчин с гипо- и нормотестостеронемией выявляется наличие у них равной по тяжести ЭД, но появление достоверности при групповом сравнении больных по баллу ЭД свидетельствует о возникновении зависимости степени ЭД от изменения Тобщ (табл. 2).Эти данные подтверждаются выявленными коррелятивными связями: достоверными сильными и умеренными в 1-й и 2-й группах– |r|=0,567, p<0,05 и |r|=0,336, p<0,05 соответственно, а также достоверной слабой и недостоверной слабой в 3-й и 4-й группах – |r|=0,261, p<0,05 и |r|=0,148, p>0,05 соответственно.
На современном этапе изучения СД известно, что его течение ассоциировано с нарушениями функции эндотелия сосудов, а некоторые патогенетические механизмы развития СД непосредственно определяются дисфункцией эндотелия. Нами выявлены патологические отклонения уровней NO и NOS-3 у большинства пациентов всех подгрупп. При этом более выраженные девиации эндотелина и резистина прослеживались у пациентов с показателями Тобщ менее 12 нмоль/л (табл. 3).
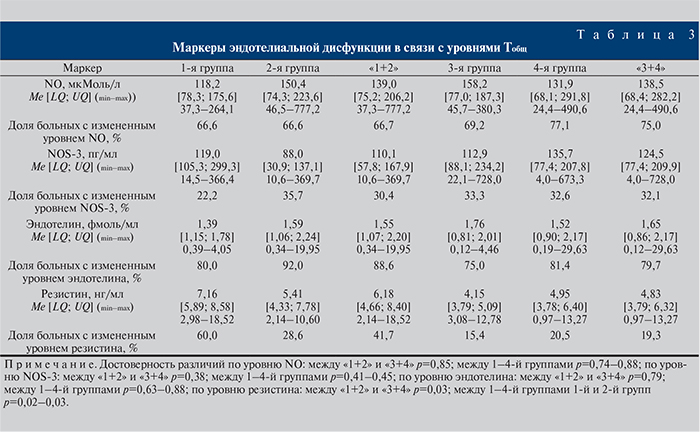
Установлено наличие сильной и умеренно достоверной корреляции между маркерами эндотелиальной дисфункции и уровнем Тобщ в 1-й и 2-й группах, что свидетельствует о развитии генерализованного поражения сосудов в условиях дефицита тестостерона при СД.
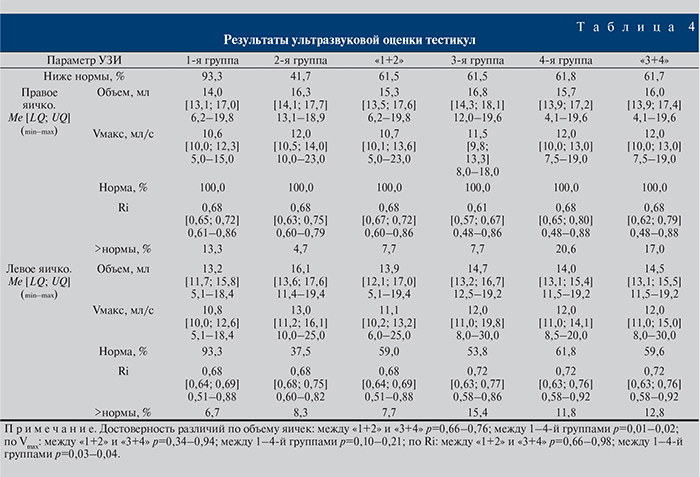
С учетом клинических и биохимических особенностей течения СД на фоне вариабельности сывороточного Тобщ и сопутствующей этим процессам ЭД нами впервые проведена оценка размеров и кровообращения тестикул. Сравнительный анализ объемов и артериального кровотока правого и левого яичек у всех пациентов установил достоверную асимметричность двух органов и показателей их артериального кровотока (p=0,001–0,0001), что обусловило необходимость проведения раздельного анализа параметров правых и левых гонад.
Определено, что в 81,4% случаев течение СД сопровождается снижением объема гонад по сравнению с параметрами нормы. Более частому снижению объема тестикул подвержены больные с дефицитом Тобщ (84,6%), хотя и при нормотестостеронемии эти изменения встречаются часто, в 78,7% случаев. Чаще всего уменьшение объема яичек определялось в 1-й и 4-й группах — в 93,3 и 85,3% случаев соответственно. Во 2-й и 3-й группах количество таких пациентов составило 79,2 и 61,5% соответственно. При этом двустороннее уменьшение объема яичек имело место у 93,3% пациентов 1-й группы. В 3-й и 4-й группах эти нарушения определялись в 61,5% случаев, во 2-й – только в 41,7%.
Последующий анализ проведен по результатам, полученным при обследовании пациентов с уменьшенными размерами гонад. Оказалось, что, несмотря на имеющиеся различия в уровнях Тобщ и достоверное снижение объема гонад, параметры артериального кровотока в группах достоверно не различались. Не выявлено значимой зависимости между значениями Vmax и Ri в условиях изменения уровня Тобщ (табл. 4). В то же время установлены достоверные умеренные коррелятивные зависимости между объемом гонад и скоростью кровотока в них у пациентов всех групп [0,301< |r<0,553, p<0,05]. При снижении уровня Тобщ эти связи становились сильными, хотя достоверность при этом терялась [0,693<|r|<0,821, p>0,05]. Эти данные подтверждают роль ЭД при СД и дефиците Тобщ в развитии поражений яичек. Кроме того, определено, что при развитии гипотестостеронемии при уменьшении гонад имеет место усиление достоверной корреляционной зависимости между этими признаками и ЭД: от |r|=0,394, p<0,05 до|r|=0,860, p<0,05. Умеренные коррелятивные зависимости определены во всех группах при поиске связей между скоростью кровотока и маркерами ЭД: от |r|=0,121, p<0,05 до |r|=0,399, p<0,05.
Обсуждение. Сахарный диабет определен ВОЗ как эпидемия неинфекционного заболевания. По данным ВОЗ, в настоящее время в мире насчитывается около 180 млн больных СД [24]. К важной особенности СД 2 типа относится возникновение заболевания преимущественно в среднем и пожилом возрасте, а поскольку у мужчин по мере старения изменяется функциональная активность всей эндокринной системы, зачастую развитие СД происходит одновременно со снижением уровня эндогенного тестостерона [25–27]. В настоящее время уже установлено, что гипотестостеронемия в условиях СД оказывает разноплановое отрицательное влияние на организм пациента, в том числе в виде повышения инсулинорезистентности, прогрессирования тяжести артериальной гипертензии, нарушений обмена липидов крови [22, 28, 29].
Полученные нами в исследовании результаты позволяют высказать следующие соображения.
На степень компенсации СД 2 типа оказывает влияние уровень сывороточного Тобщ. Частота ЭД возрастает по мере снижения Тобщ. При снижении уровня Тобщ появляются и усиливаются взаимозависимости между интенсивностью ЭД и степенью компенсации СД, что позволяет считать ЭД при вторичном дефиците тестостерона предиктором прогрессирования СД. Эректильная дисфункция в условиях СД 2 типа одинаково часто определяется у пациентов с гипо- и нормопродукцией тестостерона. При этом интенсивность эректильных нарушений достоверно определяется уровнями Тобщ, демонстрируя максимальную выраженность при содержании Тобщ менее 8 нмоль/л. Наиболее часто признаки генерализованной ЭД выявляются при уровне Тобщ менее 15 нмоль/л, но достоверно усиливаются при содержании Тобщ менее 8 нмоль/мл.
У большинства пациентов с СД 2 типа существенно снижен объем тестикул. Наибольшее число таких пациентов имеет уровень Тобщ менее 8 нмоль/л. Существует прямая коррелятивная связь между уровнем Тобщ, показателями пиковой систолической скорости артериального кровотока в капсулярных артериях яичек и объемом тестикул. Кроме того, установлена связь между объемом яичек, снижением скорости кровотока в них и наличием признаков ЭД.
Заключение. Современные рекомендации EAU и ISSAM предлагают считать нижней границей нормы тестостерона 12 нмоль/л. Однако полученные в нашем исследовании результаты могут служить основанием возможного повышения верхней границы гипотестостеронемии с 12 до 15 нмоль/л. Считаем важным подчеркнуть очевидность существования пока еще недостаточно изученной проблемы дефицита тестостерона, протекающего в условиях нарушенного обмена глюкозы.
Работа выполнена при поддержке Российского научного фонда в рамках гранта № 14-25-00052.



