Введение. Кишечная пластика мочеточников – редко выполняемое и до конца не разработанное оперативное вмешательство. За многие десятилетия в литературе были представлены только отдельные публикации, посвященные использованию кишечных сегментов для частичного или полного замещения одного или обоих мочеточников [1–6]. И лишь единичные урологические центры в мире располагают опытом нескольких десятков таких операций [7–9]. В России к ним относится наша клиника [10–12]. Отсутствие фундаментальных работ на данную тему с подробным описанием технических аспектов кишечной пластики мочеточников считается одной из основных причин ее недостаточно широкого распространения.
 В связи с этим основные этапы интестинальной пластики мочеточников: выбор, взятие, транспозиция, расположение и возможная реконфигурация кишечного участка, особенности правосторонней и двусторонней илеоуретеропластики, создание мочеточниково-кишечного и кишечно-пузырного анастомозов — остаются предметом дискуссий. В настоящей работе и последующих публикациях на основании собственного опыта мы хотим более подробно остановиться на технических особенностях различных вариантов замещения мочеточника кишечными участками, практически не освещенных в отечественной и зарубежной литературе.
В связи с этим основные этапы интестинальной пластики мочеточников: выбор, взятие, транспозиция, расположение и возможная реконфигурация кишечного участка, особенности правосторонней и двусторонней илеоуретеропластики, создание мочеточниково-кишечного и кишечно-пузырного анастомозов — остаются предметом дискуссий. В настоящей работе и последующих публикациях на основании собственного опыта мы хотим более подробно остановиться на технических особенностях различных вариантов замещения мочеточника кишечными участками, практически не освещенных в отечественной и зарубежной литературе.
Материалы и методы. С 1998 по 2015 г. в урологическом отделении городской многопрофильной больницы № 2 – основной клинической базе кафедры урологии СЗГМУ им. И. И. Мечникова – кишечная и аппендикулярная пластика мочеточников произведена 151 больному (средний возраст – 52±9,8 года). Мужчин было 67 (44,3%), женщин – 84 (55,7%). Всем больным проведено комплексное обследование, включившее ультразвуковые, рентгенологические, радиоизотопные и эндоскопические методы диагностики. В отношении 103 (68,2%) пациентов кишечные сегменты использовались для замещения различных отделов мочеточников (подвздошная – для 78, толстая – для 4, червеобразный отросток – для 21), а в отношении 48 (31,8%) человек уретеропластика сочеталась с ортотопической илеоцистопластикой.
Наиболее часто протяженные стриктуры и облитерации мочеточников развивались после лучевой терапии (35,1%), в результате послеоперационных осложнений при открытых и эндоскопических вмешательствах на верхних мочевых путях (24,5%) и после их ятрогеных повреждений при гинекологических и хирургических оперативных вмешательствах (21,8%). Значительно реже причинами непроходимости мочеточников становились мегауретер, обструкция их после ортотопической цистопластики и в результате болезни Ормонда.
Изолированная пластика мочеточников участком подвздошной кишки произведена 78 больным, из них 57 (73,1%) односторонняя и 21 (26,9%) двусторонняя. В том числе одной больной одновременно были выполнены уретероилеоцистоанастомоз слева и уретероаппендикоцистоанастомоз справа. Еще в 2 случаях уретероилеоцистоанастомоз проведен при удвоенных мочеточниках по Wallace. В общей сложности изолированным участком подвздошной кишки был замещен 101 мочеточник. В 56 (55,4%) случаях оперирован левый мочеточник, в 45 (44,6%) – правый. Среди оперированных больных 6 (3,9%) имели единственную или единственную функционирующую почку.
Чаще всего выполняли одностороннюю уретероилеопластику изолированным сегментом подвздошной кишки (50,0%), двустороннюю U-образную пластику мочеточников (18,0%), реже – более сложные кишечные реконструкции, такие как пиелоилеоцистоанастомоз (тотальная уретеропластика – 9,0%), двустороннее 7- или Г-образное замещение мочеточников (6,4%), уретеропластику реконфигурированными кишечными сегментами (5,1%) и операции из лапароскопического доступа (8,9%).
 Илеотрансплантат всегда располагали в более свойственном для него положении – внутрибрюшинно. Современные возможности предоперационной подготовки пациентов, совершенствование хирургической техники, появление новых шовных материалов и подходов к антибактериальной терапии существенно снизили риск осложнений, которых стоит опасаться, оставляя трансплантат и формируя мочеточниково-кишечные и кишечно-пузырные анастомозы в брюшной полости.
Илеотрансплантат всегда располагали в более свойственном для него положении – внутрибрюшинно. Современные возможности предоперационной подготовки пациентов, совершенствование хирургической техники, появление новых шовных материалов и подходов к антибактериальной терапии существенно снизили риск осложнений, которых стоит опасаться, оставляя трансплантат и формируя мочеточниково-кишечные и кишечно-пузырные анастомозы в брюшной полости.
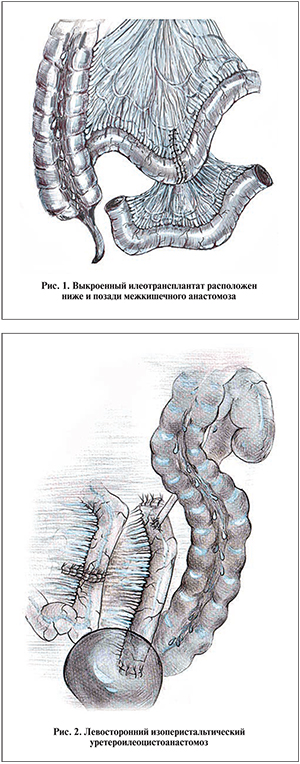
Более важным остается вопрос: как расположить кишечный трансплантат – по ходу его сокращений или наоборот? Безусловно следует стремиться к изоперистальтическому положению кишечного участка. В этом смысле наиболее простой и технически разработанной является кишечная пластика левого мочеточника. Во всех наблюдениях она была выполнена нами с изоперистальтическим расположением илеотрансплантата. С этой целью взятый кишечный сегмент помещаем ниже и позади межкишечного анастомоза (рис. 1). Затем поворачиваем его влево против часовой стрелки в вертикальное положение, изоперистальтически укладываем медиально от нисходящей ободочной кишки и латерально от петель тонкого кишечника и межкишечного анастомоза в направлении центрального конца мочеточника. Межкишечный анастомоз подтягивается и располагается медиально от илеотрансплантата.
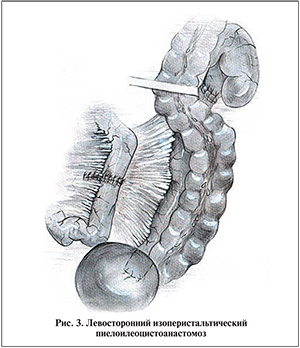
В зависимости от протяженности дефекта левого мочеточника через брыжейку сигмовидной кишки или после вскрытия париетальной брюшины мезентериального синуса в брюшную полость выводим мочеточник или лоханку, выполняем внутрибрюшинный уретероилео- или пиелоилеоанастомоз (рис. 2, 3). В ряде наблюдений при небольшой рубцово измененной лоханке, как правило при ранее оперированной и фиксированной в своем ложе почке, пиелоилеоанастомоз остается в паранефральном пространстве.

Расположить илеотрансплантат, сдвинув его латерально, можно позади сигмовидной и восходящей ободочной кишкой в пространстве левого бокового канала [13]. Раньше некоторые урологи использовали эту технику для помещения кишечного сегмента или только анастомозов в забрюшинное пространство. Сейчас такой необходимости нет, хотя данный метод имеет право на существование. Однако следует отметить, что он более сложен и не имеет никаких преимуществ перед способом, когда илеотрансплантат располагается медиально от нисходящей и сигмовидной кишки.
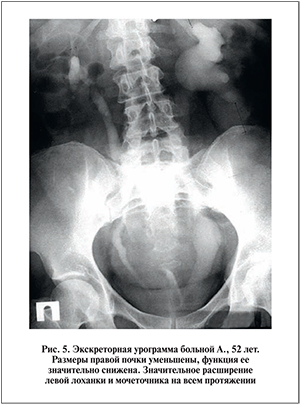 При тотальной илеоуретеропластике следует учитывать особенность анатомического строения тонкого кишечника. Дело в том, что для выполнения пиело- или каликоилеоцистоанастомоза необходим более длинный кишечный сегмент, при взятии которого следует ориентироваться прежде всего на его брыжейку. Необходимо выкроить последнюю так, чтобы концы ее без натяжения располагались рядом с лоханкой вверху и мочевым пузырем внизу. Однако в такой брыжеечный сегмент попадает соответствующий ему участок кишки – не прямой, а дугообразный и извилистый, а потому имеющий значительно большую длину, чем необходимо для тотальной илеоуретеропластики. Это связано со значительной извитостью всей тонкой кишки, а значит, и выключенной для пластики петлей. Поэтому, для того чтобы с ее помощью без натяжения преодолеть расстояние от лоханки до мочевого пузыря, необходим более длинный илеотрансплантат, по меньшей мере в 45–50 см. Включение такого дугообразного кишечного сегмента с множеством изгибов в мочевой тракт чревато застоем слизи и мочи, а также увеличивает площадь их возможной резорбции с развитием метаболических нарушений. Для укорочения и выпрямления кишечного трансплантата мы в большинстве случаев удаляем по 5–6 см кишечной трубки с обоих концов и/или резецируем 10–15 см в центральной части с последующим межкишечным анастомозом «конец в конец», оставляя брыжейку интактной (рис. 4).
При тотальной илеоуретеропластике следует учитывать особенность анатомического строения тонкого кишечника. Дело в том, что для выполнения пиело- или каликоилеоцистоанастомоза необходим более длинный кишечный сегмент, при взятии которого следует ориентироваться прежде всего на его брыжейку. Необходимо выкроить последнюю так, чтобы концы ее без натяжения располагались рядом с лоханкой вверху и мочевым пузырем внизу. Однако в такой брыжеечный сегмент попадает соответствующий ему участок кишки – не прямой, а дугообразный и извилистый, а потому имеющий значительно большую длину, чем необходимо для тотальной илеоуретеропластики. Это связано со значительной извитостью всей тонкой кишки, а значит, и выключенной для пластики петлей. Поэтому, для того чтобы с ее помощью без натяжения преодолеть расстояние от лоханки до мочевого пузыря, необходим более длинный илеотрансплантат, по меньшей мере в 45–50 см. Включение такого дугообразного кишечного сегмента с множеством изгибов в мочевой тракт чревато застоем слизи и мочи, а также увеличивает площадь их возможной резорбции с развитием метаболических нарушений. Для укорочения и выпрямления кишечного трансплантата мы в большинстве случаев удаляем по 5–6 см кишечной трубки с обоих концов и/или резецируем 10–15 см в центральной части с последующим межкишечным анастомозом «конец в конец», оставляя брыжейку интактной (рис. 4).
Такой технический прием предложил в 1950 г. J. Ballivet, первоначально использовав его при тонкокишечной пластике пищевода. Позже его одобрил Я. Кучера [14], отметив, что этим не только укорачивается взятый кишечный участок, но одновременно улучшается и его питание, так как кровоснабжающая трансплантат брыжейка остается прежних размеров. Отрицательной стороной данного приема является еще один межкишечный анастомоз и увеличение продолжительности оперативного вмешательства.
 Результаты и обсуждение. Ранние послеоперационные осложнения возникли у 8 (10,2%) пациентов и включали острую тонкокишечную непроходимость у 2 (2,6%), несостоятельность мочеточниково-кишечного анастомоза справа у 1 (1,3%), острый тромбоз илеотрансплантата у 1 (1,3%), внутрипочечное кровотечение с тампонадой лоханки, несостоятельностью лоханочно-кишечного анастомоза и мочевым перитонитом у 1 (1,3%), обострение хронического пиелонефрита у 3 (3,8%). В 5 (6,4%) случаях они потребовали повторных операций.
Результаты и обсуждение. Ранние послеоперационные осложнения возникли у 8 (10,2%) пациентов и включали острую тонкокишечную непроходимость у 2 (2,6%), несостоятельность мочеточниково-кишечного анастомоза справа у 1 (1,3%), острый тромбоз илеотрансплантата у 1 (1,3%), внутрипочечное кровотечение с тампонадой лоханки, несостоятельностью лоханочно-кишечного анастомоза и мочевым перитонитом у 1 (1,3%), обострение хронического пиелонефрита у 3 (3,8%). В 5 (6,4%) случаях они потребовали повторных операций.
В отдаленном послеоперационном периоде осложнения развились у 7 (8,9%) больных и в 4 (5,1%) наблюдениях потребовали оперативного лечения.
У этих пациентов сформировались стриктуры уретероилеоанастомозов спустя 3 мес и более после операции. Проходимость мочевыводящих путей была восстановлена путем антеградного бужирования стриктур. У 2 (2,6%) пациентов имел место клинически незначимый активный пузырно-лоханочный рефлюкс и у 1 (1,3%) – обострение хронического пиелонефрита. Результаты консервативного лечения и повторных операций оказались успешными. Летальных исходов не было.
Примером тотальной левосторонней илеоуретеропластики служит следующее клиническое наблюдение.
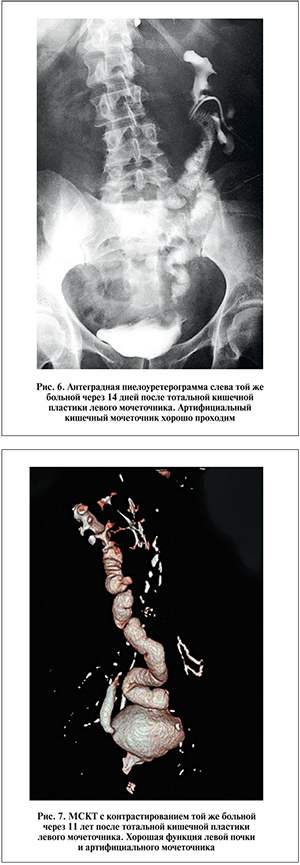
Б о л ь н а я А. 52 лет госпитализирована в нашу клинику 12.09.2001 с жалобами на периодические боли в пояснице слева. По данным УЗИ левая почка увеличена в размерах, полостная система ее расширена, справа – вторичный нефросклероз. На экскреторных урограммах контрастирование полостной системы почек замедлено, слева определяется резкое расширение мочеточника на всем протяжении до 2–3 см, справа – признаки сморщенной почки (рис. 5).
Диагноз: стриктуры нижней трети обоих мочеточников, двусторонний гидроуретеронефроз, вторичный нефросклероз справа, хронический пиелонефрит, латентная фаза, хроническая почечная недостаточность 2-й ст. Выполнена чрескожная пункционная нефростомия слева.
С учетом двустороннего характера поражения, выраженного расширения и гипотонии левого мочеточника решено полностью заместить его кишечным сегментом. 20.09.2001 выполнена срединная лапаротомия разрезом от мечевидного отростка до лона. Левый мочеточник выделен на всем протяжении. Он резко расширен, стенка инфильтрирована, рубцово изменена. Мочеточник удален, взят сегмент подвздошной кишки длиной 50 см, проходимость кишки восстановлена анастомозом «конец в конец» однорядным узловым викриловым швом. Для устранения извитости и большой площади взятого проксимального сегмента кишки из центральной его части резецировано 15 см. Выпрямленный таким образом трансплантат расположен изоперистальтически, на интубаторах выполнены анастомозы с лоханкой и мочевым пузырем. Один из интубаторов рядом с нефростомой выведен на кожу, второй – наружу по уретре с катетером Фолея. Установлены дренажи в область анастомозов, рана послойно ушита. Осложнений после операции не было, рана зажила первичным натяжением. Интубатор удален на 12-е сутки. При антеградной пиелоуретерографии контрастное вещество свободно проходит по кишечному трансплантату (рис. 6). Нефростома удалена, больная выписана на амбулаторное лечение.
При контрольном обследовании через 5 лет метаболических нарушений не выявлено, уровень креатинина крови в пределах референсных значений. Данные экскреторной урографии и реносцинтиграфии свидетельствовали о хорошей функции почек и мочевых путей. В очередной раз обследована в 2012 г. За прошедшее время особых жалоб не предъявляла. Клинические и биохимические анализы крови в пределах нормы. На выполненной МСКТ с контрастированием функция левой почки и кишечного мочеточника хорошая (рис. 7).
Сравнив полученные нами данные с литературными, хотим отметить, что результаты, приведенные разными авторами, зачастую сильно разнятся. Так, R. Boxer и соавт. [8] оценивают результаты кишечной пластики мочеточников среди 89 пациентов как положительные в 81% случаев. В. С. Карпенко [7], представив опыт лечения 131 больного, также считает илеоуретеропластику не только оправданной, но и весьма эффективной операцией. Среди послеоперационных осложнений были отмечены обострение хронического пиелонефрита (5,3%), почечная (1,5%) и сердечно-сосудистая недостаточность (3,0%), трахеобронхиты (1,5%). В двух наблюдениях по поводу эвентрации тонкой кишки и некроза кишечного трансплантата потребовались повторные экстренные оперативные вмешательства. Умер один больной. В другой работе S. A. Armatys и соавт. (2009) [9], оценивая отдаленные результаты илеоуретеропластики у 91 пациента, также сообщают о высокой частоте осложнений. Так, в раннем послеоперационном периоде они возникли в 43,0% наблюдений, в отдаленном – в 23,0%. Однако авторы объясняют столь высокие показатели тем, что 74 (81,3%) больных ранее были неоднократно оперированы или получали лучевую терапию. Особенно часто осложнения развивались у пациентов с забрюшинным постлучевым фиброзом.
Заключение. Подвздошная кишка является универсальным пластическим материалом, позволяющим заместить дефекты мочеточника любой локализации и протяженности. Левосторонняя илеоуретеропластика является одним из наиболее разработанных и простых методов кишечной реконструкции мочеточников. Тонкокишечный трансплантат следует располагать в изоперистальтическом положении и внутрибрюшинно, т.е. оставлять его в условиях, свойственных данному органу. Мочекишечные анастомозы также лучше располагать внутрибрюшинно, хотя проксимальное лоханочно-кишечное и особенно чашечно-кишечное соустья при выраженном паранефральном рубцовом процессе оказываются в забрюшинном пространстве. Изоперистальтическая пластика левого мочеточника возможна, когда илеотрансплантат находится ниже и позади межкишечного анастомоза.
При тотальной илеоуретеропластике следует выполнять резекцию кишечного сегмента в его центральной части по Ballivet, а в ряде случаев и концов трансплантата, что позволяет укоротить и выпрямить илеотрансплантат.


