Введение. Одной из актуальных проблем современной дерматовенерологии и урологии является совершенствование качества лечения пациентов с инфекциями, передаваемыми половым путем (ИППП), сопровождающимися осложнениями.
У мужчин к числу таких осложнений относятся эпидидимит, хронический уретрит, простатит. Простатит, возникший в результате полового инфицирования, доминирует в общей структуре заболеваний предстательной железы [1–4].
В современном обществе хронический простатит (ХП) становится распространенным заболеванием среди мужчин в возрасте от 20 до 45 лет. Хроническим простатитом страдают от 8 до 40% мужчин. По данным зарубежных авторов, распространенность ХП составляет 9%, из них только две трети обращаются за медицинской помощью. Несмотря на успехи современной урологии, лечение ХП по-прежнему является неразрешенной проблемой [5, 6].
Некоторые авторы считают, что абактериальный простатит встречается редко (не более чем в 7%), а трихомонады и хламидии выявляются в 76 и 85% случаев ХП соответственно, часто в сочетании [7].
У пациентов с гиперплазией предстательной железы при использовании ПЦР-тестирования Trichomonas vaginalis обнаружена в 34% наблюдений. При этом наличие патогена было ассоциировано с воспалительными изменениями в периферической крови. Вероятно, T. vaginalis причастна к воспалительным изменениям при гиперплазии предстательной железы путем стимуляции продукции провоспалительных цитокинов [8].
Действительно, T. vaginalis стимулирует в эпителиальных клетках при гиперплазии предстательной железы повышение уровня цитокинов, таких как CXCL8, CCL2, IL-1β и IL-6, стимулируя миграцию моноцитов и тучных клеток в очаг заражения, обусловливая таким образом развитие воспалительного процесса [9].
Однако роль урогенитальной хламидийной и трихомонадной инфекций в развитии ХП остается причиной оживленных дебатов среди исследователей. Несмотря на то что ДНК C. trachomatis и T. vaginalis были выделены в секрете предстательной железы, нельзя исключить возможную контаминацию из уретры [5, 7–9].
Ряд исследователей полагают, что первичного инфекционного простатита не существует, а может быть только вторичный инфекционный простатит вследствие ряда морфологических изменений или нарушений функции предстательной железы. Подавляющее большинство возбудителей бактериальных простатитов относится к грамотрицательным микроорганизмам кишечной группы (E. coli, Klebsiella spp., Proteus spp., Enterobacter spp. и др.). Этиологическими факторами могут быть также U. urealiticum, S. aureus, S. saprophyticus, Trichomonas spp., Pseudomonas spp., анаэробы и др. Развитие простатита может быть обусловлено проникновением возбудителя из уретры каналикулярным или лимфогенным путем. У 90–95% молодых мужчин в возрасте до 45 лет ХП является следствием уретральных инфекций – гонококковых и негонококковых уретритов [10, 11].
В настоящее время ХП рассматривается большинством специалистов как воспалительное заболевание инфекционного генеза с возможным присоединением аутоиммунных нарушений, характеризующееся поражением как паренхиматозной, так и интерстициальной ткани предстательной железы.
Кроме бактериальной теории выделяют также аутоиммунную и гемодинамическую теории развития ХП [5, 12, 13].
К известным на сегодняшний день возбудителям ИППП относится более 30 различных бактерий, вирусов, грибков, простейших и других паразитов. Кроме негативного влияния на здоровье человека и снижение качества жизни ИППП оказывают выраженное воздействие на репродуктивную функцию человека.
Урогенитальный трихомониаз (УГТ) – заболевание мочеполовой системы, вызываемое T. vaginalis – одноклеточным анаэробом из отряда простейших класса жгутиковых. Урогенитальный трихомониаз является наиболее распространенной в мире ИППП невирусной природы и основной причиной негонококковых уретритов [1, 14].
T. vaginalis паразитирует на эпителиальных клетках, не образует экзотоксина, повреждение клеток «хозяина» происходит только при непосредственном контакте. Попадая в мочеполовой тракт, в среднем через 3–7 дней трихомонады вызывают воспаление в виде острого, подострого или торпидного уретрита (уретропростатита [11]) у мужчин и вульвовагинита и уретрита у женщин. Как правило, процесс изначально протекает в острой или подострой форме, по прошествии 2 мес воспалительная реакция стихает и трихомониаз переходит в хроническую форму.
По данным официальной статистики, заболеваемость УГТ в Российской Федерации также является лидирующей среди ИППП за последние десятилетия. При этом отмечаются региональные различия: так, в Новосибирске за последние годы уровень заболеваемости трихомониазом превысил общероссийские показатели более чем в 3 раза (в 2015 г. – в 3,8 раза; см. таблицу).
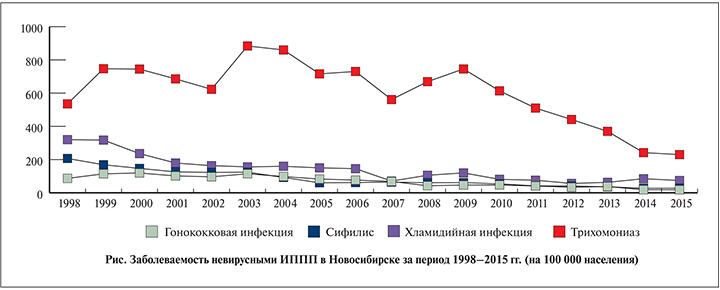
Отмечаются отчетливые половые различия среди зарегистрированных больных трихомониазом: женщины инфицированы значительно чаще, чем мужчины (в 1,8 раза). Наиболее высокий уровень заболеваемости ИППП закономерно отмечается в возрастной группе 18–29 лет.
Как видно на рисунке, заболеваемость всеми невирусными ИППП за последние два десятилетия снижалась, однако УГТ остается наиболее частой инфекцией, встречаемость которой по количеству выявленных случаев сопоставима со всеми другими вместе взятыми (60%).
Таким образом, УГТ представляет собой важную проблему современной венерологии. На фоне общего снижения заболеваемости ИППП значительный удельный вес приходится на УГТ. Однако вопрос о непосредственном участии T. vaginalis в возникновении воспалительного процесса в предстательной железе пока остается открытым, требует дальнейшего изучения и обсуждения.
Единственной группой лекарственных препаратов, эффективных в отношении T. vaginalis, являются производные 5-нитроимидазолов, антипротозойная активность которых была установлена в 1956 г. [15]. В современных рекомендациях по лечению ИППП Центра США по контролю и профилактике заболеваний (CDC, 2015) в лечении трихомонадной инфекции метронидазол и тинидазол являются препаратами, одобренными для перорального и парентерального применения [2].
В российских клинических рекомендациях [16, 17] кроме вышеуказанных препаратов также рекомендуется использование орнидазола. В качестве первой линии указано курсовое применение препаратов, однократное введение рекомендуется как альтернативная терапия.
Клинические испытания, проведенные в РФ и на Украине, выявили лучшие показатели использования орнидазола по сравнению с метронидазолом. В Новосибирске терапия этими препаратами проводилась мужчинам с УГТ в виде моноинфекции. Клиническая эффективность метронидазола составила 57,6%, орнидазола – 94,5% (p<0,001), а микробиологическая – 77,1 и 98,2% соответственно (p<0,001) [18]. В Уфе микробиологическая эффективность метронидазола и орнидазола составила 78,9 и 97,4% соответственно, клиническая – 63,2 и 94,9% [19]. Сходные результаты получены на Украине: терапевтический эффект метронидазола при лечении трихомониаза у мужчин составил 67,8%, орнидазола – 92,3% [20].
Отечественные исследователи также отмечают высокие показатели излеченности орнидазолом хронической трихомонадной инвазии у больных микст-хламидийной мочеполовой инфекцией (клиническая – 88,9% и бактериологическая – 83,3% при наблюдении в течение 2 нед после окончания лечения соответственно) [21].
Несколько худшие результаты, полученные при лечении метронидазолом, вероятно, связаны с тем, что микроорганизмы часто образуют резистентные к препарату штаммы. Метронидазол используется во врачебной практике не одно десятилетие при лечении самой различной патологии (гастрит или язвенная болезнь двенадцатиперстной кишки, связанные с Helicobacter pylori; протозойные инфекции (амебиаз, лямблиоз, кожный лейшманиоз, УГТ); инфекции, вызываемые Bacteroides spp.; бактериальный вагиноз; периоральный дерматит и др.). Нельзя не учитывать, что самолечение и нередко необоснованное применение метронидазола могли приводить к формированию резистентных штаммов T. vaginalis [22].

Как известно, метронидазол при достаточной эффективности имеет ряд существенных недостатков. Во время курса и на протяжении 48 ч после терапии метронидазолом пациенту категорически запрещается принимать алкоголь ввиду высокого риска развития антабусной (дисульфирамовой) реакции. Метронидазол вызывает ощущение сухости во рту и нередко окрашивание мочи по типу мясных помоев, о чем следует предупреждать пациентов. Побочные эффекты при применении метронидазола наблюдались в 42,1–59% наблюдений и лишь в 3,7–7,7% – при лечении орнидазолом [18, 19]. В аналогичном исследовании другие авторы наблюдали более редкую частоту побочных эффектов: 6 и 0% для метронидазола и орнидазола соответственно [20].
Меньшая частота приема и удобство применения повышают приверженность пациентов к лечению. Со структурными особенностями молекулы орнидазола связана более низкая частота развития нежелательных реакций, в том числе со стороны желудочно-кишечного тракта [18–22].
В настоящее время наблюдается неуклонная тенденция к ассоциации возбудителей ИППП, возникновению так называемых микст-инфекций, что, несомненно, существенно ухудшает течение и прогноз заболевания. Наиболее вероятной причиной формирования микст-инфекций является неэффективность антибактериальной терапии. Неправильный выбор препарата, его дозы, несоблюдение больным режима приема приводят лишь к стиханию острых симптомов и развитию хронического процесса [15]. Последующие заражения другими возбудителями сопровождаются формированием ассоциации, которая существует уже в виде биопленки и может целиком передаваться половому партнеру. Основная роль в формировании биопленки принадлежит гарднереллам (Gardnerella vaginalis) [23].
Биопленка – это конгломерат микроорганизмов, расположенных на какой-либо поверхности, клетки которых прикреплены друг к другу. Микроорганизмы образуют биопленку под влиянием множества факторов, включая клеточное распознавание мест прикрепления к поверхности, наличие питательных или, напротив, агрессивных субстанций, кислорода и др.
В режиме образования биопленки клетка изменяет свое поведение, что регулируется степенью экспрессии разных генов. Именно эта биопленка как клей притягивает другие микроорганизмы, образуя конгломерат бактерий, в большинстве своем обладающих патогенным для макроорганизма эффектом [24].
Другим объяснением того, что хронический УГТ зачастую представляет собой смешанный протозойно-бактериальный процесс, является способность трихомонад к внутриклеточному поглощению различной патогенной микрофлоры. Служа резервуаром для этих микроорганизмов, T. vaginalis способствует уменьшению их количества на поверхности слизистой, что может приводить к снижению напряженности иммунитета хозяина и вследствие этого малосимптомному, вялому течению местного воспалительного процесса.
Только у 10,5% больных трихомониаз протекает как моноинфекция, в 89,5% наблюдений выявляют смешанные мочеполовые инфекции в различных ассоциациях. Наиболее часто отмечается ассоциация T. vaginalis с микоплазмами (47,3%), гонококками (29,1%), гарднереллами (31,4%), уреаплазмами (20,9%), хламидиями (18,2%) и грибами (15,7%) [21].
Таким образом, для эффективной элиминации инфекционного агента, в частности T. vaginalis, было бы этиологически оправданным использование лекарственных препаратов, влияющих на гарднереллы.
Таким комбинированным препаратом является комбифлокс, содержащий два активных компонента – орнидазол и офлоксацин, каждый из которых рекомендован Российским обществом дерматовенерологов и косметологов и Российским обществом урологов при инфекциях мочевых путей у молодых мужчин (трихомонадный уретрит) и хроническом бактериальном простатите [16, 17].
Учитывая общность путей передачи ИППП, пациент может инфицироваться одновременно несколькими возбудителями (например, бактерии и простейшие). Причем длительно протекающие смешанные инфекции мочевых путей могут быть причиной выраженных морфологических изменений уротелия.
Показаниями к применению орнидазола и офлоксацина являются смешанные бактериальные инфекции, вызванные чувствительными грамположительными и грамотрицательными микроорганизмами, в ассоциации с анаэробными микроорганизмами и/или простейшими; инфекционно-воспалительные заболевания почек (пиелонефрит), нижних мочевыводящих путей (цистит, уретрит), половых органов и органов малого таза (эндометрит, сальпингит, оофорит, цервицит, параметрит, простатит, кольпит, орхит, эпидидимит).
Препаратом выбора для лечения простатита служат фторхинолоны, которые лучше всего проникают в ткань и секрет предстательной железы и перекрывают основной спектр возбудителей простатита.
Офлоксацин может с успехом применяться в лечении простатита, так как он высокоактивен в отношении хламидий, а в отношении микоплазм и уреаплазм его эффективность сопоставима с другими фторхинолонами и доксициклином. При хроническом простатите офлоксацин назначают внутрь по 400 мг 2 раза в сутки в течение 3–4 нед.
По химической структуре офлоксацин является пиперазинилзамещенным фторхинолоном с дополнительно «встроенным» метилзамещенным оксазиновым ядром. Основной механизм действия офлоксацина – ингибирование двух жизненно важных ферментов группы топоизомераз: топоизомеразы II (ДНК-гиразы) и топоизомеразы IV. Препарат разрывает цепи ДНК бактерии, дестабилизирует бактериальную хромосому и вызывает гибель микроорганизма, т.е. обладает бактерицидным эффектом. Такая специфичность мишени обеспечивает активность офлоксацина и других фторхинолонов в отношении большинства штаммов бактерий, в том числе устойчивых к действию антимикробных препаратов других групп [25].
Спектр противомикробной активности офлоксацина чрезвычайно широк. Офлоксацин высокоактивен в отношении большинства представителей грамотрицательной и грамположительной флоры, включая атипичные микроорганизмы – хламидии и микоплазмы, также гарднереллы. В Канаде при изучении 5553 изолятов различных патогенных микроорганизмов, полученных в 18 лабораториях, офлоксацин показал наиболее широкий спектр противомикробной активности по сравнению с другими фторхинолонами, оральными цефалоспоринами и пенициллинами [26]. К нему были чувствительны 94% патогенов респираторного и генитального тракта, кожи и мягких тканей, а также 93% возбудителей инфекций мочевыделительной системы.
В недавнем анализе результатов лечения более 50 тыс. пациентов с инфекциями мочевыводящей системы офлоксацин наряду с норфлоксацином продемонстрировал лучшую эффективность по сравнению с ципрофлоксацином и триметоприм/сульфаметоксазолом, особенно среди женщин с неосложненным течением инфекции [27].
Опыт лечения комбифлоксом 54 пациенток с лабораторно подтвержденным циститом, вызванным преимущественно Escherichia coli (73%) и Enterococcus faeсalis & cloacae (18%), показал высокую клиническую эффективность: 85% – в группе с обострением хронического цистита, 92% – в группе с острым циститом и 90% – в группе с циститом в сочетании с ИППП (T. vaginalis, C. trachomatis, G. vaginalis, M. hominis, U. urealyticum). Эрадикация микроорганизмов составила в этих группах соответственно 90, 92 и 95%. Частота побочных эффектов комбинированного препарата оказалась сопоставимой с таковой, регистрируемой при использовании и его компонентов в отдельности, и не превысила 3–6% [28].
М. А. Гомберг и соавт. [25] полагают, что выбор антибактериальной терапии должен проводиться на основании результатов микробиологических исследований; если же такой возможности нет, то может применяться эмпирический подход, при котором предпочтительным выглядит назначение комбинации производных нитроимидазолов (орнидазол) с фторхинолонами (офлоксацин).
Уникальная комбинация в одной таблетке двух активных молекул — орнидазола и офлоксацина – позволяет избегать излишней полипрогмазии во врачебных назначениях, тем самым минимизировать и максимально упрощать для пациента курс лечения осложненных и рецидивирующих ИППП.
По мнению специалистов [28, 29], недавно появившийся на отечественном рынке комбинированный антимикробный препарат комбифлокс должен занять достойное место в арсенале лекарственных средств для терапии ХП на фоне ИППП (C. trachomatis, М. genitalium и T. vaginalis). Рекомендованная схема применения данного препарата по 1 таблетке 2 раза в сутки в течение 7–10 дней представляется клинически и микробиологически эффективной и достаточной для терапии негонококкового уретрита у мужчин [29]. Ряд важных достоинств активных компонентов препарата (орнидазол и офлоксацин), таких как высокая активность в отношении внутриклеточных возбудителей и трихомонад, создание высоких и стабильных концентраций в тканях, длительный период полувыведения, хорошая переносимость, обусловливает возможность успешного использования комбифлокса для лечения хронического бактериального простатита.


