Введение. Мочекаменная болезнь (МКБ) занимает одно из первых мест среди урологических заболеваний, ее распространенность значительно варьируется в различных регионах мира, принимая в отдельных странах, в том числе и в Армении, эндемический характер [1–4]. С внедрением в клиническую практику дистанционной ударно-волновой литотрипсии (ДЛТ) и различных типов литотрипторов появилась возможность избавлять от конкрементов до 95% пациентов всех возрастов, страдающих практически любыми клиническими формами уролитиаза, в том числе с сопутствующими интеркуррентными заболеваниями [5–10].
Однако ДЛТ может вызывать травму как мочевых, так и прилегающих органов. Повреждения ударными волнами могут быть довольно серьезными, в том числе с потерей функционального объема паренхимы почки. Таким образом, то, что когда-то считалось абсолютно безопасным средством лечения почечных камней, может вызывать потенциально серьезные непредвиденные последствия [11]. Известно, что наиболее чувствительными к воздействию ударных волн являются ткани мочевыводящих путей, в первую очередь клетки переходного эпителия, к одной из главных функцией которых относится защитная [12–15].
С целью своевременного выявления выраженности повреждающего эффекта ударных волн на эпителиальные ткани мочевыводящих путей при литотрипсии, динамического наблюдения за балансом и состоянием клеток уротелия в ранние сроки после процедуры и, соответственно, выбора более адекватного метода профилактики и лечения возможных осложнений нами предложена и внедрена данная методика, одним из достоинств которой является возможность изучения прцессов деструкции и репарации тканей неинвазивными способами без использования биопсийного материала. Заметим, что изменения в паренхиме почек после ДЛТ достаточно хорошо изучены исследователями, чего нельзя сказать о воздействии ударных волн на стенку мочеточников [16–18].
 Материалы и методы. Исследование проведено в период с 2006 по 2014 г. в медицинском центре «Измирлян». Объектом исследования стали 300 пациентов в возрасте от 20 до 50 лет, впервые подвергшихся сеансу ДЛТ по поводу МКБ на литотрипторе Modulith SLK («Storz Medical») с электромагнитным генератором ударных волн. Пациенты проходили комплексное обследование и в случае обнаружения воспалительного процесса в мочевыводящих путях получали соответствующую антибактериальную терапию.
Материалы и методы. Исследование проведено в период с 2006 по 2014 г. в медицинском центре «Измирлян». Объектом исследования стали 300 пациентов в возрасте от 20 до 50 лет, впервые подвергшихся сеансу ДЛТ по поводу МКБ на литотрипторе Modulith SLK («Storz Medical») с электромагнитным генератором ударных волн. Пациенты проходили комплексное обследование и в случае обнаружения воспалительного процесса в мочевыводящих путях получали соответствующую антибактериальную терапию.
Материалом для исследования была моча пациента. Для сравнительной оценки выраженности повреждения тканей мочевыводящих путей и динамического наблюдения мочу на исследование забирали до сеанса ДЛТ, непосредственно после процедуры через 2 часа и на 4-й день после литотрипсии. Мочу собирали после туалета наружных половых органов или катетером в чистый сосуд (~150 мл) с герметически закрывающейся крышкой. Анализ проводили не позже 2 ч после получения материала. Мочу в сосуде осторожно размешивали, наливали в градуированные пробирки по 10 мл, центрифугировали 10 мин со скоростью 1500 об/мин. Надосадочную жидкость отсасывали пипеткой, оставляя около 0,5 мл осадка, который хорошо взбалтывали. Из осадка готовили один нативный препарат, а в случае отсутствия стекол с адгезивным покрытием в оставшийся материал добавляли маленькую каплю белково-глицериновой смеси для более стойкого прилипания элементов мочи к предметному стеклу и готовили два препарата. Материал на этих препаратах высушивали, фиксировали краской-фиксатором Май-Грюнвальда и затем докрашивали азурэозиновой смесью методом Паппенгейма [19]. Окраска препаратов может производиться любым другим общепринятым методом, в частности по Романовскому–Гимзе. При использовании метода окраски по Папаниколау единственным отличительным моментом является «мокрая» фиксация препарата до его высушивания.
Обзорная характеристика цитограмм дается при изучении препаратов при увеличении микроскопа с окуляром E-PL 10 и объективом 40/0,15 – нативный препарат, а с объективом 10/0,25 или 20/0,25 (марка микроскопа Axiostar Plus) – окрашенные препараты. Глубокие внутриклеточные изменения изучаются при увеличении микроскопа 10х1х100.
Для объективизации данных цитологического исследования использовали принципы морфометрии, позволившие переводить качественные характеристики в легкодоступные количественные показатели [20]. Эти исследования проводили при увеличении 10x1х20/0,45. При оценке разниц полученных числовых параметров применялся статистический критерий достоверности Стьюдента (р).
Общее число клеток (∑эк) высчитывается в 10 полях зрения (в каждой цитограмме) с последующим выведением среднестатистического числа клеток в 1 поле зрения (Хэп=∑эп /10) с одновременной дифференцировкой клеток эпителия (Хэп) и популляций соединительнотканных клеток (Хск – лейкоциты, макрофаги).
Для выявления глубины клеточного поражения рассчитывали индекс деструкции (ИД). С этой целью проводится подсчет числа эпителиальных клеток с явно выраженными цитопатологическими изменениями (Хцп), соотнося эти данные каждый раз (в каждом поле зрения) с общим числом эпителиальных клеток (∑эп). Подсчет вели в 10 полях зрения. ИД=Хцп/∑эп.
Формула клеток воспалительного ряда в осадке мочи выводится путем подсчета 200 лейкоцитов с последующим определением процентного содержания нейтрофилов, лимфоцитов, макрофагов.
Выраженность гематурии оценивали в ++++. Исследования проводили с помощью тест-полосок ФАН ( COMBUR Test UX, Roche), где «+» – это 5–10 эр/мкл; «++» – 15–50 эр/мкл; «+++» – 80–150 эр/мкл; «++++» – 250 эр/мкл и более.
Контролем служили данные цитологического исследования осадка мочи 50 практически здоровых людей.
Результаты. При исследовании мочи пациентов сразу после сеанса ДЛТ первое, что обращало на себя внимание, – это выраженная гематурия, которая оценивалась в ++++. Через 2 ч цвет мочи оставался прежним ( ++++). И только на 4-е сутки выраженность гематурии оценивалась в +.
Исходя из сути изучаемой проблемы, особое внимание уделяли процессам деструкции. Известно, что наиболее чувствительными к воздействию процедуры ДЛТ являются ткани мочевыводящих путей, в первую очередь клетки переходного эпителия, одной из главных функцией которых является защитная [3]. Поскольку баланс эпителиальных клеток, их состояние являются наиболее значимым критерием в оценке глубины повреждения ткани при ДЛТ и процессах репарации, акцент в своих исследованиях мы делали на изменениях именно в этой клеточной популяции.

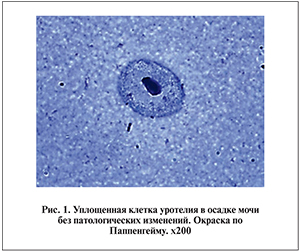
Цитограмма осадка мочи у пациентов с МКБ до сеанса литотрипсии незначительно отличалась от таковой у практически здоровых людей. Клетки переходного эпителия располагались разрозненно или в виде мелких групп (по 2–3 клетки), редко – комплексами по 5–6 клеток (рис. 1).
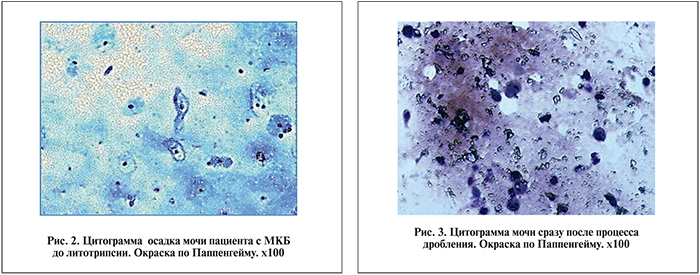
Клетки преимущественно полигональные, ядра вытянуты, хроматин рыхлый, равномерно распределен в ядре. Границы клеток четкие. Однако в небольшом числе присутствовали клетки с дистрофическими изменениями в виде мелкой вакуолизации в цитоплазме или клетки с гиперхромным бесструктурным ядром. Клеток воспалительного ряда было немного, у некоторых пациентов лейкоциты формировали небольшие негустые скопления. Как правило, микрофлора скудная, смешанная; определялось много кристаллов солей (рис. 2).
 Моча пациентов сразу после процедуры литотрипсии была кровянистого цвета, а в цитограмме осадка мочи наряду с нормальным уротелием присутствовали клетки с признаками повреждения. Располагались клетки разрозненно или мелкими группами (рис. 3).
Моча пациентов сразу после процедуры литотрипсии была кровянистого цвета, а в цитограмме осадка мочи наряду с нормальным уротелием присутствовали клетки с признаками повреждения. Располагались клетки разрозненно или мелкими группами (рис. 3).
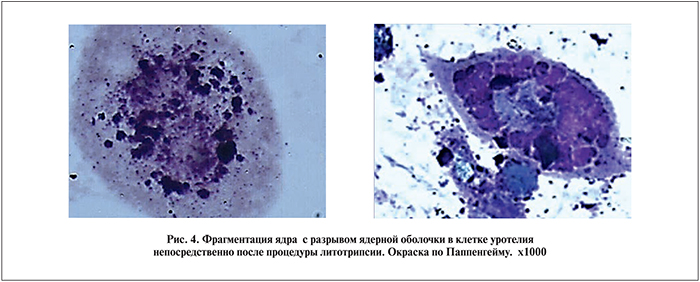
Многие клетки набухшие, увеличены в размерах, содержали вакуоли. У некоторых клеток оболочки разорваны. В некоторых клетках ядра фрагментированы или разбросаны по всей клетке в виде пылевидной зернистости. Элементы воспалительного ряда редки. Значительное число эритроцитов. Много мелких осколков и пылинок конкрементов (рис. 4).
Через 2 ч после литотрипсии цвет мочи оставался красноватым, а в цитограмме осадка мочи встречались клетки типа «пустых» с разбросанным ядерным материалом в цитоплазме. Часть клеток имела околоядерное просветление в виде ободка, присутствовали вакуолизированные клетки, кроме того, в значительном числе наблюдались обрывки цитоплазмы, детрит. Число эритроцитов заметно уменьшилось, определилась масса пылинок неорганических солей (рис. 5).
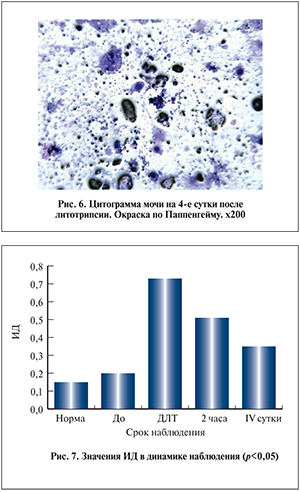
На 4-е сутки моча была желтого цвета, слегка мутной с кровянистым осадком в центрифугате. В цитограмме осадка мочи клетки уротелия были в основном без патологических изменений, хотя встречались и клетки с дегенеративными изменениями. Обращало на себя внимание значительное число пылевидных кристаллов неорганических солей (рис. 6).
Анализ результатов морфометрического исследования показал, что, если у практически здоровых людей в одном поле зрения присутствуют 3±2 клетки, то у пациентов с МКБ их, как правило, больше – 8±4. После сеанса ДЛТ отмечалось заметное увеличение числа эпителиальных клеток в моче (до 53±12) с максимумом через 2 ч – 110±15. К 4-м суткам число клеток эпителия снижалось до 35±15.
Число клеток воспалительного ряда в норме в среднем равнялось 2±2, а у пациентов с МКБ – 8±4. Непосредственно после сеанса ДЛТ и через 2 ч показатели были почти одинаковыми – 12±5 клеток. На 4-е сутки их число составило 14±6.
Для изучения степени клеточного поражения проведен подсчет числа эпителиальных клеток с цитопатологическими изменениями (Хцп), и эти данные каждый раз (в каждом поле зрения) соотносились с общим числом эпителиальных клеток (Σэп). Сумма цитологических изменений эпителиоцитов дает «индекс деструкции» (ИД), ИД=Хцп/∑эп. В ходе исследования установлено, что клетки с цитопатологией присутствуют в незначительном количестве даже у практически здоровых людей. Непосредственно сразу после сеанса ДЛТ значения ИД поднимались до отметки 0,72±0,1 (р<0,05). Через 2 ч его показатели равны 0,5 ± 0,1, а на 4-е сутки ИД снижался до отметки 0,28±0,06 (рис. 7).
Обсуждение. Анализируя результаты исследования, мы не могли не учесть многофакторность воздействия на уротелий при сеансе ДЛТ. Это и целенаправленный волновой удар, и механическое повреждение при прохождении мелких осколков и пылинок раздробленного конкремента, и прочие менее значимые факторы. В связи с этим мы решили изучить: имеется ли характерная для каждого срока наблюдения специфичность в выраженности цитологических изменений?
С этой целью все эпителиальные клетки были разделены на подгруппы в зависимости от выраженности цитопатологических изменений:
- уротелий без патологических изменений;
- клетки со слабо или умеренно выраженными дистрофическими изменениями, такими как мелкокапельная вакуолизация цитоплазмы, нечеткость контуров, сравнительно большое бесструктурное ядро, зона просветления вокруг ядра, кутикулярная кайма.
- клетки с выраженными цитологическими изменениями, как то фенестрация цитоплазмы, голые ядра, вакуолизация ядер и цитоплазмы, фрагментация и распыление ядра.
Рассчитывали значения суммарного показателя клеток с одной из форм патологии и выводили внутригрупповую гетерогенность цитологических показателей по формуле: кл./Σэп, где кл. – среднее значение показателя клеток с одной из форм цитопатологии по всей выборке в целом, Σэп – общее число эпителиальных клеток.
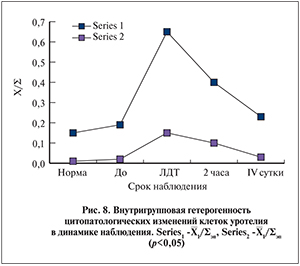 Изучение показателей внутригрупповой гетерогенности с умеренно выраженными деструктивными изменениями (1/Σэп) выявило, что их значения даже у практически здоровых людей чуть выше нуля (0,15±0,03). Сразу после сеанса литотрипсии эти показатели поднимались до отметки 0,6±0,1, а затем наблюдалось медленное снижение до 0,4±0,1 по прошествии 2 ч и до 0,25±0,07 к 4-м суткам.
Изучение показателей внутригрупповой гетерогенности с умеренно выраженными деструктивными изменениями (1/Σэп) выявило, что их значения даже у практически здоровых людей чуть выше нуля (0,15±0,03). Сразу после сеанса литотрипсии эти показатели поднимались до отметки 0,6±0,1, а затем наблюдалось медленное снижение до 0,4±0,1 по прошествии 2 ч и до 0,25±0,07 к 4-м суткам.
Что касается показателя, характеризующего глубокие клеточные изменения (2/Σэп), то в норме он практически равен 0, сразу после ударно-волнового воздействия наблюдался пик его повышения, через 2 ч – снижение и на 4-е сутки он приближался к исходной отметке. Необходимо отметить, что значения этого показателя на несколько порядков ниже, чем показатели клеток с умеренно выраженными деструктивными изменениями (рис. 8).
Результат исследования свидетельствует о том, что во время сеанса ДЛТ эпителий мочевыводящих путей претерпевает различной степени выраженности цитопатологические изменения (р<0,05). Данные изменения являются следствием многофакторного воздействия не только ударных волн, но и самого камня и образовавшихся после его разрушения фрагментов. Однако эти изменения носят кратковременный обратимый характер, о чем свидетельствует цитограмма осадка мочи пациентов уже на 4-е сутки после литотрипсии.
Применение вышеописанной методики позволяет получать объективные и высокозначимые клинико-диагностические данные о состоянии переходноклеточного эпителия после воздействия ударных волн при ДЛТ. Это позволяет выявлять патологические отклонения на самых ранних этапах и контролировать самые незначительные изменения в динамике наблюдения за пациентом, что невозможно сделать с помощью других современных неинвазивных методов исследования. Безусловно, отклонения в показателях, особенно таких, как выраженность гематурии и цифровые значения индекса деструкции, будут свидетельствовать о возникших осложнениях, в том числе и гематомы. В связи с этим мы предлагаем использовать описанный метод для изучения повреждающего эффекта ударных волн именно на уротелий при изменении параметров проведения сеансов литотрипсии в зависимости от типа источника генерации ударных волн (электрогидравлический, электромагнитный, пьезо и др.), частоты и энергии ударных волн и пр.
Особо отметим, что, хотя и современные автоматические анализаторы мочи могут представлять такие показатели, как число клеток эпителия, и даже фиксировать некоторые цитопатологические сдвиги, результаты таких исследований недостаточно информативны, поскольку отсутствуют данные о взаимосвязи между числом эпителиоцитов, выраженностью их повреждения и скоростью восстановительных процессов. Не говоря о том, что не во всех лабораториях имеется столь дорогостоящая аппаратура. Предлагаемая нами методика с использованием ряда объективных параметров (индекс деструкции, показатели внутригрупповой гетерогенности клеток) обеспечивает технический результат. Метод прост в исполнении, информативен, неинвазивен, экономичен (предполагает использование освоенных материалов и стандартного оборудования).



