Введение. За последние десятилетия в изучении причин развития обструкции верхних мочевых путей достигнуты значительные успехи [1, 2], однако, несмотря на массу опубликованных работ, до настоящего времени остаются неясными многие этиопатогенетические аспекты [3–5]. Нарушение пассажа с дилатацией проксимальнее места сужения в различные сроки после реконструкции мочеточника развивается в 6,5–37% случаев. Наиболее прогнозируемыми вариантами профилактики этих осложнений являются совершенствование техники выполнения анастомоза и дренирование зоны соустья установкой стента [6, 7].
Для изготовления урологических стентов используют металлы и полимеры [8, 9]. К достоинству первых следует отнести высокую торсионную жесткость, термостабильность при имплантации, способность к самостоятельному расширению или баллонной дилатации; к недостаткам – токсичность компонентов, входящих в состав сплава, и его способность к диффузии и накоплению в паренхиматозных органах [10, 11]. Полимерные материалы обладают большей по сравнению с металлами биоинертностью, стенты из полимеров на один-два порядка дешевле металлических. Другим способом достижения результата является использование гидролизируемых или биодеградируемых материалов. Экспериментальные исследования стентов из полимеров показали программируемую способность поддерживать просвет мочеточника на протяжении 14 – 60 сут (в зависимости от состава), лучшие показатели биоинертности и меньшую склонность к бактериальной контаминации по сравнению с рыночными аналогами [12, 13].
Одним из перспективных материалов среди биодеградируемых полимеров считают полигидроксиалканоаты (ПГА), которые являются резервными макромолекулами прокариот и синтезируются бактериями в специфических условиях несбалансированного роста. Совокупность свойств ПГА, таких как биологическая совместимость, биоразрушаемость и термопластичность, выдвигает эти полимеры в разряд высокотехнологичных материалов XXI в. Особенно перспективными областями применения ПГА являются биомедицинские технологии, связанные с разработкой материалов и устройств для реконструктивной хирургии [14, 15]. Опубликованы примеры применения ПГА для изготовления рассасываемого хирургического шовного материала, пригодного для ушивания мышечно-фасциальных разрезов [16] и наложения кишечных швов [17]; трубчатых стентов для реконструкции желчных протоков [18] и в качестве модели сосудистых эндопротезов [19, 20]; пленочных изделий в качестве искусственного перикарда, раневых покрытий [21] и опорных клеточных носителей [22]; а также биосовместимых покрытий металлических стентов [23], сетчатых эндопротезов [24] и др.
Цель настоящей работы: исследование эффективности применения биодеградируемых стентов на основе полигидроксиалканоатов по сравнению с коммерческим аналогом для дренирования верхних мочевых путей после пластики пиелоуретерального сегмента.
Материалы и методы. Работа выполнена на базе лаборатории биотехнологии новых биоматериалов, Института фундаментальной биологии и биотехнологии, Сибирского Федерального университета и кафедры урологии, андрологии и сексологии ИПО, кафедры патологической анатомии им. П. Г. Подзолкова с курсом ПО КрасГМУ им. профессора В. Ф. Войно-Ясенецкого. Проведение экспериментов одобрено локальным этическим комитетом КрасГМУ им. профессора В. Ф. Войно-Ясенецкого.
В исследовании использовали полимерные стенты на основе сополимера поли-3-гидроксибутирата с поли-4-гидроксибутиротом П(3ГБ/4ГБ) с включением 4 ГБ 30% (молекулярная масса, которого составляет 800 кDa, полидисперсность 1,76±0,04, кристалличность 50%, среднее отн. удлинение 392,8% ); смесь поли-3-гидроксибутирата с поликапролактоном П(3ГБ)/ПКЛ с включением ПКЛ 75% (среднее отн. удлинение 495,49%); стенты из полиуретана (производитель «Coloplast»).
Морфофункциональные изменения стентированного мочеточника изучены на 45 кроликах-самцах породы «советская шиншилла» массой 4550–5200 г.
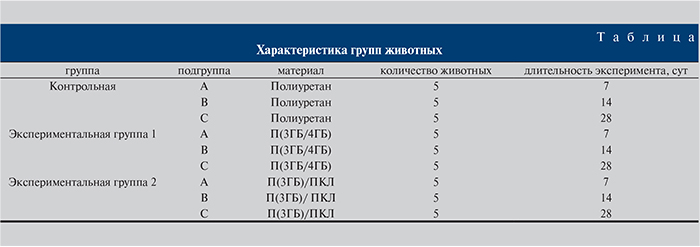
Перед началом эксперимента животных выдерживали на карантине в течение 7 сут в стандартных условиях вивария, за 4 ч до наркоза животным не давали ни пищи, ни воды. В зависимости от типа использованного материала было сформировано три группы (см. таблицу).
Оперативное вмешательство выполняли под общей анестезией в асептических условиях (дозу препарата рассчитывали с учетом массы тела животного, согласно рекомендациям производителя): ксилозин 17 мг и золетил 40 мг внутримышечно, в ходе операции 0,7 мг золетила по внутривенному катетеру, время действия – 5–7 мин.
Для установки стента в пиелоуретеральный сегмент (ПУС) выполняли продольный паралюмбальный разрез. Послойно рассекали кожу, подкожную клетчатку, наружную и внутреннюю косую мышцу, поперечную мышцу живота; брюшину отодвигали латерально, вскрывали забрюшинное пространство, выделяли верхнюю треть мочеточника, ПУС, почку. Мочеточник фиксировали на держалку, поперечно вскрывали в соустье ПУС, по струне устанавливали стент длиной 4 см, отдельными кетгутовыми швами разрез ушивали. Рану дренировали перчаточным дренажом. Операцию заканчивали послойным сопоставлением всех слоев. В раннем послеоперационном периоде с профилактической целью назначали офрамакс (цефтриаксон) в дозе 0,2 г 2 раза в сутки в течение 3 дней, а также анальгетики и спазмолитики.
Дренажные свойства исследуемых стентов оценивали на основании данных экскреторной урографии. Внутривенно вводили омнипак из расчета 0,5 мл на 1 кг массы тела животного в периферическую вену передней лапы. Спиральную компьютерную томографию (СКТ) выполняли на аппарате Phillips Digital в вентральном положении в нативном режиме и с контрастным усилением. Регистрировали экскреторную фазу через 4 мин, а при необходимости выполняли отсроченное исследование через 20 мин.
Животных выводили из эксперимента путем передозировки наркоза через 7, 14 и 28 сут наблюдения. При аутопсии оценивали состояние стента (его положение, плотность сращения со стенкой мочеточника), наличие и отсутствие спаечного процесса.
Морфологическому исследованию подвергали фрагменты мочеточника, ПУС в зоне стояния стента (в каждом случае иссекали участок размером 0,5х0,5 см).
Материал фиксировали в забуференном 10%-ном нейтральном формалине и обрабатывали по общепринятой методике. Парафиновые срезы стандартной толщины (5 мкм) окрашивали гематоксилином и эозином и пикрофуксином по Ван-Гизону. Микроскопическое исследование и фотофиксацию приводили с применением светового микроскопа Carl Zeiss Imager.A1 («Carl Zeiss», Германия), объективы 10, 20, 40 с адаптированной цифровой фотокамерой AxioCam MRc 5.0. Морфометрию проводили с помощью программы Axio Vision и JMicroVision для среды Windows XP. Измеряли толщину уротелия, мышечной оболочки, проводили оценку воспалительной инфильтрации пиелоуретерального сегмента.
Статистическую обработку данных выполняли в программе Microsoft Office Exсel 2010. При анализе данных совокупности рассчитывались средние показатели (средняя арифметическая [хср]; среднее квадратичное отклонение [σ]). Оценка характера распределения производилась по тестам на нормальность. Исследуемые показатели имели нормальное распределение, приведены в их среднем значении со средней квадратичной ошибкой: М±σ.
 Результаты и обсуждение. Все животные удовлетворительно перенесли операции, интраперационных осложнений ни в одном случае не зафиксировано. Продолжительность операции во всех группах составила 27,5±4,7 мин и статистически значимо не отличалась между группами. Ранний послеоперационный период протекал гладко, дренажи удалены на 3-е и 5-е сутки, кожные швы сняты на 10–12-е сутки, заживление послеоперационных ран per prima.
Результаты и обсуждение. Все животные удовлетворительно перенесли операции, интраперационных осложнений ни в одном случае не зафиксировано. Продолжительность операции во всех группах составила 27,5±4,7 мин и статистически значимо не отличалась между группами. Ранний послеоперационный период протекал гладко, дренажи удалены на 3-е и 5-е сутки, кожные швы сняты на 10–12-е сутки, заживление послеоперационных ран per prima.
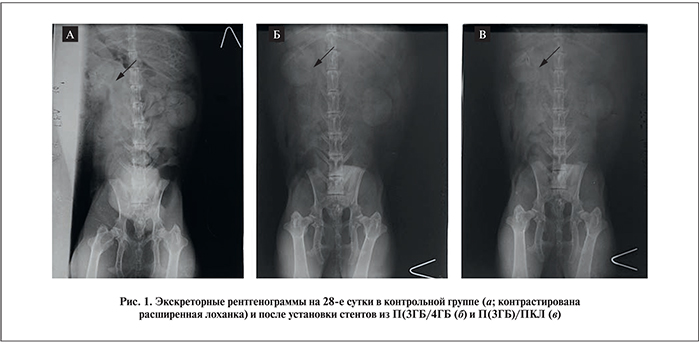
Исследования в рентгеноскопическом режиме проводили до операции, на 14-е и 28-е сутки после операции, что позволило зафиксировать время визуализации нефрограммы, чашечно-лоханочной системы, продолжительность эвакуации по мочеточнику. В группах со стентами из П(3ГБ/4ГБ) и П(3ГБ)/ПКЛ не выявлено статистически значимых различий по сравнению с результатами предоперационного исследования. Так, нефрограмма до операции визуализировалась в среднем через 56,8±5,2 с от момента введения контраста, на 14-е сутки – через 60,2±5,3 с, а на 28-е сутки – через 61,3±5,0 с (р>0,05). Время визуализации чашечно-лоханочной системы и мочеточника для экспериментальных групп до операции составило 144,30±12,7 с, на 14-е сутки – 148,1±12,3 с и на 28-е сутки – 149,7±10,5 с (р>0,05). При рентгеноскопии на всем протяжении выполнялись чашечно-лоханочная система и мочеточник. На 28-е сутки в экспериментальных группах функция почки сохранялась с обеих сторон, также визуализировались нерасширенные мочевыделительные пути.
У животных контрольной группы отмечены статистически значимые различия по сравнению с экспериментальными группами исследования, проявившиеся в увеличении времени визуализации нефрограммы, чашечно-лоханочной системы и мочеточника – эти показатели на 28-е сутки исследования составили 108,9±26,5 и 370,41±38,74 с соответственно (р<0,01). Кроме того, у животных контрольной группы отсутствовало болюсное выделение мочи, расширенный мочеточник равномерно наполнялся контрастом в 2–3 раза медленнее контралатерального (рис. 1).
На секции у всех животных контрольной группы с полиуретановыми стентами на 14-е сутки в забрюшинном пространстве отмечался спаечный процесс различной выраженности: у 4 (77,7%) – выраженный, у 1 (23,3%) – умеренно-выраженный. К 28-м суткам для животных контрольной группы было характерно наличие плотной паранефральной клетчатки, а также выраженного периуретерита на всем протяжении мочеточника.
В экспериментальных группах при макроскопическом исследовании на всех сроках исследования не выявлено существенных изменений, которые могли бы быть обусловлены нарушениями проходимости мочевыводящих путей и мочевой гипертензией. Спаечный процесс в забрюшинном пространстве отсутствовал, определялись единичные спайки в области паралюмбального рубца. Почки не увеличены, фиброзная капсула не утолщена, поверхность почек гладкая, отсутствовала дилатация чашечно-лоханочной системы и мочеточника.

При морфологическом исследовании поперечных срезов мочеточника у животных контрольной группы на 7-е сутки эксперимента выявлена дилатация мочеточника, средний диаметр просвета составил 3,5±0,4 мм. Отмечено утолщение стенок мочеточника вследствие гипертрофии мышечного слоя и воспалительного отека подслизистого. Толщина слизистого слоя составила 74,3±8,5 мкм, при этом уротелий был сохранен не везде. В поверхностных слоях собственной пластинки определялись небольшие очаговые воспалительные инфильтраты, представленные преимущественно клетками гранулоцитарного ряда, местами распространяющиеся на мышечную оболочку, толщина которой составила 115,5±12,2 мкм.
При гистологическом исследовании материала экспериментальной группы 1 во всех случаях на 7-е сутки без труда визуализировался полимерный стент из П(3ГБ/4ГБ), имеющий вид слабоэозинофильной полупрозрачной каймы. На поперечных срезах просвет мочеточника умеренно расширен до 2,6±0,3 мм. Уротелий сохранен на всем протяжении установленного стента, мышечный слой имел равномерную толщину, отек подслизистого не выражен. Эпителиальный пласт имел неравномерную толщину, составившую в среднем 111,7±17,6 мкм, был истончен в местах более плотного прилегания полимерного стента.
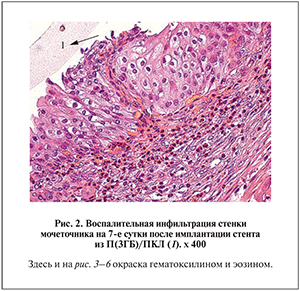
Клетки воспалительного инфильтрата во всех группах располагались главным образом в подслизистом слое (рис. 2) и были представлены лимфоцитами (2±1 клетка в поле зрения), эозинофилами (5±2 клетки в поле зрения). Миоциты обычного вида не гипертрофированы. Толщина мышечного слоя составила 198,4±38,5 мкм, тогда как в контрольной группе этот показатель был достоверно ниже (р<0,01).
В экспериментальной группе 2 после имплантации стента из П(3ГБ)/ПКЛ на 7-е сутки регистрировалась умеренная дилатация просвета мочеточника, характеризовавшегося неровными контурами. Отек подслизистого слоя был незначительный. Имело место сегментарное истончение уротелия, толщина которого составила в среднем 124,5±12,5 мкм.
Мышечная оболочка не гипертрофирована, ее толщина в среднем составила 199,2±9,2 мкм. Воспалительный инфильтрат был выражен минимально с неравномерным расположением немногочисленных лимфоцитов – 2±1 клетка в поле зрения, гистиоцитов – 4±2 клетки в поле зрения. В двух наблюдениях обнаружены единичные многоядерные клетки типа инородных тел. На данном сроке склеротические изменения стенки мочеточника не были выраженными.
На 14-е сутки после стентирования в препаратах контрольной группы отмечены дилатация мочеточника, гипертрофия и воспалительный отек его стенки, а также гиперпластические и десквамативные изменения уротелия. Средний диаметр просвета мочеточника составил 3,9±0,3 мм, толщина стенки – 343,8±43,2 мкм. Уротелий на отдельных участках истончен, большей частью утолщен до 106,1±12,6 мкм с образованием гиперпластических псевдополипозных разрастаний. Подслизистая основа отечна, утолщена до 40,8±2,1 мкм. Клеточная межуточная инфильтрация относительно выражена. Количество полиморфно-ядерных лейкоцитов, лимфоцитов и гистиоцитов составило 15±7, 10±5 и 12±4 клетки в поле зрения. Мышечная оболочка мочеточника гипертрофирована до 237,7±42,3 мкм с умеренно выраженным фиброзом.
В те же сроки в экспериментальной группе 1 после имплантации стента П(3ГБ/4ГБ) просвет мочеточника на уровне расположения стента был складчатый, минимально расширен в дистальном отделе. Слизистая оболочка в месте расположения стента со сглаженным контуром, но с наличием крупных продольных складок, умеренно гиперплазирована. Толщина уротелия в среднем составила 119,1±12,5 мкм. На большем протяжении стент располагался свободно, без адгезии к поверхности переходного эпителия (рис. 3). Имели место незначительный отек в подслизистом слое и незначительная гипертрофия мышечной оболочки, толщина которой составила 169,1±23,5 мкм, что достоверно меньше контроля (р<0,05). Клетки воспалительного характера отсутствовали или единичны.
В экспериментальной группе 2 после имплантации стента П(3ГБ)/ПКЛ на 14-е сутки определился слабовыраженный отек собственной пластинки слизистой оболочки и подслизистого слоя. Воспалительная инфильтрация выражена минимально, представлена единичными мелкоочаговыми инфильтратами из мононуклеарных клеток (рис. 4). Толщина переходного эпителия составила 116,2±12,1 мкм. Проксимальные сегменты мочеточников не расширены. Мышечный слой в среднем имел толщину 176,8±20,7 мкм. Слизистая мочеточника с признаками умеренно выраженной гиперплазии. Деэпителизированные участки были единичными, имели небольшую протяженность (см. рис. 4). Подслизистый и мышечный слои обычного вида.
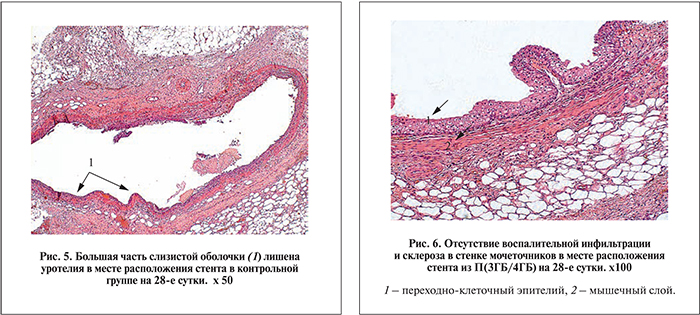
В контрольной группе на 28-е сутки эксперимента толщина слизистого слоя мочеточника составила 74,2±8,1 мкм, на большинстве участков уротелий отсутствовал (рис. 5). Гипертрофированная оболочка имела толщину 183,2±29,1 мкм с явлениями пролиферации соединительнотканных элементов. Подслизистый слой имел более компактную структуру за счет накопления волокон соединительной ткани и пролиферации фибробластов (40±19 клеток в поле зрения) и фиброцитов (56±12 клеток в поле зрения).
В экспериментальной группе 1 после имплантации стента П(3ГБ/4ГБ) стенка мочеточника проксимальнее стояния стента сохраняла продольную складчатость. Мочеточники не расширены: наружный диаметр – 1,4±0,7 мм. Слизистая мочеточника сохранена, без псевдополипозных разрастаний уротелия и деэпителизированных участков. Регистрировали незначительный отек подслизистой; гипертрофических и воспалительных изменений в мышечном слое не выявлено, их толщина составила 28,5±9,2 и 173±12,1 мкм соответственно (р<0,05). Уротелий мочеточников не утратил барьерных функций, поэтому стенка мочеточника не содержала воспалительных инфильтратов (рис. 6). Клетки лейкоцитарного происхождения диффузно располагались в подслизистом слое и были представлены лимфоцитами и гистиоцитами – 2±1 и 7±4 клетки в поле зрения. Умеренная фибробластическая реакция выявлена также в подслизистом слое: число фибробластов составило 19±5 клеток в поле зрения, фиброцитов – 32±5 клеток в поле зрения.
В экспериментальной группе 2 после имплантации стента из П(3ГБ)/ПКЛ складчатость мочеточника сохранена. Слизистая оболочка в основном имела гладкие контуры с равномерной толщиной переходного эпителия 112,4±8,5 мкм. Отмечена некоторая разрыхленность собственной пластинки слизистой и подслизистого слоя, однако воспалительная инфильтрация отсутствовала, толщина мышечного слоя составила 163,20±20,7 мкм.
Проведено сравнительное исследование морфофункциональных изменений стентированного мочеточника кроликов после пластики стентом из полиуретана (контрольная группа) и полимерными стентами из поли-3-гидроксибутирата с поли-4-гидроксибутиратом П(3ГБ/4ГБ) и смеси поли-3-гидроксибутирата с поликапролактоном П(3ГБ)/ПКЛ (экспериментальные группы). Несмотря на разные показатели физико-механических свойств биодеградируемых стентов на основе ПГА, доказано, что после имплантации тканевая реакция на оба типа стента сопоставима: стенка мочеточника сохраняет продольную складчатость, гипертрофия мышечной оболочки отсутствует, слизистая оболочка имеет гладкие контуры с равномерной толщиной переходного эпителия, тогда как в контрольной группе имеет место продуктивное воспаление с исходом в склероз.
Заключение. Использование биодеградируемых стентов на основе ПГА для дренирования верхних мочевых путей позволяет сохранять перистальтику, интактность водителя ритма и проводящих путей проксимального отрезка мочеточника, предупреждает возникновение воспалительных изменений в области операции. Планируется проведение молекулярных и иммуногистохимических исследований, что в дальнейшем позволит перейти к ограниченным клиническим испытаниям биодеградируемых стентов и определить потенциальные возможности применения данного материала при пластике пиелоуретерального сегмента и лечении стриктур уретры.


