 Введение. Рак предстательной железы (РПЖ) является одним из наиболее распространенных онкологических заболеваний в мире. По данным национального реестра «Состояние онкологической помощи в Российской Федерации за 2014 год», распространенность РПЖ на 100 тыс. населения нашей страны в 2004 г. составила 38,4, а к 2014 г. выросла до 116,4. В то же время следует отметить, что удельный вес больных с I–II стадиями заболевания с 2004 по 2014 г. увеличился с 35,5 до 52,5%, а с III и IV стадиями снизился с 38,4 до 29% и с 22,7 до 16,5% соответственно [1]. Все это позволяет проводить радикальное лечение большему количеству больных РПЖ. На сегодняшний день, согласно данным Европейской ассоциации урологов, к радикальным методам лечения относятся хирургический (радикальная простатэктомия) и лучевой (дистанционная конформная лучевая и брахитерапия – контактная лучевая терапия) [2]. Брахитерапия рака предстательной железы – это разновидность лучевой терапии (контактная, или внутритканевая, лучевая), которая выполняется путем введения радиоактивных источников непосредственно в ткань простаты. К основным видам брахитерапии РПЖ относятся высокомощностная (облучение опухоли достигается за счет временного помещения в предстательную железу источников высокой мощности дозы, содержащих изотопы Ir-192, Co-60, Cs-137) и низкомощностная (выполняется имплантация микроисточников низкой мощности дозы, содержащих изотопы I-125, Pd-103, Cs-131, на постоянной основе) [3].
Введение. Рак предстательной железы (РПЖ) является одним из наиболее распространенных онкологических заболеваний в мире. По данным национального реестра «Состояние онкологической помощи в Российской Федерации за 2014 год», распространенность РПЖ на 100 тыс. населения нашей страны в 2004 г. составила 38,4, а к 2014 г. выросла до 116,4. В то же время следует отметить, что удельный вес больных с I–II стадиями заболевания с 2004 по 2014 г. увеличился с 35,5 до 52,5%, а с III и IV стадиями снизился с 38,4 до 29% и с 22,7 до 16,5% соответственно [1]. Все это позволяет проводить радикальное лечение большему количеству больных РПЖ. На сегодняшний день, согласно данным Европейской ассоциации урологов, к радикальным методам лечения относятся хирургический (радикальная простатэктомия) и лучевой (дистанционная конформная лучевая и брахитерапия – контактная лучевая терапия) [2]. Брахитерапия рака предстательной железы – это разновидность лучевой терапии (контактная, или внутритканевая, лучевая), которая выполняется путем введения радиоактивных источников непосредственно в ткань простаты. К основным видам брахитерапии РПЖ относятся высокомощностная (облучение опухоли достигается за счет временного помещения в предстательную железу источников высокой мощности дозы, содержащих изотопы Ir-192, Co-60, Cs-137) и низкомощностная (выполняется имплантация микроисточников низкой мощности дозы, содержащих изотопы I-125, Pd-103, Cs-131, на постоянной основе) [3].
Одной из важных проблем в развитии низкомощностной брахитерапии рака предстательной железы в нашей стране является высокая стоимость зарубежных источников излучения, применяемых для имплантации. В связи с этим в октябре 2015 г. в НМИРЦ при участии Физико-энергетического института им. А. И. Лейпунского (АО «ГНЦ РФ–ФЭИ» – Госкорпорация Росатом) впервые в нашей стране в рамках клинического испытания была проведена низкомощностная брахитерапия микроисточниками I-125 отечественного производства. Целью данной работы стало доказательство клинической эффективности и безопасности отечественных микроисточников I-125 при проведении низкомощностной брахитерапии при раке предстательной железы.
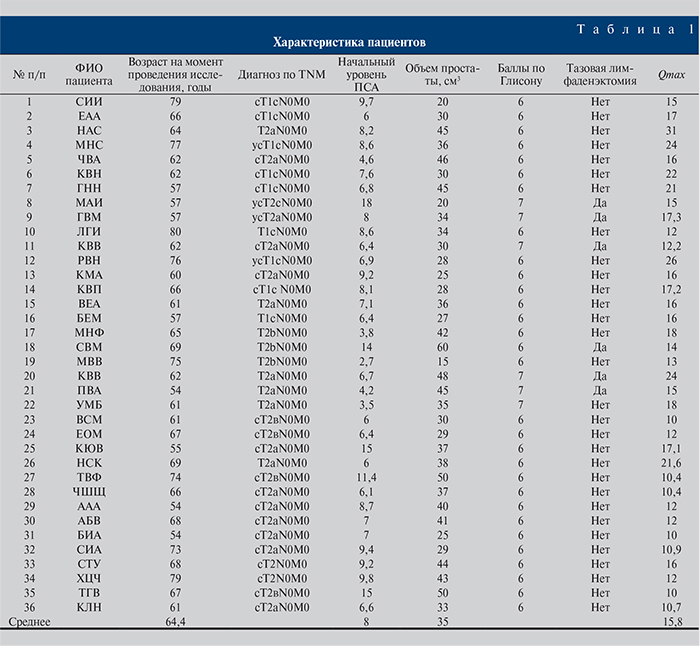
Материалы и методы. На сегодняшний день в рамках клинического исследования 36 больным раком предстательной железы стадий T1–Т2 выполнена низкомощностная брахитерапия отечественными микроисточниками I-125 (регистрационное удостоверение № РЗН 2016/4738 на применение источников I-125 производства АО «ГНЦ РФ–ФЭИ», выданное Росздравнадзором 07.09.2016). Пациенты были рандомизированы по степени онкологического риска прогрессирования РПЖ [2]. Группу низкого онкологического риска (благоприятный прогноз по классификации D’Amico) составили 30 (83,3%), умеренного онкологического риска (промежуточный прогноз по классификации D’Amico) – 6 (16,7%) больных. Возраст пациентов варьировался от 54 до 79 лет (средний возраст – 64,6 года), уровень простатспецифического антигена (ПСА) – от 2,3 до 18 нг/мл, составив в среднем 8 нг/мл. Объем предстательной железы до брахитерапии колебался от 15 до 60 см3 (средний – 35 см3). Максимальная скорость потока мочи, определенная при урофлоуметрии до начала исследования, варьировалась от 10 до 31 мл/с, составив в среднем 15,8 мл/с (табл. 1).
Все пациенты перед включением в исследование подписали информированное согласие. Больные были подробно проинформированы относительно методики проведения брахитерапии, о возможных побочных реакциях и мерах их предупреждения, а также о прогнозе заболевания.
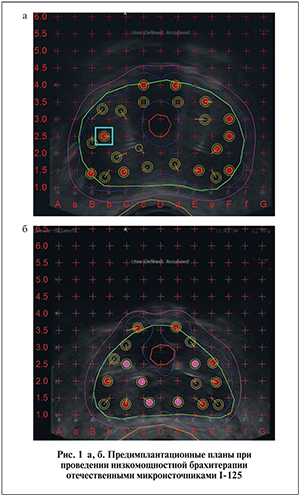
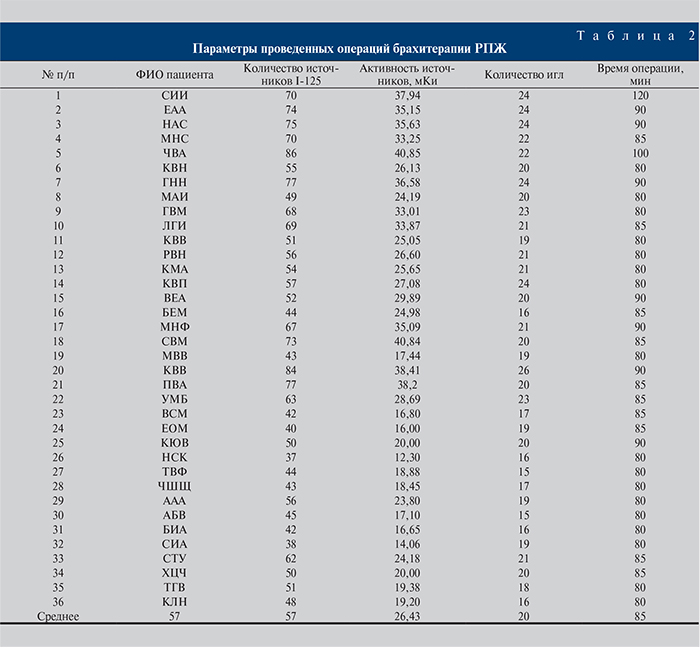
Пациентам группы низкого онкологического риска брахитерапию выполнили в монорежиме, при этом cуммарная доза облучения составила 145 Гр. Были использованы источники I-125 двух активностей – 0,55 и 0,35 мКи [3]. В зависимости от объема предстательной железы пациентам имплантировали от 40 до 80 микроисточников, в среднем 57 (рис. 1 а, б). Время имплантации в среднем составило 85 мин. Длительность пребывания в условиях стационара не превышала 2 сут. На следующий день после брахитерапии всех пациентов выписали домой. В табл. 2 представлены параметры проведенных брахитерапий рака предстательной железы у пациентов, принимавших участие в клинических исследованиях.
В группе промежуточного прогноза низкомощностная брахитерапия проведена в комбинации с лапароскопической тазовой лимфаденэктомией, которую выполили за 4–5 нед до брахитерапии. Страховочные дренажи удаляли через 3–4 дня после операции, однако у 3 пациентов была отмечена лимфорея до 2 нед.
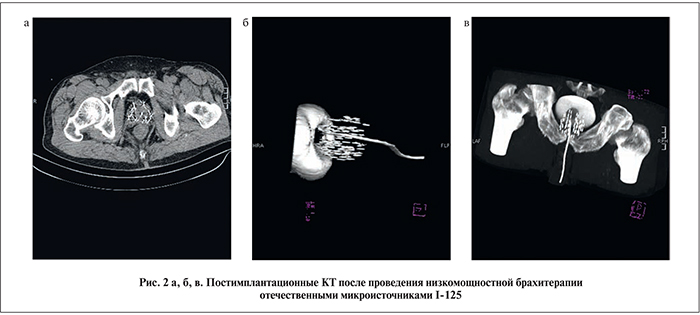
Результаты. С октября 2015 по июнь 2016 г. под наблюдением находились все 36 прооперированных пациентов. Контрольную КТ выполили на следующий день после имплантации с целью оценки качества и правильности установки микроисточников и через 5 нед после брахитерапии (рис. 2 а, б, в). Ни у одного из пациентов дефекта имплантации микроисточников выявлено не было.
Также был проведен дозиметрический контроль с целью оценки безопасности разработанных микроисточников I-125, по данным которого они признаны полностью безопасными для медперсонала, выполнявшего брахитерапию [4].
Среди пациентов, которым первым этапом выполнена тазовая лимфаденэктомия, только в одном случае был выявлен метастаз рака предстательной железы в единичном лимфатическом узле – аденокарцинома 7 (3+4) баллов по Глисону.
По результатам контрольного обследования через 6 мес после имплантации уровень ПСА у всех пациентов снизился в среднем на 87% от исходного.
Отмеченные в ходе исследования побочные реакции проявились в ожидаемых явлениях дизурии 1-й степени по классификации RTOG/EORTC. Только у 1 (2,7%) из 36 пациентов через 1 мес после брахитерапии возникла острая задержка мочи, потребовавшая катетеризации мочевого пузыря; полностью восстановить мочеиспускание этому пациенту удалось консервативными методами. Проявлений гастроинтестинальной токсичности в группе пролеченных пациентов зарегистрировано не было. Наблюдение за пациентами продолжается с целью получения отдаленных результатов лечения.
Клинические испытания микроисточников продемонстрировали их безопасность для пациентов и медицинского персонала, что было доказано проведением дозиметрического контроля во время самой процедуры, а также при обследовании пациентов после проведения брахитерапии. Клиническая эффективность отечественных микроисточников I-125 при проведении низкомощностной брахитерапии демонстрируется снижением уровня ПСА от исходного на 87% в срок наблюдения 6 мес.
Заключение. Данные обследований, проведенных пациентам после низкомощностной брахитерапии отечественными микроисточниками I-125, доказывают их клиническую эффективность, безопасность и соответствие отечественных микроисточников I-125 международным стандартам. В настоящее время Национальный медицинский исследовательский радиологический центр Министерства здравоохранения Российской Федерации полностью перешел на выполнение низкомощностной брахитерапии отечественными микроисточниками I-125.


