Введение. Первые попытки производства искусственных заменителей тканей и органов, а также последующей их трансплантации были предприняты в XIX в. [1]. С тех пор тканеинженерные трансплантаты успешно использовались прежде всего в дерматологии, однако были отдельные случаи применения и в других областях медицины [1]. В настоящее время тканевая инженерия широко используется для решения широкого круга медицинских проблем [2]. Ожидания от использования достижений тканевой инженерии зачастую весьма высоки, однако реализованы с ее помощью могут быть пока лишь единичные задачи [3]. Основная идея тканевой инженерии – комплексное использование клеточных технологий и современных биосовместимых материалов для замены или репарации тканей и органов. Интерес урологов к методам тканевой инженерии растет, поскольку до сих пор не было найдено идеального способа восстановления поврежденных органов мочевыделительной системы, в частности мочевого пузыря.
Целью данного обзора является объективное отражение текущих тенденций и достижений в области тканевой инженерии мочевого пузыря с использованием бесклеточных матриц.
С начала XX в. ученые пытаются найти идеальный материал для замещения стенки мочевого пузыря.
В первом опубликованном эксперименте, проведенном на собаках, хирурги использовали мышечную фасцию для замены стенки мочевого пузыря [4].
 В последующем с этой целью применяли множество других материалов, в том числе кусочки кожи, подслизистый слой, сальник, твердую мозговую оболочку, брюшину, плаценту, серозно-мышечные лоскуты и участки подслизистой тонкой кишки [5, 6]. Кроме того, были попытки использовать синтетические материалы – поливиниловые губки, тефлон, желатиновые губки, коллагеновые матрицы, викриловые матрицы, латекс и силикон [7–10].
В последующем с этой целью применяли множество других материалов, в том числе кусочки кожи, подслизистый слой, сальник, твердую мозговую оболочку, брюшину, плаценту, серозно-мышечные лоскуты и участки подслизистой тонкой кишки [5, 6]. Кроме того, были попытки использовать синтетические материалы – поливиниловые губки, тефлон, желатиновые губки, коллагеновые матрицы, викриловые матрицы, латекс и силикон [7–10].
Был проведен систематический поиск доклинических и клинических исследований, проведенных вплоть до июня 2016 г., посвященных тканевой инженерии и реконструкции мочевого пузыря. Информация о потенциально соответствующих тематике исследованиях была получена из электронных баз данных, включая Scopus, Web of Science, PubMed, Embase. Из поиска были исключены публикации не на английском языке. Для поиска использовали ключевые слова для тканевой инженерии и ключевые слова по реконструкции мочевого пузыря; использовали MeSH-термины (PubMed) и EMTREE-термины (EMBASE). Тексты запросов представлены в табл. 1. Списки литературы найденных обзорных статей были проанализированы на предмет наличия недостающих публикаций по теме. Кроме того, был проведен ручной поиск зарегистрированных клинических исследований по данным clinicaltrials.gov.
После удаления дубликатов ссылок с помощью программы EndNoteX5 (Thomson Reuter, США) неподходящие публикации были исключены путем анализа кратких содержаний (абстрактов) по следующим критериям:
- отсутствие названия;
- отсутствие реконструкции мочевого пузыря;
- тканевая инженерия не применялась при создании трансплантатов;
- обзоры, комментарии или редакционные письма.
После этого актуальность исследований для систематического обзора была проанализирована путем оценки полного текста публикации.
Критерии исключения на данном этапе:
- исследования исключительно in vitro;
- отсутствие информации о материале скаффолда, биоактивных веществах или клетках при условии, что они были использованы;
- не проводилась оценка регенерации мочевого пузыря;
- полный текст публикации отсутствует.
Для систематического обзора в итоге было отобрано 77 работ, которые были классифицированы по следующим показателям:
- тип животной модели;
- тип скаффолда;
- тип(ы) клеток;
- методы оценки регенерации мочевого пузыря.
Предметом систематического обзора являются доклинические и клинические исследования продуктов тканевой инженерии для реконструкции стенки мочевого пузыря. На рисунке представлено количество публикаций на каждом этапе отбора статей. Для дальнейшего анализа было отобрано 77 публикаций. Исследования значительно различались по типам животных моделей, материалам подложки, используемым клеткам и факторам роста. Все исследования были разделены на три группы по количеству типов клеток, используемых при создании трансплантата: бесклеточные, с одним и двумя типами клеток. Для более подробного анализа в данном обзоре были выбраны исследования с использованием бесклеточных матриц (табл. 2).

Бесклеточные конструкции являются первыми, наиболее распространенными и самыми простыми тканеинженерными конструкциями. Одним из их основных преимуществ является то, что они в меньшей степени склонны вызывать иммунный ответ реципиента. Более чем в 63% исследований (табл. 2) в качестве матрицы конструкции использовали децеллюляризированные ткани: подслизистую тонкого кишечника, слизистую оболочки полости рта или стенку мочевого пузыря. Тем не менее использование децеллюляризированных матриц связано с некоторыми трудностями: во-первых, ткань до децеллюляризации не должна иметь никаких патологических изменений, во-вторых, заселение матрицы клетками (ни на in vitro моделях, ни in vivo) не повторяет нормальный органогенез [11]. Хотя, согласно опубликованным результатам, мочевые пузыри, реконструированные с помощью децеллюляризированных матриц, функционировали хорошо, данный экспериментальный подход не получил широкого развития.
В других исследованиях в качестве основы для трансплантата применяли синтетические материалы. Наиболее часто используемые из них – коллагеновые губки, поликапролактон, матрицы на основе шелка, а также мембраны из биолатекса. В некоторых in vitro экспериментах исследователи использовали тефлон, полигликолевую кислоты и ее производные, а также силикон [11]. Преимуществом синтетических материалов является возможность полного контроля их механических характеристик. Некоторые из полимеров обладают хорошей клеточной и тканевой совместимостью.
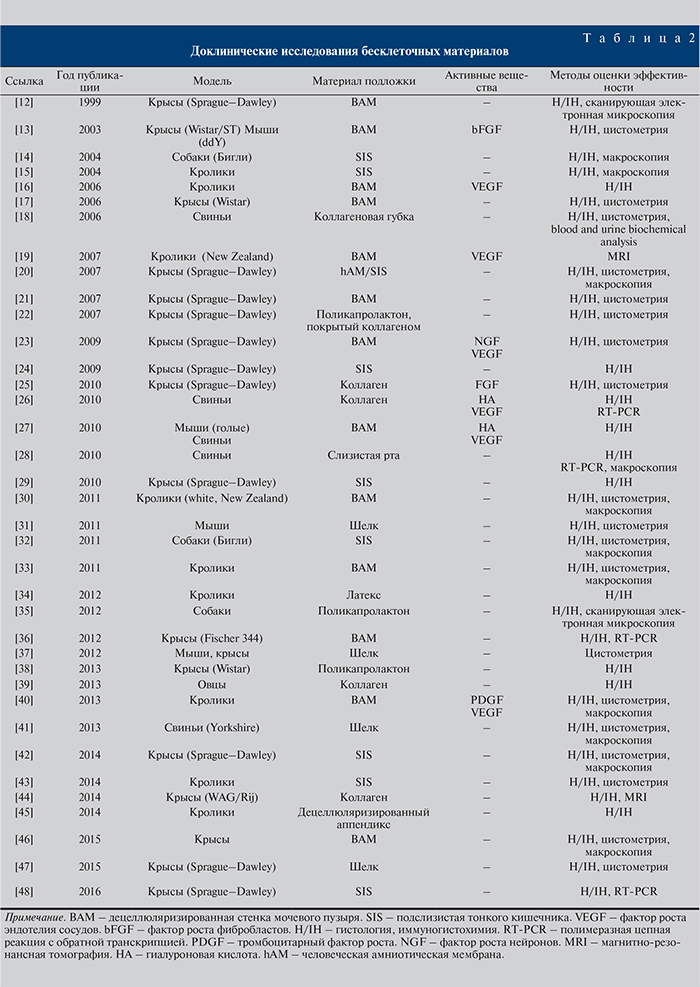
Бесклеточные матрицы также могут быть использованы в качестве носителей различных факторов роста, способных ускорить регенерацию тканей и образование новых сосудов. В исследовании [40] участок стенки мочевого пузыря кролика (4х5 см) был удален и заменен на свиной пузырный децеллюляризированный матрикс (ВАМ – децеллюляризированная стенка мочевого пузыря), по размеру равный изъятому участку. На BAM был иммобилизирован тромбоцитарный фактор роста и фактор роста сосудистого эндотелия. В контрольной группе использовали интактный BAM. Послеоперационная уродинамика у кроликов опытной группы была гораздо лучше, чем у животных контрольной группы. Гистологическое исследование показало, что регенерация гладкой мускулатуры и васкуляризация в опытной группе прошли в значительно большей степени по сравнению с таковыми показателями в контрольной группе (р<0,05), в то время как многослойный уротелий был сформирован в обеих группах в одинаковой степени. Результаты исследования показали, что включение тромбоцитарного фактора роста и VEGF в имплантат стимулирует местный ангиогенез и в целом повышает шанс успешной регенерации.
Восстановления мочевого пузыря удалось добиться при использовании подслизистой тонкого кишечника в качестве матрицы; наиболее впечатляющие результаты получены, если подслизистая была взята из дистальной подвздошной кишки [45]. Превосходство sacculus rotundus по сравнению с другими тканями заключается в его уникальных механических свойствах, связанных с большим содержанием коллагена.
В данном обзоре была проанализирована бо'льшая часть доклинических исследований в области тканевой инженерии мочевого пузыря в период с 2000 по 2016 г. Можно отметить, что интерес исследователей к этой проблеме значительно вырос.
В данном систематическом обзоре были проанализированы исследования с использованием бесклеточных матриц. Последние являются наиболее популярным объектом для эксперимента ввиду простоты их производства и относительно большого опыта использования.
Частичное восстановление уротелиального слоя наблюдалось в большинстве исследований, где бесклеточные трансплантаты были использованы для цистопластики, однако мышечный слой никогда не развивался. Данный факт служит основной причиной использования трансплантатов с клетками в клинической практике. Мочевой пузырь без развитого мышечного слоя не может выполнять большинство важных функций.
Благодарность
Работа выполнена при финансовой поддержке РНФ (проект № 15-15-00132 «Новые фотополимеризующиеся биосовместимые композиции и скаффолды для регенеративной и реконструктивной урологии, создаваемые методом лазерного 3D-принтинга»).


