Введение. К числу перспективных способов восстановления поврежденных органов мочевыделительной системы, в частности мочевого пузыря, относят методы тканевой инженерии. Основная идея тканевой инженерии – комплексное использование клеточных технологий и современных биосовместимых материалов для замены или репарации тканей и органов.
Цель работы – объективное отражение текущих тенденций и достижений в области тканевой инженерии мочевого пузыря с использованием бесклеточных матриц путем проведения систематического поиска доклинических и клинических исследований по интересующей тематике.
Материалы и методы. Информация об исследованиях, включающих методы тканевой инженерии мочевого пузыря,была получена из электронных баз данных, включая Scopus, Web of Science, PubMed, Embase. Списки литературы найденных обзорных статей были проанализированы на предмет наличия недостающих публикаций по теме. Кроме того, был проведен ручной поиск зарегистрированных клинических исследований по данным clinicaltrials.gov.
Результаты и обсуждение. Согласно вышеописанной методике, для дальнейшего анализа было отобрано 77 публикаций. Исследования значительно различались по типам животных моделей, материалам подложки, используемым клеткам и факторам роста. Среди исследований были выбраны те, которые проводились с использованием бесклеточных матриц, для них был проведен более подробный анализ.
Заключение. Частичное восстановление уротелиального слоя наблюдалось в большинстве исследований, где бесклеточные трансплантаты были использованы для цистопластики, однако мышечный слой никогда не развивался. Данный факт является основной причиной, по которой в клинической практике используют, как правило, клеточные тканеинженерные конструкции.
Введение. Первые попытки производства искусственных заменителей тканей и органов, а также последующей их трансплантации были предприняты в XIX в. [1]. С тех пор тканеинженерные трансплантаты успешно использовались прежде всего в дерматологии, однако были отдельные случаи применения и в других областях медицины [1]. В настоящее время тканевая инженерия широко используется для решения широкого круга медицинских проблем [2]. Ожидания от использования достижений тканевой инженерии зачастую весьма высоки, однако реализованы с ее помощью могут быть пока лишь единичные задачи [3]. Основная идея тканевой инженерии – комплексное использование клеточных технологий и современных биосовместимых материалов для замены или репарации тканей и органов. Интерес урологов к методам тканевой инженерии растет, поскольку до сих пор не было найдено идеального способа восстановления поврежденных органов мочевыделительной системы, в частности мочевого пузыря.
Целью данного обзора является объективное отражение текущих тенденций и достижений в области тканевой инженерии мочевого пузыря с использованием бесклеточных матриц.
С начала XX в. ученые пытаются найти идеальный материал для замещения стенки мочевого пузыря.
В первом опубликованном эксперименте, проведенном на собаках, хирурги использовали мышечную фасцию для замены стенки мочевого пузыря [4].
 В последующем с этой целью применяли множество других материалов, в том числе кусочки кожи, подслизистый слой, сальник, твердую мозговую оболочку, брюшину, плаценту, серозно-мышечные лоскуты и участки подслизистой тонкой кишки [5, 6]. Кроме того, были попытки использовать синтетические материалы – поливиниловые губки, тефлон, желатиновые губки, коллагеновые матрицы, викриловые матрицы, латекс и силикон [7–10].
В последующем с этой целью применяли множество других материалов, в том числе кусочки кожи, подслизистый слой, сальник, твердую мозговую оболочку, брюшину, плаценту, серозно-мышечные лоскуты и участки подслизистой тонкой кишки [5, 6]. Кроме того, были попытки использовать синтетические материалы – поливиниловые губки, тефлон, желатиновые губки, коллагеновые матрицы, викриловые матрицы, латекс и силикон [7–10].
Был проведен систематический поиск доклинических и клинических исследований, проведенных вплоть до июня 2016 г., посвященных тканевой инженерии и реконструкции мочевого пузыря. Информация о потенциально соответствующих тематике исследованиях была получена из электронных баз данных, включая Scopus, Web of Science, PubMed, Embase. Из поиска были исключены публикации не на английском языке. Для поиска использовали ключевые слова для тканевой инженерии и ключевые слова по реконструкции мочевого пузыря; использовали MeSH-термины (PubMed) и EMTREE-термины (EMBASE). Тексты запросов представлены в табл. 1. Списки литературы найденных обзорных статей были проанализированы на предмет наличия недостающих публикаций по теме. Кроме того, был проведен ручной поиск зарегистрированных клинических исследований по данным clinicaltrials.gov.
После удаления дубликатов ссылок с помощью программы EndNoteX5 (Thomson Reuter, США) неподходящие публикации были исключены путем анализа кратких содержаний (абстрактов) по следующим критериям:
- отсутствие названия;
- отсутствие реконструкции мочевого пузыря;
- тканевая инженерия не применялась при создании трансплантатов;
- обзоры, комментарии или редакционные письма.
После этого актуальность исследований для систематического обзора была проанализирована путем оценки полного текста публикации.
Критерии исключения на данном этапе:
- исследования исключительно in vitro;
- отсутствие информации о материале скаффолда, биоактивных веществах или клетках при условии, что они были использованы;
- не проводилась оценка регенерации мочевого пузыря;
- полный текст публикации отсутствует.
Для систематического обзора в итоге было отобрано 77 работ, которые были классифицированы по следующим показателям:
- тип животной модели;
- тип скаффолда;
- тип(ы) клеток;
- методы оценки регенерации мочевого пузыря.
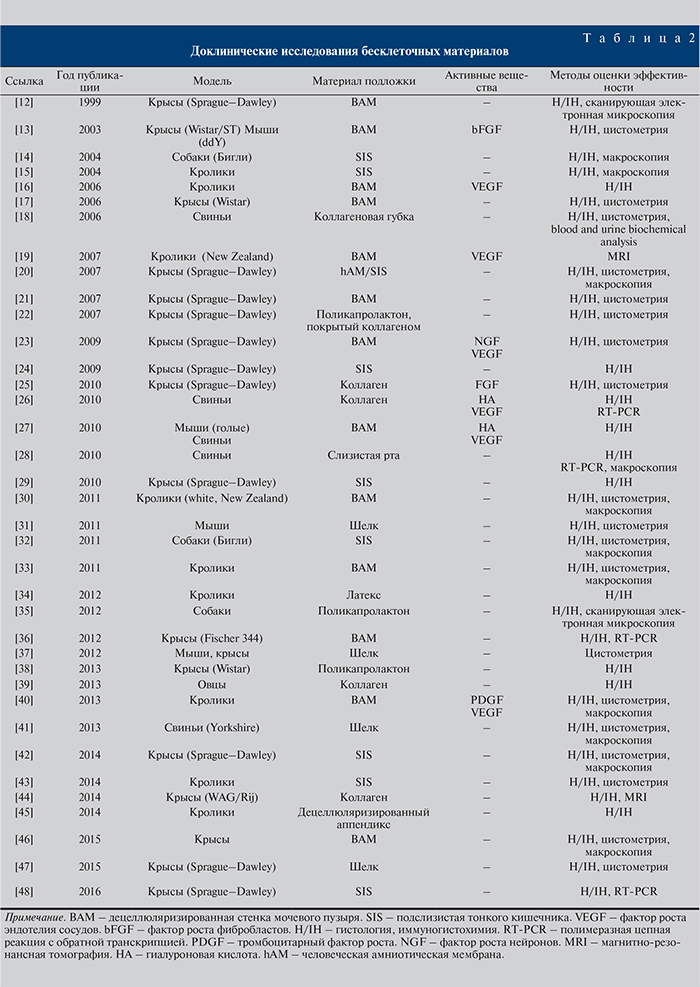
Предметом систематического обзора являются доклинические и клинические исследования продуктов тканевой инженерии для реконструкции стенки мочевого пузыря. На рисунке представлено количество публикаций на каждом этапе отбора статей. Для дальнейшего анализа было отобрано 77 публикаций. Исследования значительно различались по типам животных моделей, материалам подложки, используемым клеткам и факторам роста. Все исследования были разделены на три группы по количеству типов клеток, используемых при создании трансплантата: бесклеточные, с одним и двумя типами клеток. Для более подробного анализа в данном обзоре были выбраны исследования с использованием бесклеточных матриц (табл. 2).

Бесклеточные конструкции являются первыми, наиболее распространенными и самыми простыми тканеинженерными конструкциями. Одним из их основных преимуществ является то, что они в меньшей степени склонны вызывать иммунный ответ реципиента. Более чем в 63% исследований (табл. 2) в качестве матрицы конструкции использовали децеллюляризированные ткани: подслизистую тонкого кишечника, слизистую оболочки полости рта или стенку мочевого пузыря. Тем не менее использование децеллюляризированных матриц связано с некоторыми трудностями: во-первых, ткань до децеллюляризации не должна иметь никаких патологических изменений, во-вторых, заселение матрицы клетками (ни на in vitro моделях, ни in vivo) не повторяет нормальный органогенез [11]. Хотя, согласно опубликованным результатам, мочевые пузыри, реконструированные с помощью децеллюляризированных матриц, функционировали хорошо, данный экспериментальный подход не получил широкого развития.
В других исследованиях в качестве основы для трансплантата применяли синтетические материалы. Наиболее часто используемые из них – коллагеновые губки, поликапролактон, матрицы на основе шелка, а также мембраны из биолатекса. В некоторых in vitro экспериментах исследователи использовали тефлон, полигликолевую кислоты и ее производные, а также силикон [11]. Преимуществом синтетических материалов является возможность полного контроля их механических характеристик. Некоторые из полимеров обладают хорошей клеточной и тканевой совместимостью.
Бесклеточные матрицы также могут быть использованы в качестве носителей различных факторов роста, способных ускорить регенерацию тканей и образование новых сосудов. В исследовании [40] участок стенки мочевого пузыря кролика (4х5 см) был удален и заменен на свиной пузырный децеллюляризированный матрикс (ВАМ – децеллюляризированная стенка мочевого пузыря), по размеру равный изъятому участку. На BAM был иммобилизирован тромбоцитарный фактор роста и фактор роста сосудистого эндотелия. В контрольной группе использовали интактный BAM. Послеоперационная уродинамика у кроликов опытной группы была гораздо лучше, чем у животных контрольной группы. Гистологическое исследование показало, что регенерация гладкой мускулатуры и васкуляризация в опытной группе прошли в значительно большей степени по сравнению с таковыми показателями в контрольной группе (р<0,05), в то время как многослойный уротелий был сформирован в обеих группах в одинаковой степени. Результаты исследования показали, что включение тромбоцитарного фактора роста и VEGF в имплантат стимулирует местный ангиогенез и в целом повышает шанс успешной регенерации.
Восстановления мочевого пузыря удалось добиться при использовании подслизистой тонкого кишечника в качестве матрицы; наиболее впечатляющие результаты получены, если подслизистая была взята из дистальной подвздошной кишки [45]. Превосходство sacculus rotundus по сравнению с другими тканями заключается в его уникальных механических свойствах, связанных с большим содержанием коллагена.
В данном обзоре была проанализирована бо'льшая часть доклинических исследований в области тканевой инженерии мочевого пузыря в период с 2000 по 2016 г. Можно отметить, что интерес исследователей к этой проблеме значительно вырос.
В данном систематическом обзоре были проанализированы исследования с использованием бесклеточных матриц. Последние являются наиболее популярным объектом для эксперимента ввиду простоты их производства и относительно большого опыта использования.
Частичное восстановление уротелиального слоя наблюдалось в большинстве исследований, где бесклеточные трансплантаты были использованы для цистопластики, однако мышечный слой никогда не развивался. Данный факт служит основной причиной использования трансплантатов с клетками в клинической практике. Мочевой пузырь без развитого мышечного слоя не может выполнять большинство важных функций.
Благодарность
Работа выполнена при финансовой поддержке РНФ (проект № 15-15-00132 «Новые фотополимеризующиеся биосовместимые композиции и скаффолды для регенеративной и реконструктивной урологии, создаваемые методом лазерного 3D-принтинга»).
1. Kramer-Schultheiss K.S., Schultheiss D. From wound healing to modern tissue engineering of the skin. A historical review on early techniques of cell and tissue culture. Hautarzt. 2002;53(11):751–760. Doi: 10.1007/s00105-002-0445-6. PubMed PMID: 12402139.
2. Atala A. Recent developments in tissue engineering and regenerative medicine. Curr Opin Pediatr. 2006;18(2):167–71. Doi: 10.1097/01.mop.0000193294.94646.be. PubMed PMID: 16601497.
3. Gucciardo L., De Koninck P., Verfaillie C., Lories R., Deprest J. Perception and knowledge about stem cell and tissue engineering research: a survey amongst researchers and medical practitioners in perinatology. Stem cell reviews. 2014;10(4):447–54. Doi: 10.1007/s12015-014-9506-3. PubMed PMID: 24647632.
4. Neuhof H., Wolf H., Rohtermundt R., Michnacs H. Effect of plasma substitute solutions on oxygen uptake in hemorrhagic shock (animal experiments). Bibliotheca haematologica. 1971;37:313–319.
5. Gleeson M.J., Griffith D.P. The use of alloplastic biomaterials in bladder substitution. The Journal of urology. 1992;148(5):1377–1382.
6. Probst M., Piechota H.J., Hohenfellner M., Gleason C.A., Tanagho E.A. Neurostimulation for bladder evacuation: is sacral root stimulation a substitute for microstimulation? British journal of urology. 1997;79(4):554–566.
7. Fujita K. The use of resin-sprayed thin paper for urinary bladder regeneration. Investigative urology. 1978;15(5):355–357.
8. Rohrmann D., Albrecht D., Hannappel J., Gerlach R., Schwarzkopp G., Lutzeyer W. Alloplastic replacement of the urinary bladder. The Journal of urology. 1996;156(6):2094–2097.
9. McDougal W.S. Metabolic complications of urinary intestinal diversion. The Journal of urology. 1992;147(5):1199–1208.
10. Soergel T.M., Cain M.P., Misseri R., Gardner T.A., Koch M.O., Rink R.C. Transitional cell carcinoma of the bladder following augmentation cystoplasty for the neuropathic bladder. The Journal of urology. 2004;172(4):1649–1651.
11. Atala A. Tissue engineering of human bladder. British medical bulletin. 2011;97:81–104. doi: 10.1093/bmb/ldr003.
12. Piechota H.J., Gleason C.A., Dahms S.E., Dahiya R., Nunes L.S., Lue T.F., Tanagho E.A. Bladder acellular matrix graft: in vivo functional properties of the regenerated rat bladder. Urological research. 1999;27(3):206–213.
13. Kanematsu A., Yamamoto S., Noguchi T., Ozeki M., Tabata Y., Ogawa O. Bladder regeneration by bladder acellular matrix combined with sustained release of exogenous growth factor. The Journal of urology. 2003;170(4):1633–8. doi: 10.1097/01.ju.0000084021.51099.8a.
14. Kropp B.P., Cheng E.Y., Lin H.K., Zhang Y. Reliable and reproducible bladder regeneration using unseeded distal small intestinal submucosa. The Journal of urology. 2004;172(4):1710–1713.
15. Nuininga J.E., van Moerkerk H., Hanssen A., Hulsbergen C.A., Oosterwijk-Wakka J., Oosterwijk E., de Gier R.P., Schalken J.A., van Kuppevelt T.H., Feitz W.F. A rabbit model to tissue engineer the bladder. Biomaterials. 2004;25(9):1657–1661.
16. Cartwright L., Farhat W.A., Sherman C., Chen J., Babyn P., Yeger H., Cheng H.L. Dynamic contrast-enhanced MRI to quantify VEGF-enhanced tissue-engineered bladder graft neovascularization: pilot study. J Biomed Mater Res A. 2006;77(2):390–5. doi: 10.1002/jbm.a.30648.
17. Obara T., Matsuura S., Narita S., Satoh S., Tsuchiya N., Habuchi T. Bladder acellular matrix grafting regenerates urinary bladder in the spinal cord injury rat. Urology. 2006;68(4):892–7. doi: 10.1016/j.urology.2006.04.030.
18. Hattori K., Joraku A., Miyagawa T., Kawai K., Oyasu R., Akaza H. Bladder reconstruction using a collagen patch prefabricated within the omentum. International Journal of Urology. 2006;13(5):529–37. doi: 10.1111/j.1442-2042.2006.01351.x.
19. Cheng H.L., Wallis C., Shou Z., Farhat W.A. Quantifying angiogenesis in VEGF-enhanced tissue-engineered bladder constructs by dynamic contrast-enhanced MRI using contrast agents of different molecular weights. J Magn Reson Imaging. 2007;25(1):137–45. doi: 10.1002/jmri.20787.
20. Iijima K., Igawa Y., Imamura T., Moriizumi T., Nikaido T., Konishi I., Nishizawa O. Transplantation of preserved human amniotic membrane for bladder augmentation in rats. Tissue engineering. 2007;13(3):513–24. doi: 10.1089/ten.2006.0170.
21. Urakami S., Shiina H., Enokida H., Kawamoto K., Kikuno N., Fandel T., Vejdani K., Nunes L., Igawa M., Tanagho E.A., Dahiya R. Functional improvement in spinal cord injury-induced neurogenic bladder by bladder augmentation using bladder acellular matrix graft in the rat. World journal of urology. 2007;25(2):207–13. doi: 10.1007/s00345-006-0142-7.
22. Yu D.S., Lee C.F., Chen H.I., Chang S.Y. Bladder wall grafting in rats using salt-modified and collagen-coated polycaprolactone scaffolds: preliminary report. International journal of urology : official journal of the Japanese Urological Association. 2007;14(10):939–944. Doi: 10.1111/j.1442-2042.2007.01871.x.
23. Kikuno N., Kawamoto K., Hirata H., Vejdani K., Kawakami K., Fandel T., Nunes L., Urakami S., Shiina H., Igawa M., Tanagho E., Dahiya R. Nerve growth factor combined with vascular endothelial growth factor enhances regeneration of bladder acellular matrix graft in spinal cord injury-induced neurogenic rat bladder. BJU international. 2009;103(10):1424–8. doi: 10.1111/j.1464-410X.2008.08129.x.
24. Roth C.C., Bell C.H., Woodson B., Schultz A.D., Palmer B.W., Frimberger D., Fung K.M., Lin H.K., Kropp B.P. Temporal differentiation and maturation of regenerated rat urothelium. BJU international. 2009;103(6):836–41. Doi: 10.1111/j.1464-410X.2008.08231.x.
25. Chen W., Shi C., Yi S., Chen B., Zhang W., Fang Z., Wei Z., Jiang S., Sun X., Hou X., Xiao Z., Ye G., Dai J. Bladder regeneration by collagen scaffolds with collagen binding human basic fibroblast growth factor. The Journal of urology. 2010;183(6):2432–9. Doi: 10.1016/j.juro.2010.02.042.
26. Evren S., Loai Y., Antoon R., Islam S., Yeger H., Moore K., Wong K., Gorczynski R., Farhat W.A. Urinary bladder tissue engineering using natural scaffolds in a porcine model: role of Toll-like receptors and impact of biomimetic molecules. Cells, tissues, organs. 2010;192(4):250–61. doi: 10.1159/000317332.
27. Loai Y., Yeger H., Coz C., Antoon R., Islam S.S., Moore K., Farhat W.A. Bladder tissue engineering: tissue regeneration and neovascularization of HA-VEGF-incorporated bladder acellular constructs in mouse and porcine animal models. Journal of biomedical materials research Part A. 2010;94(4):1205–15. Doi: 10.1002/jbm.a.32777.
28. Lu M., Zhou G., Liu W., Wang Z., Zhu Y., Yu B., Zhang W., Cao Y. Remodeling of buccal mucosa by bladder microenvironment. Urology. 2010;75(6):1514.e7–14. doi: 10.1016/j.urology.2009.12.060.
29. Ashley R.A., Roth C.C., Palmer B.W., Kibar Y., Routh J.C., Fung K.M., Frimberger D., Lin H.K., Kropp B.P. Regional variations in small intestinal submucosa evoke differences in inflammation with subsequent impact on tissue regeneration in the rat bladder augmentation model. BJU International. 2010;105(10):1462–1468. Doi: 10.1111/j.1464-410X.2009.08965.x.
30. Eberli D., Atala A., Yoo J.J. One and four layer acellular bladder matrix for fascial tissue reconstruction. Journal of materials science Materials in medicine. 2011;22(3):741–51. doi: 10.1007/s10856-011-4242-6.
31. Gomez P. 3rd1, Gil E.S., Lovett M.L., Rockwood D.N., Di Vizio D., Kaplan D.L., Adam R.M., Estrada C.R. Jr., Mauney J.R. The effect of manipulation of silk scaffold fabrication parameters on matrix performance in a murine model of bladder augmentation. Biomaterials. 2011;32(30):7562–70. Doi: 10.1016/j.biomaterials. 2011.06.067.
32. Roth C.C., Mondalek F.G., Kibar Y., Ashley R.A., Bell C.H., Califano J.A., Madihally S.V., Frimberger D., Lin H.K., Kropp B.P. Bladder regeneration in a canine model using hyaluronic acid-poly(lactic-co-glycolic-acid) nanoparticle modified porcine small intestinal submucosa. BJU international. 2011;108(1):148–1455. Doi: 10.1111/j.1464-410X.2010.09757.x.
33. Zhu W.D., Xu Y.M., Feng C., Fu Q., Song L.J. Different bladder defects reconstructed with bladder acellular matrix grafts in a rabbit model. Urologe – Ausgabe A. 2011;50(11):1420–5. doi: 10.1007/s00120-011-2627-2.
34. Domingos A.L.A., Garcia S.B., de Bessa J., Cassini M.F., Molina C.A.F., Junior S.T. Expression of VEGF and collagen using a latex biomembrane as bladder replacement in rabbits. International Braz J Urol. 2012;38(4):536–543. Doi: 10.1590/S1677-55382012000400014.
35. Shakhssalim N., Dehghan M.M., Moghadasali R., Soltani M.H., Shabani I., Soleimani M. Bladder tissue engineering using biocompatible nanofibrous electrospun constructs: feasibility and safety investigation. Urology J. 2012;9(1):410–419.
36. Thangappan R., Eandi J.A., Modi J., Kurzrock E.A. Epithelium-free bladder wall graft: Epithelial ingrowth and regeneration-clinical implications for partial cystectomy. J Urology. 2012;187(4):1450–1457. Doi: 10.1016/j.juro.2011.12.014.
37. Tu D.D., Seth A., Gil E.S., Kaplan D.L., Mauney J.R., Estrada Jr C.R. Evaluation of biomaterials for bladder augmentation using cystometric analyses in various rodent models. Journal of visualized experiments : JoVE. 2012;66.
38. Del Gaudio C., Vianello A., Bellezza G., Maulà V., Sidoni A., Zucchi A., Bianco A., Porena M. Evaluation of electrospun bioresorbable scaffolds for tissue-engineered urinary bladder augmentation. Biomedical materials (Bristol, England). 2013;8(4):045013. Doi: 10.1088/1748-6041/8/4/045013.
39. Roelofs L.A., Kortmann B.B., Oosterwijk E., Eggink A.J., Tiemessen D.M., Crevels A.J., Wijnen R.M., Daamen W.F., van Kuppevelt T.H., Geutjes P.J., Feitz W.F. Tissue engineering of diseased bladder using a collagen scaffold in a bladder exstrophy model. BJU international. 2014;114(3):447–457.
40. Zhou L., Yang B., Sun C., Qiu X., Sun Z., Chen Y., Zhang Y., Dai Y. Coadministration of platelet-derived growth factor-BB and vascular endothelial growth factor with bladder acellular matrix enhances smooth muscle regeneration and vascularization for bladder augmentation in a rabbit model. Tissue engineering Part A. 2013;19(1–2):264–276. Doi: 10.1089/ten.TEA.2011.0609.
41. Tu D.D., Chung Y.G., Gil E.S., Seth A., Franck D., Cristofaro V., Sullivan M.P., Di Vizio D., Gomez P. 3rd, Adam R.M., Kaplan D.L., Estrada C.R. Jr, Mauney J.R. Bladder tissue regeneration using acellular bi-layer silk scaffolds in a large animal model of augmentation cystoplasty. Biomaterials. 2013;34(34):8681–8689. Doi: 10.1016/j.biomaterials.2013.08.001.
42. Chung Y.G., Algarrahi K., Franck D., Tu D.D., Adam R.M., Kaplan D.L., Estrada C.R. Jr, Mauney J.R. The use of bi-layer silk fibroin scaffolds and small intestinal submucosa matrices to support bladder tissue regeneration in a rat model of spinal cord injury. Biomaterials. 2014;35(26):7452–7459. doi: 10.1016/j.biomaterials.2014.05.044.
43. Wang Y., Liao L. Histologic and functional outcomes of small intestine submucosa-regenerated bladder tissue. BMC urology. 2014;14:69. Doi: 10.1186/1471-2490-14-69.
44. Sun Y., Geutjes P., Oosterwijk E., Heerschap A. In vivo magnetic resonance imaging of type I collagen scaffold in rat: improving visualization of bladder and subcutaneous implants. Tissue engineering Part C, Methods. 2014;20(12):964–71. Doi: 10.1089/ten.TEC.2014.0046.
45. Sabetkish N., Kajbafzadeh A.M., Sabetkish S., Tavangar S.M. Augmentation cystoplasty using decellularized vermiform appendix in rabbit model. Journal of pediatric surgery. 2014;49(3):477–483. doi: 10.1016/j.jpedsurg.2013.07.016.
46. Horst M., Milleret V., Noetzli S., Gobet R., Sulser T., Eberli D. Polyesterurethane and acellular matrix based hybrid biomaterial for bladder engineering. Journal of biomedical materials research Part B, Applied biomaterials. 2015. doi: 10.1002/jbm.b.33591.
47. Zhao Y., He Y., Zhou Z., Guo J.H., Wu J.S., Zhang M., Li W., Zhou J., Xiao D.D., Wang Z., Sun K., Zhu Y.J., Lu M.J. Time-dependent bladder tissue regeneration using bilayer bladder acellular matrix graft-silk fibroin scaffolds in a rat bladder augmentation model. Acta biomaterialia. 2015;23:91–102. Doi: 10.1016/j.actbio. 2015.05.032.
48. Kajbafzadeh A.M., Khorramirouz R., Sabetkish S., Ataei Talebi M., Akbarzadeh A., Keihani S. In vivo regeneration of bladder muscular wall using decellularized colon matrix: an experimental study. Pediatric surgery international. 2016. Doi: 10.1007/s00383-016-3871-8.
А в т о р д л я с в я з и: А. А. Чапленко – эксперт лаборатории биомедицинских клеточных продуктов ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России, Москва, Россия; e-mail:
 В последующем с этой целью применяли множество других материалов, в том числе кусочки кожи, подслизистый слой, сальник, твердую мозговую оболочку, брюшину, плаценту, серозно-мышечные лоскуты и участки подслизистой тонкой кишки [5, 6]. Кроме того, были попытки использовать синтетические материалы – поливиниловые губки, тефлон, желатиновые губки, коллагеновые матрицы, викриловые матрицы, латекс и силикон [7–10].
В последующем с этой целью применяли множество других материалов, в том числе кусочки кожи, подслизистый слой, сальник, твердую мозговую оболочку, брюшину, плаценту, серозно-мышечные лоскуты и участки подслизистой тонкой кишки [5, 6]. Кроме того, были попытки использовать синтетические материалы – поливиниловые губки, тефлон, желатиновые губки, коллагеновые матрицы, викриловые матрицы, латекс и силикон [7–10].




