С возрастом значительно увеличивается число больных с различными расстройствами функции нижних мочевыводящих путей (НМП), особенно с гиперактивным мочевым пузырем (ГМП) [1, 2]. В соответствии с классификацией, предложенной Международным обществом по удержанию мочи (International Continence Society, ICS), выделяют следующие группы симптомов нарушения функции НМП: накопления, опорожнения и симптомы после опорожнения [3]. Симптомы нижних мочевыводящих путей (СНМП) у мужчин чаще всего обусловлены механической обструкцией. Кроме того, расстройства мочеиспускания связаны с гиперактивностью гладкомышечных клеток стенки мочевого пузыря, что приводит к постоянному или периодическому их гипертонусу.
В то время как механическая обструкция вызывает главным образом обструктивную симптоматику, гиперактивностью детрузора объясняются симптомы наполнения. Более того, достаточно выраженные симптомы НМП (СНМП) могут встречаться и без существенной механической обструкции. У большинства пациентов расстройства мочеиспускания обусловлены как механическим, так и функциональным фактором. Острая задержка мочи представляет собой крайнее проявление СНМП. Риск развития острой задержки мочи увеличивается с возрастом. Хотя инфравезикальная обструкция (ИВО) вследствие доброкачественной гиперплазии предстательной железы (ДГПЖ) остается наиболее частой причиной расстройств мочеиспускания у пожилых мужчин, СНМП могут наблюдаться и при других заболеваниях. По данным Chapple C.R. [4], у 49% мужчин с СНМП выявляются симптомы как опорожнения, так и накопления. До 80% пациентов с выраженной формой ИВО страдают гиперактивность детрузора, которая отмечается в 2 раза чаще, чем у пациентов без ИВО.
У большинства мужчин с СНМП наблюдается комбинация симптомов различных типов. Результаты опроса EpiLUTS в США, Великобритании и Швеции [5] показали, что СНМП, связанные с накоплением мочи, опорожнением мочевого пузыря и возникающие после мочеиспускания, у пациентов часто наблюдаются одновременно. Кроме того, нейрогенные нарушения, ятрогенные факторы и вмешательства на предстательной железе могут также стать причиной развития симптомов наполнения и/или опорожнения.
В работе Казилова Ю.Б. [6] была изучена распространенность различных нарушений мочеиспускания у жителей Республики Дагестан. Частью этой работы стало изучение данной проблемы в отношении мужского населения – проведено анонимное анкетирование (по собственно разработанной анкете) 584 жителей (из них 264 мужчины) различных регионов Республики Дагестан на предмет наличия тех или иных расстройств мочеиспускания, а также анкетирование 136 урологов, работающих в Республике Дагестан и других субъектах Северо-Кавказского и Южного Федеральных округов, на предмет особенностей диагностики и лечения различных СНМП, включая больных ДГПЖ. Согласно данным опроса жителей Республики Дагестан, те или иные нарушения мочеиспускания имели место у 371 (63,5%) опрошенного, из них у 163 (61,7%) мужчин (табл. 1).
Достоверное уменьшение числа холинергических рецепторов при гиперактивном детрузоре было показано J. Restоrick, A. Mundy [7]. В ряде других исследований было продемонстрировано уменьшение плотности холинергических нервов в случае обструктивного детрузора. Уменьшение количества адренергических нервов также представляется возможным. По-видимому, гиперактивность детрузора при обструкции связана с изменениями как бета-, так и альфа1-типа адренорецепторов [8]. Причина гиперактивности детрузора служит типичным примером постсинаптической денервационной гиперчувствительности. Гиперактивный мочевой пузырь отмечается у 52–80% мужчин с ИВО вследствие ДГПЖ, а у 38% мужчин с ИВО вследствие ДГПЖ симптомы ГМП сохраняются после оперативного устранения обструкции [9, 10].
Таким образом, имеет место высокая распространенность СНМП, особенно комбинированных, среди мужчин, причем частота симптомов опорожнения преобладает над частотой симптомов наполнения. Гиперактивность детрузора может быть обусловлена и наличием ИВО, а также существовать и без ИВО. Несмотря на противоречивость данных, следует признать, что как возраст, так и ИВО могут приводить к постсинаптической денервации мочевого пузыря. Это обстоятельство еще раз подчеркивает важную роль нервной системы в контроле за накопительной функцией мочевого пузыря.

По данным G.N. Sibley [11], инфравезикальная обструкция может вызывать гиперактивность детрузора вследствие холинергической денервации детрузора и последовательной гиперчувтсвительности мускариновых рецепторов к ацетилхолину. Некоторые работы отображают тот факт, что роль М2-холинорецепторов может быть более резко выраженной с возрастом [12]. Возрастные изменения, которые могут способствовать развитию гиперактивности детрузора, выражаются в увеличении протрузии межклеточных соединений, что может нарушать электрическую активность между клетками гладкой мускулатуры. Изменения в немиелинизированных, капсаицин-чувствительных С-афферентных волокнах могут вызывать ургентный позыв при небольшом объеме мочевого пузыря. Комбинация этих факторов, часто существующих одновременно с изменениями в центральной нервной системе, могут играть ключевую роль в развитии гиперактивности детрузора [13]. Физиологическое старение ассоциируется со снижением способности тканей к восстановлению (репарации), уменьшением их эластичности, повышенной жировой инфильтрацией, клеточной атрофией, дегенерацией нервных окончаний, снижением тонуса гладкой мускулатуры, уменьшением количества коллагеновых волокон в соединительной ткани связочного аппарата, истончением уретрального эпителия, ухудшением кровоснабжения уретры. Возрастные изменения мочевого пузыря, вероятнее всего, связана с развитием гипоксии. Развившаяся тканевая гипоксия определяет многие функциональные изменения в стареющем организме [14].
Окончательный диагноз пациентам с СНМП должен быть поставлен только по результатам тщательного обследования. Для установления причины нарушений мочеиспускания до и после оперативного лечения по поводу ДГПЖ считаем необходимым выполнение комбинированного уродинамического обследования. Только при таком подходе можно выявить особенности нарушения функции НМП и истинную причину нарушения их функции, что имеет исключительное значение для прогноза болезни и определения оптимальной тактики лечения. Уродинамическое обследование больных по поводу неудовлетворительных результатов оперативного лечения позволяет определить причину нарушенного оттока мочи из мочевого пузыря. Точная диагностика особенностей и причин нарушения функции НМП у таких больных помогает в выборе адекватной лечебной тактики.
По данным Гаджиевой З.К. (2009) [15] 206 пациентам с различными обструктивными заболеваниями НМП были проведены комбинированные уродинамические исследования с целью оценки функционального состояния НМП – 128 пациентам ДГПЖ, 26 – раком простаты, 41 – стриктурой уретры, 11 – деформацией шейки мочевого пузыря. Обработаны результаты 64 уродинамических исследований пациентов после трансуретральной операции по поводу обструктивных заболеваний НМП с осложненным послеоперационным периодом в виде задержки мочи или большим количеством остаточной мочи [15]. У 120 (58,25%) больных при комбинированном уродинамическом исследовании выявлена гиперактивность детрузора. Средняя длительность жалоб у пациентов с гиперактивностью детрузора составила 5,34 года. Максимальный цистометрический объем мочевого пузыря у пациентов с ГМП составил 183,59 мл, а среднее колебание детрузорного давления – 73,44 см водн.ст. У 56 (27,2%) пациентов выявлен уретерогидронефроз, из них у 37 – двусторонний, у 19 – односторонний. По нашему мнению, основной причиной уретерогидронефроза у 31 (55,3%) пациента могла стать выявленная гиперактивность детрузора, у 11 (19,6%) – выраженное повышение комплаенса детрузора, у 7 (12,5%) – снижение комплаенса детрузора. У 7 (12,5%) пациентов при наличии нарушения уродинамики верхних мочевыводящих путей констатирован нормальный комплаенс детрузора. Средняя длительность заболевания у пациентов с уретерогидронефрозом составила 6,6 года. Пузырно-мочеточниковый рефлюкс (ПМР) при антеградной цистографии выявлен у 37 (17,9%) пациентов, ХПН – у 19 (9,2%). С нашей точки зрения, ПМР у 29 (78,4%) пациентов стал следствием выраженного нарушения уродинамики мочевого пузыря по типу гиперактивности детрузора. Средняя длительность заболевания у пациентов с ПМР составила 4,57 года, а среднее колебание детрузорного давления – 51,18 см водн.ст. У 15 пациентов расширение верхних мочевыводящих путей сочеталось с ПМР. В этой группе больных в ходе уродинамического исследования у 8 выявлена гиперактивность детрузора. Таким образом, с увеличением длительности ИВО, снижением комплаенса детрузора, появлением его гиперактивности, увеличением амплитуды сокращений детрузора в момент некоординированного сокращения усугубляется и состояние верхних мочевыводящих путей – от ПМР до уретерогидронефроза и ХПН [15]. Наиболее часто при уродинамическом исследовании выявлялась гиперактивность детрузора (58,25% больных), которая, возможно, была следствием ИВО и последующей ишемии мочевого пузыря. Эта дисфункция мочевого пузыря могла быть основным ведущим звеном в развитии осложнений ИВО, а именно пузырно-мочеточникового рефлюкса, уретерогидронефроза и как следствие – выраженного нарушения уродинамики верхних мочевыводящих путей – хронической почечной недостаточности.

Таким образом, полученные данные в представленной выше работе [15] соответствуют функциональной классификации ИВО, отражающей степень не только нарушения функции мочевого пузыря, но и изменения уродинамики верхних мочевыводящих путей и функциональной способности почек [16].
По данным P. Abrams (1985), из 100 больных инфравезикальной обструкцией только у 63% наблюдается нивелирование гиперактивного детрузора в стабильный после простатэктомии [17]. Прогнозировать исчезновение или сохранение гиперактивности детрузора после операции у больных ДГПЖ достаточно сложно [18]. В связи с этим комплексное исследование уродинамики нижних мочевыводящих путей показано всем больным с клиническими симптомами гиперактивного детрузора для выявления ее причины и установления взаимосвязи с обструктивным процессом в пузырно-уретральном сегменте.
При обработке данных 64 уродинамических исследований пациентов после трансуретральной операции по поводу обструктивных заболеваний НМП с осложненным послеоперационным периодом в виде задержки мочи или большим количеством остаточной мочи, а также с частыми позывами на мочеиспускание получены следующие данные [15]. У 30 (46,9%) прооперированных функциональное состояние НМП выражалось в виде гиперактивности детрузора, у – 19 (29,7%) в виде повышения комплаенса детрузора, у 15 (23,4%) – в виде снижения комплаенса детрузора. У 13 (20%) пациентов диагностирована ИВО, что потребовало диагностической уретероцистоскопии. Из них в 8 наблюдениях механическая обструкция выявлена не была. Скорее всего, в данном случае проявился динамический компонент ИВО за счет активности адренергической системы. Процент пациентов, у которых после операции продолжал иметь место динамический компонент инфравезикальной обструкции, составил 12,5%. Именно этот факт может говорить в пользу необходимости использования α-адреноблокаторов в послеоперационном периоде.

Своевременное выявление характера уродинамических нарушений, в первую очередь инфравезикальной обструкции и гиперактивности детрузора, у больных ДГПЖ имеет важное практическое значение, так как без учета этого фактора существенно ухудшаются функциональные результаты хирургического лечения.
До 50% пациентов после ТУР назначается медикаментозная терапия СНМП – в основном М-холиноблокаторы, что связано с выраженными симптомами гиперактивного мочевого пузыря [19]. По данным Herrera-Muñoz J.A. и соавторов (2016) [20], 30,4% пациентов получали медикаментозную терапию СНМП после ТУР. Антихолинергические препараты были наиболее часто назначаемыми. Адекватный отбор пациентов на дооперационном этапе будет снижать частоту развития осложнений и риск для дополнительного лечения после операции [20].
Следует отметить, что благодаря появлению новых фармакологических препаратов сегодня стало возможно осуществлять консервативное лечение урологической патологии в тех случаях, которые еще десять лет назад неизменно ассоциировались с хирургическим вмешательством. С другой стороны, это обстоятельство потребовало более глубоких знаний физиологии и патофизиологии мочевыводящих путей.
Наиболее часто применяемыми в урологической практике α1-адреноблокаторами (α1-АБ) – препаратами первой линии в лечении нижних мочевыводящих путей у мужчин – являются (оригинальные препараты): тамсулозин, теразозин, доксазозин, альфузозин и силодозин (Урорек) [21, 22]. Многие непрямые сравнения плацебо-контролируемых исследований, так же как и не столь многочисленные прямые сравнительные исследования, продемонстрировали сопоставимую эффективность двух высокоселективных α1-АБ (тамсулозин и силодозин) [23]. С другой стороны, α1-АБ отличаются уроселекивностью и, соответственно, переносимостью: селективный α1-АБ тамсулозин пациенты переносят лучше, чем другие α1-АБ без подтиповой селективности, например доксазозин или теразозин [24], что особенно важно в отношении нежелательных явлений со стороны сердечно-сосудистой системы [25]. Селективная блокада α1A-адренорецепторов может обеспечить эффективное лечение СНМП при ДГПЖ [26]. При наличии селективности в отношении α1A-адренорецепторов препарат будет вызывать меньше побочных эффектов со стороны сердечно-сосудистой системы по сравнению с неселективным препаратом.
В настоящий момент наиболее часто в лечении ГМП применяются препараты, воздействующие на мускариновые рецепторы мочевого пузыря. Является доказанным тот факт, что опосредованная ацетилхолином стимуляция м-холинорецепторов детрузора играет ведущую роль как при нормальных, так и при «нестабильных» сокращениях детрузора [27]. Большинство из этих препаратов вызывает неизбежные нежелательные явления, что обусловливает необходимость поддержания клиницистом баланса между их преимуществами и недостатками.
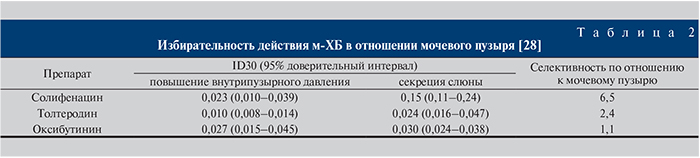
В настоящее время в России используются следующие м-холиноблокаторы (м-ХБ): солифенацин, оксибутинин, троспия хлорид, толтеродин. Наиболее селективным в отношении мочевого пузыря остается солифенацин [28] (табл. 2).
Хорошая переносимость солифенацина пациентами старшей возрастной группы является значимым моментом в выборе данного препарата в лечении ургентных расстройств мочеиспускания, так как подобные пациенты и без того отягощены сопутствующими заболеваниями, что осложняет прием препаратов с большим количеством побочных эффектов [29].
На сегодняшний день подтвержден положительный эффект от увеличения дозировки солифенацина при лечении основных симптомов ГМП и актуализирована необходимость применения 10 мг препарата на старте терапии [30–35].
Согласно рекомендациям Европейской ассоциации урологов (EAU). комбинированная терапия с применением альфа-адреноблокатора и м-холиноблокатора может быть использована в лечении пациентов с умеренными или выраженными СНМП, если при монотерапии любым из указанных препаратов терапевтический эффект был недостаточно выражен [36]. Каковы же основные показания к такой комбинированной терапии? Основными претендентами для подобной схемы лечения считаются мужчины с сочетанием ИВО и персистирующими симптомами ГМП, а также с низким риском возникновения острой задержки мочи, имеющие следующие показатели [37]:
- 5 мл/с<Qmax<15 мл/с);
- частота мочеиспусканий ≥8 за 24 ч;
- ургентные позывы ≥1 за 24 ч с ургентным недержанием мочи или без;
- ноктурия;
- суммарный балл I-PSS≥12;
- QоL-качество жизни ≥3;
- объем остаточной мочи <200 мл;
- отсутствие острой задержки мочи в анамнезе.
В работе Тангриберганова М. Р. (2012) [38] случайная выборка из 300 больных ДГПЖ включила 138 больных с преобладанием ирритативной симптоматики. По данным комплексного уродинамического исследования, у 89 (64,5%) мужчин с ДГПЖ с преобладанием ирритативной симптоматики было подтверждено наличие ГМП. Из них 9 человек, которые получали медикаментозное лечение менее 3 мес или воздержались от последующего выполнения трансуретральной резекции (ТУР) простаты, не вошли в исследование. Таким образом, в исследование включены 80 мужчин с ДГПЖ с преобладанием ирритативной симптоматики ГМП. Данному контингенту пациентов проведена медикаментозная терапия в течение 3 мес с последующим выполнением ТУР предстательной железы. Пациенты были разделены на 2 группы по 40 человек в зависимости от получаемого препарата: – м-ХБ или α1-АБ. У больных ДГПЖ с симптомами ГМП после оперативного лечения симптомы наполнения сохраняются статистически значимо реже при предоперационной терапии м-ХБ, чем при лечении α1-АБ, – 12,5 против 27,5% [38, 39]. В работе Тангриберганова М. Р. (2012) [38] при сопоставлении двух групп больных по степени снижения выраженности симптомов на основании данных дневника мочеиспусканий выявлено, что на фоне приема м-ХБ наблюдается уменьшение проявлений симптомов ГМП в большей степени, чем при терапии α-адренобокатором. При этом статистически значимый характер носили различия по показателям частоты недержания и объема мочи при ургентных позывах (р<0,05). Что касается такого осложнения, как острая задержка мочи, то ни в той, ни в другой группе не было отмечено ни одного случая острой задержки мочи.
В работе Гаджиевой З.К. и соавт. (2016) [40] было выявлено, что наиболее часто пациентам с ДГПЖ урологами Дагестана, других регионов Северо-Кавказского федерального округа (СКФО) и Южного федерального округа (ЮФО) назначаются α-адреноблокаторы, причем чаще оригинальный тамсулозин. Комбинированная терапия СНМП при ДГПЖ α-адреноблокатором с м-ХБ назначается редко (табл. 3).
Причинами, по которым имеет место более редкое использование М-холиноблокаторов в лечении комбинированных СНМП у мужчин в республике Дагестан, могут быть: недостаточная информированность урологов о патогенезе развития СНМП и необходимости применения данного класса препаратов у конкретной группы больных, а также отсутствие аппаратов для выполнения комбинированного уродинамического исследования (на момент анкетирования) и, соответственно, его невыполнение с целью определения функционального состояния нижних мочевыводящих путей, результаты которого помогают в определении тактики лечения.
Комбинированная терапия α1-АБ и м-ХБ показала высокую терапевтическую эффективность для больных ДГПЖ в сочетании с ГМП [41]. На фоне подобного лечения не выявлено существенного увеличения объема остаточной мочи, равно как и развития эпизодов острой задержки мочи [42–47].
Положительный опыт совместного назначения α1-АБ и м-ХБ стал толчком к разработке препарата для лечения комплекса симптомов наполнения (ургентные позывы, учащенное мочеиспускание и возможное наличие ургентного недержания мочи) и симптомов опорожнения у мужчин с ДГПЖ. Везомни 6 мг/0,4 мг является комбинацией селективного антимускаринового препарата солифенацина и селективного α1-АБ тамсулозина в лекарственной форме ОКАС®. Каждая двухслойная таблетка содержит один слой солифенацина сукцината (6 мг), что соответствует 4,5 мг солифенацина, и один слой тамсулозина гидрохлорида (0,4 мг), что соответствует 0,37 мг тамсулозина. Солифенацин подавляет гиперактивность детрузора и уменьшает симптомы, связанные с накоплением мочи, а тамсулозин в форме ОКАС® расслабляет гладкую мускулатуру предстательной железы, капсулы, простатической части мочеиспускательного канала и шейки мочевого пузыря, уменьшает в основном выраженность симптомов опорожнения.
Одной из наиболее интересных публикаций последнего времени стало исследование VICTOR (VESIcare® In Combination With Tamsulosin in OAB Residual Symptoms) – использование Везикара в комбинации с Тамсулозином для лечения остаточных симптомов ГМП [47]. В группе комбинированной терапии по сравнению с терапией тамсулозином в сочетании с плацебо через 12 недель лечения отмечено более выраженное уменьшение количества мочеиспусканий в сутки (1,05 против 0,67) и статистически более значимое снижение количества эпизодов ургентности (2,18 против 1,1).
По данным исследования ASSIST – многоцентрового, двойного слепого рандомизированного плацебо-контролируемого исследования, в котором приняли участие 638 пациентов с СНМП, включая симптомы наполнения, которые сохранялись после ≥6 нед монотерапии тамсулозином 0,2 мг [48]. По результатам исследования при сравнении эффективности 12 нед монотерапии тамсулозином 0,2 мг с применением комбинации солифенацина (2,5 и 5 мг) и тамсулозина 0,2 мг в качестве однокомпонентных препаратов при применении комбинации солифенацина с тамсулозином наблюдалось статистически значимо более выраженное улучшение симптомов наполнения по сравнению с монотерапией тамсулозином.
По данным исследования крупного исследования NEPTUNE [49], в котором изучалось применение комбинации солифенацина и тамсулозина в форме одной таблетки для приема внутрь с системой контролируемого всасывания (Везомни®), комбинация солифенацина 6 мг и тамсулозина ОКАС 0,4 мг отвечала всем заранее установленным в исследовании критериям эффективности, а комбинация солифенацина 9 мг и тамсулозина ОКАС 0,4 мг отвечала критериям эффективности по сравнению с плацебо, но не по сравнению с монотерапией тамсулозином ОКАС 0,4 мг. Применение обеих дозировок солифенацина (6 и 9 мг) в комбинации с тамсулозином ОКАС 0,4 мг в виде одной таблетки вызывало улучшение показателей качества жизни, хорошо переносилось и редко сопровождалось острой задержкой мочи. Авторами был сделан вывод, согласно которому применение препарата Везомни® вызывало статистически значимое уменьшение симптомов наполнения и опорожнения, а также улучшение качества жизни по сравнению с плацебо.
У мужчин с симптомами наполнения и опорожнения мочевого пузыря уменьшение симптомов накопления и улучшение качества жизни при применении данного комбинированного препарата были также статистически значимо более выраженными, чем при монотерапии тамсулозином ОКАС 0,4 мг, и при этом данный комбинированный препарат хорошо переносился [50].
По результатам исследования NEPTUNE II [51], профиль безопасности препарата Везомни® соответствовал таковым солифенацина и тамсулозина ОКАС. Не было выявлено нежелательных явлений, специфичных для указанной комбинации. Наиболее часто встречаемыми нежелательными явлениями были сухость во рту и запор, а степень тяжести большинства побочных реакций была легкой или умеренной. В данном исследовании лишь несколько пациентов прекратили лечение по причине развития нежелательных явлений. Не было получено доказательств повышения риска ОЗМ при применении комбинации солифенацина с тамсулозином ОКАС у мужчин с умеренными или выраженными симптомами, связанными с накоплением мочи (ургентные позывы, учащенное мочеиспускание), и мочеиспусканием, сопровождающим ДГПЖ.
Использование комбинированного препарата в виде одной таблетки по сравнению с использованием двух разных препаратов улучшает приверженность пациентов к лечению, а соответственно, и эффективность проводимой терапии [50]. По данным фармакоэкономических исследований, применение комбинированного препарата Везомни® больными ДГПЖ является ресурсосберегающей альтернативой по сравнению с комбинацией монопрепаратов тамсулозина и солифенацина [52].
Из-за порой выраженных побочных эффектов, в первую очередь при приеме наименее селективных м-ХБ, и низкого комплаенса со стороны пациентов [53] были предприняты попытки разработать новые лекарственные средства. К новому фармакологическому классу препаратов для лечения ГМП, а именно к группе β3-адреномиметиков, относится недавно зарегистрированный в России препарат Мирабегрон.
Мирабегрон производится в форме дозированного высвобождения. Препарат доступен в виде таблеток в дозировке 50 мг для приема 1 раз в день. Мирабегрон высокоселективен в отношении β3-адренорецепторов (β3-АР) подтипа по сравнению с β1- и β2-АР: сродство к β3-АР в 105 раз выше по сравнению с β1-АР, а сродство к β3-АР в 33 раза выше по сравнению с β2-АР [54] (табл. 4). Активация β3-АР стимулирует расслабление детрузора и способствует удержанию мочи, обеспечивая увеличение накопительной емкости мочевого пузыря и интервала между мочеиспусканиями [54]. Мирабегрон не влияет на парасимпатическую регуляцию сокращения детрузора и опорожнения мочевого пузыря, поэтому может снизить риск острой задержки мочи по сравнению с антимускариновыми препаратами [55–58].
Концепция лечения ГМП мирабегроном была подтверждена в исследовании BLOSSOM, опубликованном С. Chapple и соавт. в 2008 г. [59]. Были выявлены значительные преимущества обеих – 100 и 150 мг – доз мирабегрона по сравнению с плацебо и толтеродином в лечении поллакиурии, а также несомненное преимущество мирабегрона перед плацебо в лечении ургентных позывов, недержания мочи и ноктурии. Частота возникновения побочных реакций составляла для мирабегрона 39,2%, плацебо – 36,4%, толтеродина – 48,4%.
В исследовании DRAGON производился поиск оптимальной дозы мирабегрона [60]. Девятьсот девятнадцать больных были распределены в пять групп: плацебо, мирабегрон 25, 50, 100 и 200 мг. Лечение проводилось на протяжении 12 нед. Эффективность доз 50, 100 и 200 мг отличалась незначительно. Именно на основании этого исследования была определена стандартная доза препарата в 50 мг. Частота побочных реакций для мирабегрона не превышала таковую для толтеродина, а частота возникновения сухости во рту была существенно ниже по сравнению с м-ХБ.
Еще одно большое исследование по изучению эффективности мирабегрона ARIES проводилось в США и Канаде [61]. Был выполнен двойной слепой сравнительный анализ эффективности мирабегрона 50 и 100 мг по сравнению с плацебо. В три соответствующие группы были распределены 1328 больных ГМП. По истечении 12 нед во всех группах снизилось число эпизодов недержания мочи (-1,13, -1,47 и -1,63 для плацебо, 50 и 100 мг мирабегрона соответственно) и частого мочеиспускания (-1,05, -1,66 и -1,75, p<0,05).
В исследовании SCORPIO для сравнения эффективности мирабегрона был выбран толтеродин с медленным высвобождением [62]. В это одно из самых крупных исследований были включеноы1978 пациентов с ГМП из Европы и Австралии. Больные были распределены на четыре группы: плацебо (n=494), мирабегрон 50 мг (n=493), 100 мг (n=496), толтеродин медленного высвобождения 4 мг (n=495). Дизайн исследования предполагал лечение в течение 12 нед. Несмотря на значительное улучшение состояния больных по всем симптомам ГМП, преимущества мирабегрона не достигли статистической значимости по сравнению с толтеродином медленного высвобождения. Однако мирабегрон оказался весьма эффективным для больных, ранее получавших холинолитики и прекративших их прием по причине недостаточного действия или выраженных побочных реакций. На фоне приема препарата не было отмечено случаев задержки мочи, регистрировалось существенно меньшее количество эпизодов сухости во рту, запоров и других нежелательных явлений со стороны желудочно-кишечного тракта.
Интересны результаты многоцентрового исследования TAURUS, включившего 2444 пациента из Северной Америки, Европы и других стран [63]. Больные были распределены по четырем группам: плацебо, мирабегрон 50 и 100 мг, толтеродин замедленного высвобождения 4 мг. Прием препаратов продолжался в течение 12 мес. На протяжении года приема мирабегрона наблюдалось стойкое снижение количества эпизодов недержания мочи и мочеиспусканий. И мирабегрон, и холинолитики с одинаковой частотой вызывали такие нежелательные явления, как гипертензия, запоры и головная боль. Исключение составила лишь сухость во рту, которая намного чаще возникала у больных, получавших м-холинолитик. Удлинение QT-интервала на электрокардиограмме при длительном приеме мирабегрона не наблюдалось.
Мирабегрон не противопоказан пациентам с глаукомой и сопоставим с плацебо по воздействию на внутриглазное давление. Частота наличия побочных эффектов со стороны центральной нервной системы в клинических испытаниях сравнима с плацебо: препарат не влияет на когнитивные свойства [58, 64, 65]. На сегодняшний день мирабегрон – первый зарегистрированный препарат альтернативной фармакологической группы, который прошел многочисленные клинические исследования и доказал высокую эффективность в устранении ургентных позывов к мочеиспусканию и недержания мочи, связанного с императивными позывами.
Таким образом, правильная оценка симптоматики со стороны нижних мочевыводящих путей помогает правильно подобрать адекватную медикаментозную терапию с целью нормализации их функции. Из доступного на российском фармацевтическом рынке арсенала медикаментозных препаратов имеется возможность отобрать наиболее селективные представители рекомендуемых классов лекарственных веществ, которые обеспечат высокую эффективность с хорошей переносимостью с минимумом или отсутствием побочных эффектов.


