Введение. Важнейшим этапом при замещении мочеточника или мочевого пузыря кишечным сегментом является формирование мочекишечных анастомозов. Основное требование к создаваемому механизму отведения мочи – сохранение интактных верхних мочевых путей (ВМП) выше места оперативного вмешательства [1, 2]. В настоящее время не вызывает сомнений, что повторяющийся мочеточниково-лоханочный рефлюкс инфицированной мочи, равно как и гидроуретеронефроз, на фоне стриктуры мочеточника являются причиной нарастающего ухудшения функционального состояния ВМП и почек.
Несмотря на значительные успехи, достигнутые в реконструктивно-восстановительной хирургии мочевых путей, до сих пор существуют разногласия в том, является ли антирефлюксный механизм мочеточниково-кишечного анастомоза предпочтительным по сравнению с прямым методом имплантации [3].
В основе методов, позволяющих защищать верхние мочевые пути от ретроградного заброса мочи, лежат два физиологических принципа: ниппельный и клапанный. Первый заключается в создании инвагината (ниппеля) в месте имплантации мочеточника, который, выступая в просвет артифициального мочеточника и мочевого пузыря во время его заполнения, равномерно сдавливается мочой со всех сторон. Второй принцип также строится на законах гидравлики и заключается в формировании тоннеля для дистального участка мочеточника вдоль внутренней стенки трансплантата. В результате накапливающаяся моча сдавливает просвет мочеточника.
На сегодняшний день большинство авторов [4–7], принимая во внимание высокий риск развития стриктуры мочеточника вследствие формирования антирефлюксного механизма, считают лучшей технику прямого мочеточниково-кишечного анастомоза по методу Nesbit. Согласно представленным ими данным, частота стеноза при формировании прямого мочеточниково-кишечного анастомоза значительно ниже, однако в данном случае возрастает риск развития рефлюкса. U. Studer и соавт. [8] cообщают о хорошем функциональном результате использования длинной приводящей недетубуляризированной изоперистальтически расположенной кишечной петли. Их исследования показали, что динамический антирефлюксный механизм афферентного тубулярного сегмента при его достаточной длине надежно защищает ВМП после создания подвздошного резервуара низкого давления.
Материал и методы. В клинике урологии СЗГМУ им И. И. Мечникова заместительная пластика мочеточников кишечными сегментами выполняется с 1998 г., и к декабрю 2016 г. количество таких пациентов достигло 168. Средний возраст составил 51±8,7 года. Мужчин было 76 (45,2%), женщин – 92 (54,8%). У 119 (70,8%) пациентов кишечные сегменты использовались для замещения различных отделов мочеточников (подвздошная – у 92, толстая – у 4, червеобразный отросток – у 23), а у 49 (29,2%) человек уретеропластика сочеталась с ортотопической илеоцистопластикой. Изолированная пластика мочеточников сегментами тонкой и толстой кишки выполнена 96 пациентам. Всем больным проведено комплексное обследование, включившее ультразвуковые, рентгенологические, радиоизотопные и эндоскопические методы диагностики.
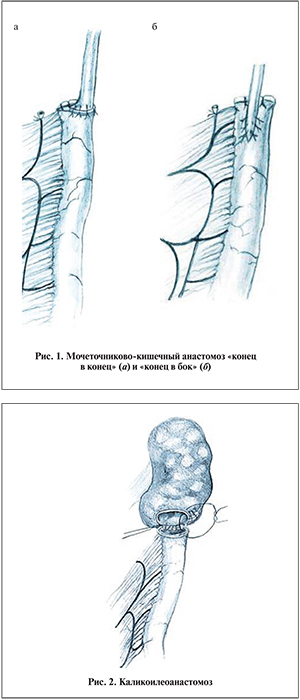 Проксимальные анастомозы можно подразделить на мочеточниково-кишечные, лоханочно-кишечные и чашечно-кишечные. Согласно нашим данным (n=96), их частота составила 89,6%; 9,3 и 1,1% соответственно. Большинство авторов полагают, что анастомоз должен прежде всего обеспечивать полную и свободную проходимость [1, 6, 9]. Мы также основываемся на этой точке зрения, поэтому выполняли прямые мочеточниково-кишечные анастомозы без антирефлюксных методик, по типу «конец в конец» (рис. 1, а) или «конец в бок», в обоих случаях спатулируя мочеточник, если он не расширен (рис. 1, б). Дополнительным и очень важным условием при этом считаем обязательное изоперистальтическое расположение кишечного трансплантата. При гидроуретеронефрозе мочеточниково-кишечный анастомоз чаще производили «конец в конец».
Проксимальные анастомозы можно подразделить на мочеточниково-кишечные, лоханочно-кишечные и чашечно-кишечные. Согласно нашим данным (n=96), их частота составила 89,6%; 9,3 и 1,1% соответственно. Большинство авторов полагают, что анастомоз должен прежде всего обеспечивать полную и свободную проходимость [1, 6, 9]. Мы также основываемся на этой точке зрения, поэтому выполняли прямые мочеточниково-кишечные анастомозы без антирефлюксных методик, по типу «конец в конец» (рис. 1, а) или «конец в бок», в обоих случаях спатулируя мочеточник, если он не расширен (рис. 1, б). Дополнительным и очень важным условием при этом считаем обязательное изоперистальтическое расположение кишечного трансплантата. При гидроуретеронефрозе мочеточниково-кишечный анастомоз чаще производили «конец в конец».
Значительно более сложным является вариант лоханочно-кишечного анастомоза при неувеличенной замурованной в рубцовых тканях лоханке. Надежно его можно произвести только из люмботомического доступа. Следует тщательно и осторожно выделить почку, почечные сосуды и лоханку. Этот этап сложный и длительный. В таких условиях разрез лоханки, необходимый для анастомоза длиной не менее 1–2 см, реально выполнить только по ее передней или задней поверхности. Последний подход менее сложен и опасен, но он неприемлем, так как соединенный с лоханкой по ее задней стенке кишечный сегмент может быть сдавлен между почкой и поясничной мышцей. Остается передний лоханочно-кишечный анастомоз. Для его выполнения необходимо достаточно хорошо выделить переднюю поверхность лоханки, в том числе ее часть, расположенную под губой почки, и сосудистую ножку. Помогает в этом введенный через нефростомическое отверстие, которое всегда имеется в таких случаях, зонд или буж. Особенно сложно осуществлять такой анастомоз при удвоенных почечных сосудах. В редких случаях, при наличии выраженного гидрокаликоза или выраженного рубцово-спаечного процесса, делающего выделение лоханки невозможным, оправданным является каликоилеоанастомоз (рис. 2).
Приводим клиническое наблюдение тотальной кишечной пластики мочеточника с каликоилеоанастомозом у пациентки с единственной почкой.
П а ц и е н т к а Щ. 58 лет поступила в клинику 17.02.16 в плановом порядке с жалобами на отсутствие мочеиспускания, наличие нефростомического дренажа единственной правой почки. Из анамнеза: страдает мочекаменной болезнью с 2009 г., лечилась в одной из городских больниц Дальневосточного региона, где дважды, в 2009 и 2012 гг., выполнялась пиелолитотомия справа с нефростомией.
В 2013 г. там же произведена нефрэктомия слева по поводу коралловидного конкремента и терминального нефросклероза. С тех пор наблюдалась амбулаторно у уролога поликлиники, производилась замена нефростомического дренажа.
При осмотре состояние удовлетворительное, повышенного питания, кожные покровы бледные. Гемодинамика стабильная. Живот мягкий, безболезненный. В поясничной области справа – нефростомическая трубка. Диурез 1500 мл. Показатели клинического и биохимического анализов крови в пределах нормы. Анализ мочи: светло-желтая, удельный вес 1015, лейкоциты 10–30 в поле зрения, эритроциты 10–12 в поле зрения. Выполнена антеградная и ретроградная пиелоуретероилеография, показавшая наличие протяженной стриктуры поясничного отдела правого мочеточника (рис. 3).
Установлен диагноз: мочекаменная болезнь, протяженная стриктура верхней трети мочеточника единственной правой почки, нефростома справа, хронический пиелонефрит, латентная фаза.
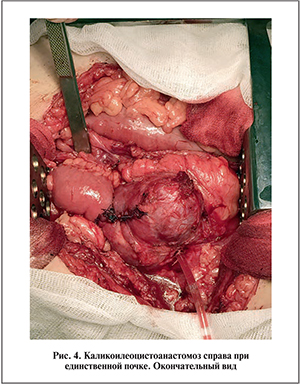
 22.02.16 проведена операция. Из нижнесрединной лапаротомии после вскрытия правого бокового канала выделен правый мочеточник в средней трети. Как в дистальном, так и в проксимальном направлении последний и окружающие его ткани рубцово изменены вплоть до почечной лоханки, что исключает возможность участия ее в формировании надежного анастомоза. С выраженными техническими трудностями выделен нижний полюс правой почки, резецирован в пределах нижней чашечки. Отступя 25 см от илеоцекального угла, взят кишечный сегмент длиной 40 см, ниже его выполнен аппаратный межкишечный анастомоз. На интубаторе сформированы анастомоз трансплантата с нижней чашечкой (рис. 4), а затем кишечно-пузырный анастомоз «конец в бок». Интубатор мочеточника вместе с катетером Фолея выведен по уретре.
22.02.16 проведена операция. Из нижнесрединной лапаротомии после вскрытия правого бокового канала выделен правый мочеточник в средней трети. Как в дистальном, так и в проксимальном направлении последний и окружающие его ткани рубцово изменены вплоть до почечной лоханки, что исключает возможность участия ее в формировании надежного анастомоза. С выраженными техническими трудностями выделен нижний полюс правой почки, резецирован в пределах нижней чашечки. Отступя 25 см от илеоцекального угла, взят кишечный сегмент длиной 40 см, ниже его выполнен аппаратный межкишечный анастомоз. На интубаторе сформированы анастомоз трансплантата с нижней чашечкой (рис. 4), а затем кишечно-пузырный анастомоз «конец в бок». Интубатор мочеточника вместе с катетером Фолея выведен по уретре.
Послеоперационное течение гладкое. Рана зажила первичным натяжением. Выполненная антеградная пиелоуретероилеография показала хорошую проходимость кишечного трансплантата (рис. 5). На 14-е сутки удален интубатор, а затем катетер Фолея. Восстановилось мочеиспускание, и 10.03.16 больная выписана на амбулаторное лечение.
В течение 3 мес чувствовала себя хорошо, жалоб не предъявляла. При контрольном обследовании через 6 мес самочувствие пациентки хорошее, жалоб нет, определяется хорошая функция почек и мочевых путей, в том числе кишечного трансплантата.
В представленном клиническом наблюдении тотальная кишечная пластика мочеточника с каликоилеоанастомозом оказалась единственной возможной операцией, позволившей устранить мочевой свищ и сохранить единственную почку.
Кишечно-пузырный анастомоз мы выполняли в двух вариантах: «дистальный конец в бок» и «бок в бок». Соустье между кишечным сегментом и мочевым пузырем «конец в бок» можно сформировать в классическом варианте или в модификации со спатуляцией конца кишки, что делает анастомоз шире (рис. 6, а). Последний считаем более надежным, особенно при постлучевых изменениях стенки мочевого пузыря. В таких случаях может быть выполнен и кишечно-пузырный анастомоз «бок в бок» с оставлением небольшого слепого участка кишечного сегмента (рис. 6, б). Такое клюшкообразное расположение делает соустье более широким и создает «кишечный запас» при возможном снижении емкости мочевого пузыря.
Мочекишечные анастомозы почти всегда располагали внутрибрюшинно, хотя лоханочно-кишечный анастомоз из-за выраженного паранефрального рубцового процесса можно размещать и в забрюшинном пространстве, что не имеет принципиального значения. Более того, зачастую мы вовсе не ушивали париетальную брюшину. Времена, когда, опасаясь перитонита, всегда старались расположить анастомозы внебрюшинно, прошли. В связи с этим вопрос об их месте нахождения теряет свою актуальность. Зоны вновь созданных соустий обязательно дренировали для раннего обнаружения возможных случаев их несостоятельности. При кишечной пластике мочеточников мы ни разу не наблюдали несостоятельности или стенозирования кишечно-пузырных анастомозов.
 Результаты и обсуждение. Период наблюдения составил от 3 мес до 15 лет (средний – 8,6±0,7 года). Среди 96 прооперированых ранние послеоперационные осложнения возникли у 8 (8,3%) пациентов, 5 (5,2%) из которых потребовались повторные операции. Среди них у 2 (2,1%) имела место несостоятельность проксимальных анастомозов. В первом случае у пациентки после двусторонней 7-образной илеоуретеропластики произведены релапаротомия, лигирование правого мочеточника, ушивание отверстия в трансплантате. Во втором случае у больного после пиелоилеоуретероанастомоза справа по Yang–Monti двумя кишечными трансплантатами на 2-е сутки после операции возникла обильная гематурия с тампонадой лоханки правой почки сгустками крови, несостоятельность пиелоилеоанастомоза с формированием мочевого затека и развитием перитонита. Выполнена релюмболапаротомия, эвакуация сгустков крови из лоханки, ушивание ее дефекта, интубация тонкой кишки зондом Эббота, дренирование брюшной полости. Острые явления купированы, рана зажила первичным натяжением.
Результаты и обсуждение. Период наблюдения составил от 3 мес до 15 лет (средний – 8,6±0,7 года). Среди 96 прооперированых ранние послеоперационные осложнения возникли у 8 (8,3%) пациентов, 5 (5,2%) из которых потребовались повторные операции. Среди них у 2 (2,1%) имела место несостоятельность проксимальных анастомозов. В первом случае у пациентки после двусторонней 7-образной илеоуретеропластики произведены релапаротомия, лигирование правого мочеточника, ушивание отверстия в трансплантате. Во втором случае у больного после пиелоилеоуретероанастомоза справа по Yang–Monti двумя кишечными трансплантатами на 2-е сутки после операции возникла обильная гематурия с тампонадой лоханки правой почки сгустками крови, несостоятельность пиелоилеоанастомоза с формированием мочевого затека и развитием перитонита. Выполнена релюмболапаротомия, эвакуация сгустков крови из лоханки, ушивание ее дефекта, интубация тонкой кишки зондом Эббота, дренирование брюшной полости. Острые явления купированы, рана зажила первичным натяжением.
В отдаленном послеоперационном периоде осложнения развились у 7 (7,3%) пациентов и 4 (4,2%) потребовалось оперативное лечение. У этих пациентов сформировались стриктуры уретероилеоанастомозов спустя 3 мес и более после операции. Проходимость мочевыводящих путей была восстановлена путем антеградного бужирования стриктур. Результаты консервативного лечения и повторных операций для всех пациентов были хорошими. Летальных исходов не было. Сведения о ранних и поздних осложнениях со стороны мочекишечных анастомозов после кишечной реконструкции мочеточников представлены в таблице.
Из таблицы следует, что именно проксимальные анастомозы (уретероилеоанастомоз) являются уязвимыми местами при данных операциях, наиболее подверженными образованию стриктур. Они превалировали (50%) среди 8 больных с послеоперационными осложнениями.
 Совершенный мочеточниково-кишечный анастомоз должен быть прост в создании, характеризоваться низким риском развития стеноза и препятствовать рефлюксу. В современной литературе существуют разные мнения: использовать ли антирефлюксные методики для защиты почки от заброса мочи из мочевого пузыря, или нет? Некоторые авторы продолжают совершенствовать технику вмешательства, вводя все более сложные способы таких механизмов, в том числе и в области дистального, кишечно-пузырного, анастомоза [10]. Другие урологи, располагая большим собственным опытом с ближайшими и отдаленными результатами, считают, что применение антирефлюксных анастомозов значительно увеличивает продолжительность операции и сопровождается большим количеством осложнений, прежде всего образованием стриктур в отдаленном послеоперационном периоде [11–14].
Совершенный мочеточниково-кишечный анастомоз должен быть прост в создании, характеризоваться низким риском развития стеноза и препятствовать рефлюксу. В современной литературе существуют разные мнения: использовать ли антирефлюксные методики для защиты почки от заброса мочи из мочевого пузыря, или нет? Некоторые авторы продолжают совершенствовать технику вмешательства, вводя все более сложные способы таких механизмов, в том числе и в области дистального, кишечно-пузырного, анастомоза [10]. Другие урологи, располагая большим собственным опытом с ближайшими и отдаленными результатами, считают, что применение антирефлюксных анастомозов значительно увеличивает продолжительность операции и сопровождается большим количеством осложнений, прежде всего образованием стриктур в отдаленном послеоперационном периоде [11–14].
О формировании кишечно-пузырного анастомоза также существуют различные мнения. Одни считают, что оптимальным является соединение отрезка кишки с мочевым пузырем «бок в бок», так как в этом случае риск сужения в этом месте сводится к минимуму [15]. Другие утверждают, что и в конструктивном отношении, и с точки зрения уродинамики создание кишечно-пузырного соустья «конец в бок» представляется наиболее совершенным способом [16]. Для сохранения функции почки некоторые урологи рекомендуют формировать антирефлюксный инвагинационный клапан, хотя доказано, что ни один из них не обеспечивает полной гарантии защиты от рефлюкса и в 40% случаев приводит к различным осложнениям. В отношении места расположения анастомоза также нет единого мнения: выполнять его ближе ко дну мочевого пузыря или в области свода [17, 18]? С целью минимальной травматизации нашим больным экстраперитонизация мочевого пузыря не производилась и осуществлялся кишечно-пузырный анастомоз «конец в бок» в области его верхушки (эпицистоилеоанастомоз). Диаметр подвздошной кишки практически всегда позволял создать широкое соустье с мочевым пузырем. Для надежной герметичности при его формировании использовали непрерывный шов, который в определенной степени сужает просвет анастомоза и со временем может стать причиной образования в этом месте стриктуры. С целью предупреждения стеноза мы дополнительно выполняли продольное рассечение пузырного конца кишки по антибрыжеечному краю на 2–3 см так, чтобы длина ее просвета была не менее 5 см. Такой же длины разрез проводили внутрибрюшинно в области верхушки мочевого пузыря, после чего непрерывным узловым викриловым швом 2/0 через все слои формировали кишечно-пузырный анастомоз. В отличие от проксимального дистальный анастомоз трансплантата с мочевым пузырем всегда является более широким, и риск его сужения минимален. Отрицательной стороной такого соустья является развитие пузырно-лоханочного рефлюкса, который имел место у 2 (2,1%) пациентов. Однако он не проявлялся клинически и не сопровождался гидроуретеронефрозом и рецидивирующей инфекцией мочевыводящих путей.
На сегодняшний день, располагая опытом 168 кишечных и аппендикулярных пластик мочеточников и мочевого пузыря, мы считаем, что всем вышеуказанным требованиям больше всего соответствует прямой анастомоз, сопряженный с минимальной вероятностью развития стриктуры, а при изоперистальтическом расположении и достаточной длине (не менее 15 см) трансплантата обеспечивает и антирефлюксную защиту. Риск сужения соустья можно снижать адекватным дренированием и аккуратным обращением с мочеточником, избегая избыточного истончения адвентиции, качественным наложением швов, а также не допуская натяжения анастомоза.
Заключение. Являясь достаточно надежным и технически простым, прямой мочеточниково-кишечный анастомоз обеспечивает минимальную вероятность развития стриктуры. Следует отметить, что именно проксимальные (мочеточниково-кишечные) анастомозы наиболее подвержены образованию сужений. В отличие от проксимального, дистальный анастомоз трансплантата с мочевым пузырем всегда является более широким, в связи с чем риск его сужения минимален. Предотвратить развитие пузырно-лоханочного рефлюкса позволяет изоперистальтическое расположение трансплантата и достаточная его длина.


