Введение. В настоящее время большинство авторов полагают, что в основе осложнений хирургического лечения гипоспадии лежат два важнейших фактора: широкая вариабельность клинических форм аномалии и как следствие – многообразие методических подходов к лечению этого порока [1–4]. Анализ причин осложнений оперативного лечения гипоспадии представлен в ряде работ, при этом к факторам наибольшего риска возникновения свищей уретры после ее восстановления относят недостаточное инвертирование эпителиальных краев раны, некроз тканей, недостаточное покрытие вторым слоем тканей зоны уретропластики [3–6].
Безусловно большинство осложнений первичного лечения гипоспадии – стеноз отверстия уретры, уретральные свищи, несостоятельность неоуретры – требует выполнения дополнительных корригирующих операций. Считается, что потребность в повторном хирургическом вмешательстве после операций по поводу гипоспадии может служить показателем эффективности лечения и качества оказания медицинской помощи [3, 7, 8]. Показано, что общая частота повторных вмешательств при гипоспадии достигает 15,7%, при дистальной гипоспадии – 8% [2, 9–12]. Таким образом, несмотря на значительные достижения в области хирургической техники лечения гипоспадии, у значительной части пациентов развиваются осложнения, что в последующем требует выполнения нескольких повторных оперативных вмешательств.
Целью исследования стало улучшение результатов лечения больных после неоднократных операций по поводу гипоспадии за счет оптимизации ведения послеоперационного периода.
Материалы и методы. На базе отделения андрологии и урологии НЦАГиП им. акад. В. И. Кулакова обследованы 82 пациента (средний возраст – 48,1±15,3 года) со стриктурой уретры после неудачных операций по поводу гипоспадии. В ходе обследования выявляли жалобы, собирали анамнез, проводили физикальное обследование с использованием общеклинических методов, выполняли УЗИ мочевыводящих путей, урофлоуметрию, микционную ультрасонографию уретры, ретроградную и микционную уретрографию. По показаниям проводили КТ или МРТ органов малого таза и уретры.
Частота встречаемости различных симптомов нижних мочевыводящих путей у обследованных пациентов представлена в табл. 1.
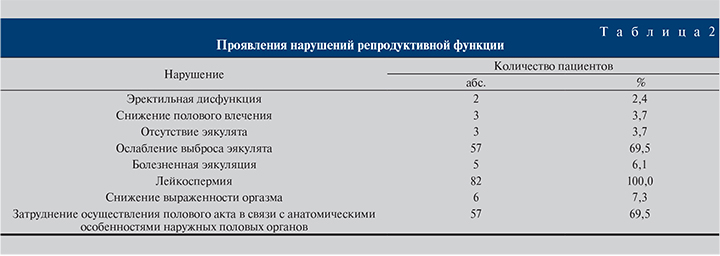
У значительной части обследуемых пациентов выявлены нарушения репродуктивной функции (табл. 2).
Всем больным, включенным в исследование, была выполнена этапная заместительная уретеропластика. В качестве пластического материала использована слизистая оболочка из ротовой полости (щека, губа, язык).
Первым этапом удаляли пораженный участок уретры с фиброзно-измененными тканями, корригировали деформацию полового члена и создавали уретральную площадку из слизистой оболочки ротовой полости. При удовлетворительных результатах через 6–8 мес, когда была сформирована уретральная площадка шириной не менее 2,5 см и достигнуто выпрямление полового члена, выполняли следующий этап – тубуляризацию уретры. Если после I этапа лечения возникало рубцевание буккального лоскута или деформация полового члена, требовалась повторная операция для коррекции данных осложнений.
Всем пациентам после фиксации буккального лоскута с целью профилактики гематомы в области раны на 5 дней применяли давящую марлевую повязку и дренировали мочевой пузырь уретральным катетером Фолея в течение 5–7 дней. После удаления фиксирующей повязки уретральную площадку в течение 7–10 дней обрабатывали левомеколем, а потом бипантеном до выполнения II этапа операции.

При выполнении II, окончательного, этапа операции мы в основном применяли методику Дюплея, где окаймляющим разрезом мобилизовали края буккального лоскута и, используя непрерывный шов (монокрилом 5/0 или 6/0), производили тубулиризацию уретры. Для профилактики свищей линия швов дополнительно укрывалась мобилизованными слоями мясистой оболочки полового члена или лоскутом из влагалищной оболочки яичка.
После II этапа – тубулиризации, мочевой пузырь дренировали уретральным катетером Фолея в течение 14 дней, а в отношении 20 пациентов применяли катетер, разработанный в НЦАГиП им. акад. В. И. Кулакова. Данный катетер изготовлен из высококачественного силикона и имеет два дополнительных канала: один – для раздувания манжетки-дилататора, второй – для доставки лекарственных препаратов и эвакуации раневого отделяемого из уретры. Манжетка-дилататор в разных катетерах располагается на разных уровнях канала уретры. С целью профилактики образования стриктур и сужений в области операционного поля врач осуществляет регулярное (1–2 раза в день) раздувание манжетки-дилататора.
Кроме этого на протяжении уретральной части катетера находятся перфорированные отверстия, через которые уретра орошается лекарственными и антисептическими жидкостями. Кроме этого, что очень важно, наличие отверстий в стенке катетера позволяет в постоянном режиме эвакуировать воспалительный экссудат из мочеиспускательного канала.
Перед удалением уретрального катетера выполняли перикатетерную уретрогафию и при наличии затека контрастного вещества оставляли катетер на более длительный срок. При возникновении гнойно-воспалительных изменений в ране или в мочеиспускательном канале удаляли уретральный катетер, предварительно установив цистостомический дренаж.
Результат операции оценивали на основании субъективной оценки пациентами результатов выполненных корригирующих операций («хороший», «удовлетворительный», «неудовлетворительный») по таким критериям, как внешний вид органа, отсутствие вентрального искривления и характер струи мочи, а также по данным урофлоуметрии и уретрографии.
Статистическую обработку полученных данных выполняли с помощью пакета прикладных программ «STATISTICA 8.0».
Результаты. По данным урофлоуметрии средний показатель максимальной скорости мочеиспускания (Qmax) до операции составил 7,4±4,8 мл/с. При оценке протяженности стриктуры уретры использовали результаты ультразвуковых и рентгенологических методов диагностики. Средняя протяженность стриктуры составила 5,4±1,2 см (от 1 до 16 см). При обследовании было установлено, что у 37 (45,1%) пациентов стриктура сочеталась с деформацией полового члена, у 30 (36,5%) – с наличием волос в неоуретре, у 28 (34,1%) – с дивертикулами уретры, у 14 (17%) – с камнями уретры.
Почти у всех пациентов в общем анализе мочи и в анализе эякулята было отмечено повышенное количество лейкоцитов, что свидетельствовало о наличии воспалительного процесса.
Средний срок наблюдения составил 25,4±12,9 мес. У 68 (82,9%) прооперированных проходимость уретры была восстановлена в результате двухэтапных вмешательств, у 10 (12,2%) – трех-, у 4 (4,8%) – четырехэтапных.
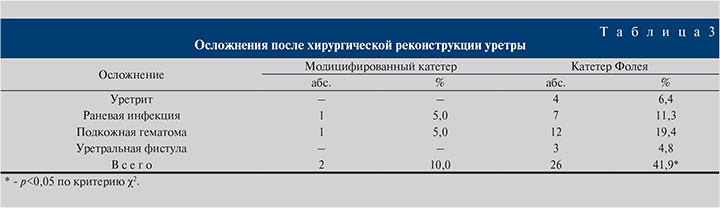
Как видно из табл. 3, в группе пациентов, которым был установлен модифицированный катетер, осложнения наблюдались реже, их общая частота составила только 10%, что статистически значимо (p<0,05) меньше, чем в группе катетера Фолея, где значение этого показателя составило 41,9%.
Все воспалительные осложнения и подкожные гематомы корригировали с помощью консервативных методов лечения. Уретральные фистулы у всех трех пациентов были ликвидированы в ходе повторных хирургических вмешательств.
Показатели урофлоуметрии демонстрировали улучшение качества мочеиспускания почти у всех пациентов. Средние показатели Qmax после операции увеличились почти в 3 раза и составили 21,4±6,8 мл/с. Несмотря на улучшение показателей урофлоуметрии, двое пациентов не были удовлетворены качеством мочеиспускания. При контрольном рентгенологическом обследовании у них были выявлены короткие стриктуры уретры (0,5 см), которые в дальнейшем успешно корригировались с помощью внутренней оптической уретротомии.
У 34 пациентов деформация полового члена была корригирована полностью, тогда как у 3 имелось остаточное искривление, которое не мешало пациенту проводить половой акт и не требовало дополнительной операции.
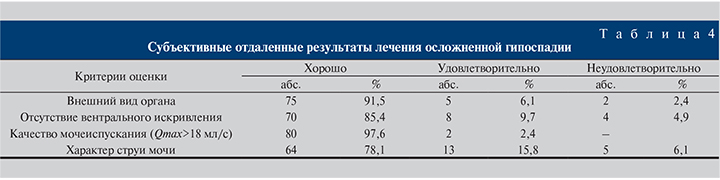
При контрольном обследовании через 12 мес у 7 пациентов, которые использовали обычные катетеры, в анализах мочи и эякулята сохранялись признаки воспалительного процесса, тогда как аналогичные изменения после применении модифицированного катетера были выявлены только у двух больных. В табл. 4 представлены результаты субъективной оценки пациентами результатов лечения. Как видно, абсолютное большинство опрошенных (75 [91,5%]) оценили внешний вид органа как хороший, 5 (6,1%) – как удовлетворительный, 2 (2,4%) пациента – как неудовлетворительный.
Также большинство пациентов оценили результат как хороший по такому критерию, как отсутствие вентрального искривления (70 [85,4%]) опрошенных, только 8 (9,7%) человек рассматривали результат как удовлетворительный, 4 (4,9%) – как неудовлетворительный.
Почти все пациенты результат посчитали хорошим по качеству мочеиспускания – 80 (97,6%) человек, лишь 2 (2,4%) расценили его как удовлетворительный.
Наконец, при оценке характера струи мочи оценили результат как хороший 64 (78,1%) пациента, как удовлетворительный – 13 (15,8%) и как неудовлетворительный – 5 (6,1%).
Обсуждение. В целом результаты проведенного исследования показывают, что этапная заместительная уретропластика из слизистой оболочки ротовой полости позволяет восстановить проходимость мочеиспускательного канала, снизить выраженность воспалительного процесса в нем и за счет этого улучшить качество жизни пациентов после неоднократных операций по поводу гипоспадии.
Известно, что неудачи уретропластики и свищи неоуретры отчасти являются результатом развития ишемического некроза тканей и этому может способствовать электрокоагуляция, используемая при выполнении вмешательств. Некоторые специалисты в ходе операции применяют временное наложение жгута или турникета на основание полового члена с обработкой раневой поверхности марлевым тампоном, смоченным в ледяном солевом растворе с добавлением адреномиметиков [12, 13].
Касаясь техники выполнения вмешательств, следует отметить, что W. Snodgrass и соавт. [13] утверждают, что разрез мочеиспускательной пластинки не должен продолжаться до кончика полового члена, так как это может приводить к стенозу отверстия мочеиспускательного канала. Тем не менее результаты гистологических исследований свидетельствуют, что под пластинкой находится здоровая, васкуляризованная соединительная субэпителиальная ткань, при этом не было найдено доказательств того, что субэпителиальная ткань на вершине головки отличается от таковой под пластинкой [14].
A. Holland и соавт. [15] предположили, что применение TIP-пластики в отношении мальчиков с узкой уретральной пластинкой (менее 8 мм) сопряжено с увеличением риска осложнений. Авторы отметили, что риск формирования свища повышен при неглубокой головке с шириной менее 8 мм, при этом не было предоставлено доказательств того, что такой разрез действительно увеличивает итоговую истинную ширину неоуретры.
В исследовании [16] в качестве факторов, способствующих плохому заживлению неоуретры и формированию свищей, указаны механические факторы, ошибки в технике операции, приводящие к ишемии тканей.
Есть мнение, будто фактором, предрасполагающим к развитию осложнений, может быть и техника ушивания послеоперационных ран, при этом отмечено, что при выполнении подобного рода операций предпочтительно внутрикожное ушивание [13].
В целом следует отметить, что до настоящего времени отсутствует единый клинический подход к выбору метода хирургического лечения осложненных форм гипоспадии [2]. Ряд авторов данной категории больных в качестве пластического материала для повторной уретропластики рекомендуют использовать оставшиеся участки кожи полового члена [3]. Для закрытия дефекта в средней части ствола используются любые доступные участки кожи.
В случаях когда кожа ствола полового члена не может быть использована для пластики, берется трансплантат из слизистой оболочки губы или щеки. В тех ситуациях, когда в результате нескольких попыток образуется дефект больших размеров, операцию по его устранению выполняют, как правило, в два этапа. Вначале удаляют ткани сформированной ранее неоуретры, образовавшийся дефект закрывают сетчатым трансплантатом или лоскутом на ножке из влагалищной оболочки либо одновременно обоими лоскутами. На втором этапе проводят повторную пластику уретры [4–6].
В тех случаях, когда экстрагенитальная донорская ткань считается единственным возможным вариантом для выполнения уретропластики, следует помнить, что ее использование может увеличить длительность как самой операции, так и общего лечения пациента [6, 7].
Как известно, длительность дренирования уретры и характеристика уретрального катетера служат немаловажным фактором при возникновении рецидива стриктуры, поскольку при длительном дренировании поддерживается воспалительный процесс в уретре, а при раннем удалении уретрального катетера возникает слипание рассеченных краев уретры и эти факторы способствуют раннему рецидивированию. Кроме того, после хирургического лечения в уретре накапливается раневое отделяемое, что также поддерживает воспалительный процесс и требует своевременной его эвакуации. Наряду с этим тактика лечения предусматривает введение антибактериальных препаратов, протеолитических ферментов в зону оперативного вмешательства. Немаловажным фактором является также материал, из которого сделан уретральный катетер. Как показывает клиническая практика, катетеры, изготовленные из современного высококачественного силикона, по сравнению с латексными лучше переносятся пациентами и реже провоцируют развитие острого уретрита.
Таким образом, создавая новую идеальную модель уретрального катетера для лечения стриктуры уретры, можно предъявить к нему следующие требования: катетер, изготовленный из силикона, который имеет первый дополнительный канал для доставки лекарственных препаратов и отхождения раневого отделяемого из уретры, и второй дополнительный канал для раздувания манжетки-дилятатора, которая располагается на разных уровнях катетера.
Предложенная нами модификация катетера позволяет урологам своевременно вводить после хирургического лечения стриктуры уретры соответствующие лекарственные препараты в зону операции, эвакуировать раневое отделяемое из уретры, предупреждать развитие стриктур и сужений, периодически раздувая регулируемую манжетку-дилататор. Возможность орошения уретры через дополнительный канал лекарственными и антисептическими растворами очень актуальна для больных хроническим уретритом с точки зрения предупреждения активизации воспалительного процесса. Безусловно, повторная уретропластика после неудачного первичного оперативного лечения гипоспадии считается достаточно сложной задачей. Кроме того, зачастую хирург не имеет необходимых сведений об исходной форме гипоспадии, а также о варианте ранее выполненного вмешательства. В связи с этим нередко частота осложнений при повторных операциях бывает значительно выше, чем при первичных вмешательствах [8].
Еще одной существенной проблемой при выполнении повторного вмешательства по поводу гипоспадии является выбор пластического материала для формирования неоуретры. Многие авторы считают, что результаты лечения гипоспадии зависят от опыта хирурга и возраста пациента [17, 18]. К значимым факторам, повышающим вероятность проведения повторных операций, относятся мошоночно-стволовая и проксимальная стволовая формы гипоспадии, недостаточное покрытие неоуретры васкуляризованной тканью, а также возраст пациента больше 4 лет [19].
В заключение следует отметить, что ряд авторов считают, что прогресс медицинских технологий позволит повысить эффективность реконструкции уретры после осложнений хирургического лечения гипоспадии [8, 15]. Этому будут в первую очередь способствовать дальнейшее развитие методов клеточной инженерии и создание искусственной ткани для замещения уретры, а также применение новых методов трансплантации кожи.


