Введение. Наиболее ярким представителем патологического состояния сна является синдром обструктивного апноэ сна (СОАС), характеризующийся высокой распространенностью и тяжестью осложнений. Еще в 1995 г. было показано, что данное нарушение дыхания во время сна встречается в 8 раз чаще у мужчин, чем у женщин [1]. Основные жалобы – храп, повышение артериального давления (АД), преимущественно в утренние часы, повышенная дневная сонливость, головная боль при пробуждении, снижение либидо и ночной диурез. Данный симптомокомплекс зачастую описывается как «привилегия» мужчин среднего возраста [2, 3]. Следует отметить, что около 35% мужчин в возрасте от 40 до 70 лет страдают от частичной или полной невозможности достичь эрекции [4]. Взаимосвязь эректильной дисфункции и обструктивных нарушений дыхания во время сна не вызывает сомнений.
С детства и до пожилого возраста у мужчин во время сна возникает эрекция. Приоткрыл завесу тайны ночных спонтанных эпизодов эрекции E. Aserinsky в 1953 г. в своей докторской диссертации. Именно он впервые установил взаимосвязь только открытой фазы быстрого сна (ФБС) и ночных эпизодов эрекции. Эти исследования были продолжены и полученные ранее данные подтверждены I. Karasan и C. Fisher в 1965 г. Тогда же, в 1965 г., был принят термин NPT – nocturnal penile tumescence. Назначение ночных эпизодов эрекции во многом еще неясно. Однако регулярная вазодилатация и оксигенация пениса необходимы для поддержания жизнеспособности тканей, так как постоянная тренировка всей сложной физиологической системы, зависящей от гармоничного функционирования сосудистых, неврологических и гормональных механизмов, поддерживает на должном уровне процессы, необходимые для эрекции [5]. Ранее нами были описаны особенности ночного пенильного паттерна (NPT) у пациентов с СОАС [6]. Стандартом лечения пациентов с СОАС является СРАР-терапия (Continuous Positive Airway Pressure – неинвазивная вентиляция положительным давлением в верхних дыхательных путях во время сна). Однако наблюдаемое сочетание различных коморбидных состояний, в частности характерный для пациентов с СОАС андрогенный дефицит, демонстрирует явное «омоложение» данной патологии и обосновывает целесообразность поиска новых и эффективных междисциплинарных путей профилактики и коррекции данных состояний.
 Целью данной работы стала оценка влияния СРАР-терапии на показатели полисомнографического (ПСГ) мониторинга и NPT, а также на уровень тестостерона у мужчин с СОАС в условиях возрастного андрогенного дефицита (ВАД).
Целью данной работы стала оценка влияния СРАР-терапии на показатели полисомнографического (ПСГ) мониторинга и NPT, а также на уровень тестостерона у мужчин с СОАС в условиях возрастного андрогенного дефицита (ВАД).
Материалы и методы. В соответствии с дизайном в открытое нерандомизированное неинтервенционное исследование были включены 69 мужчин с ВАД. Из них 45 мужчинам (средний возраст – 60,3±4,8 года, индекс массы тела (ИМТ) – 34,2±5,2 кг/м2), обратившимся в Сомнологический центр с жалобами на храп, повышенную утомляемость, снижение либидо, «неосвежающий силы сон», головную боль по утрам и частое ночное мочеиспускание, на основании жалоб и объективных данных был выставлен диагноз «СОАС средней степени тяжести». Пациентам были объяснены все возможные последствия данного заболевания и в соответствии с утвержденными рекомендациями, впервые описанными Douglas в 1994 г. [7], была назначена СРАР-терапия. Тридцати четырем (основная группа, средний возраст – 60,5±4,3 года, ИМТ – 33,4±1,8 кг/м2) из 45 мужчин с СОАС был проведен подбор адекватного постоянного положительного давления в верхних дыхательных путях. Одиннадцать мужчин подписали отказ от подобного терапевтического воздействия. Титрация осуществлена с помощью автоматического СИПАП-аппарата Prisma 20 A («Weinemann», Германия) в течение 2 мес. Контрольную группу составили 24 человека без клинических проявлений нарушений дыхания во время сна, находящихся в состоянии ВАД, сопоставимых по полу, возрасту и ИМТ с пациентами основной группы (средний возраст – 62,2±3,1 года, ИМТ – 29,3±2,6 кг/м2) и подобранных по типу «копия–пара». Отсутствие нарушений дыхания во время сна было подтверждено в ходе ПСГ-исследования. Указанный объем контрольной выборки статистически допустим с учетом сопоставимости с основной группой и использования в анализе полученных данных только методов дескриптивной статистики.
Критерии включения:
- возраст мужчин 55–65 лет;
- ИМТ >27,2 кг/м2;
- объем талии (ОТ) >94 cм;
- общий тестостерон (ОТс) <12,1 нмоль/л;
- симптомы гипогонадизма – оценка по опроснику AMS более 26 баллов;
- балльная оценка по международному индексу эректильной функции (IIEF-5) менее 21.
Критерии исключения:
- рак предстательной железы;
- тяжелая сердечная или легочная недостаточность;
- неконтролируемая ишемическая болезнь сердца;
- тяжелая степень хронической обструктивной болезни легких.
Состояние ВАД определено в условиях Центра инновационной медицины НЦ ПЗС РЧ в соответствии с Рекомендациями по диагностике, лечению и мониторированию возрастного гипогонадизма у мужчин [8]. Диагноз СОАС был поставлен в Сомнологическом центре на основании результатов проведенного ПСГ-исследования с использованием системы GRASS-TELEFACTOR Twin PSG (Comet®) с усилителем As 40 с интегрированным модулем для сна SPM-1 (США) и опцией для мониторинга NPT во время 7-часового ночного сна. Исследование было проведено по стандартной методике [9]. Уровень общего Тс определен иммуноферментным способом. Обязательным условием включения пациентов в исследование было заполнение ими опросника возрастного гипогонадизма Aging Male Scale (опросник AMS) и шкалы выраженности эректильной дисфункции (анкета IIEF-5). Допустимым критерием по первому опроснику стало количество баллов более 26 [10], по второму – менее 21 балла [11].
Дизайн исследования: открытое нерандомизированное неинтервенционное исследование эффективности CPAP-терапии мужчин с СОАС в условиях ВАД посредством ПСГ-исследования с одновременным мониторингом ночных пенильных эпизодов и оценкой уровня тестостерона.
1-й этап – скрининг: опросник AMS, анкета IIEF-5, ОТс, объективное исследование, ОТ, консультация уролога, терапевта, УЗИ предстательной железы.
2-й этап – объективизация: ПСГ-мониторинг в течение 7 ч ночного сна с одновременным исследованием эректильной функции.
3-й этап – СРАР-терапия в течение 2 мес.
4-й этап – контроль лечения: опросник AMS, анкета IIEF-5, общий Тс, ПСГ-мониторинг (7 ч ночного сна) с одновременным исследованием эректильной функции. Контроль лечения осуществлен через 2 мес в соответствии с дизайном исследования.
 Статистическую обработку и анализ полученных результатов проводили с применением пакета прикладных программ «Statistica for Windows» v.6.0, StatSoft Inc. (США) и электронных таблиц «Microsoft Excel». Для изучаемых признаков использовали оценку средних арифметических: среднего (M), среднеквадратичного отклонения (SD). Данные представлены в виде М±σ. Межгрупповое сравнение значимости клинических параметров при равном количестве наблюдений проведено с помощью парного W-критерия Уилкоксона, а при неравном количестве наблюдений – с помощью U-критерия Манна–Уитни (гипотеза о различиях между группами принималась при р<0,05).
Статистическую обработку и анализ полученных результатов проводили с применением пакета прикладных программ «Statistica for Windows» v.6.0, StatSoft Inc. (США) и электронных таблиц «Microsoft Excel». Для изучаемых признаков использовали оценку средних арифметических: среднего (M), среднеквадратичного отклонения (SD). Данные представлены в виде М±σ. Межгрупповое сравнение значимости клинических параметров при равном количестве наблюдений проведено с помощью парного W-критерия Уилкоксона, а при неравном количестве наблюдений – с помощью U-критерия Манна–Уитни (гипотеза о различиях между группами принималась при р<0,05).
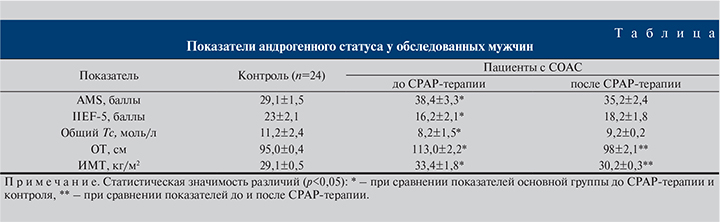
Результаты. Согласно дизайну исследования, всем обследуемым на 1-м этапе было проведено анкетирование с целью выявления симптомов гипогонадизма и эректильной дисфункции, объективное обследование с оценкой ОТ и ИМТ, консультация уролога, терапевта, УЗИ предстательной железы, определение уровня общего Тс. Как видно из таблицы, сравнительный анализ этих показателей до СРАР-терапии по сравнению с контролем выявил статистически значимые различия между группами (p<0,05). После 2-месячного курса СРАР-терапии пациенты отметили улучшение по всем анализируемым показателям (см. таблицу). Следует отметить, что, несмотря на статистически значимое улучшение некоторых показателей андрогенного статуса на фоне СРАР-терапии, уровень общего Тс не достиг нормативных показателей при имеющейся тенденции к повышению (см. таблицу).
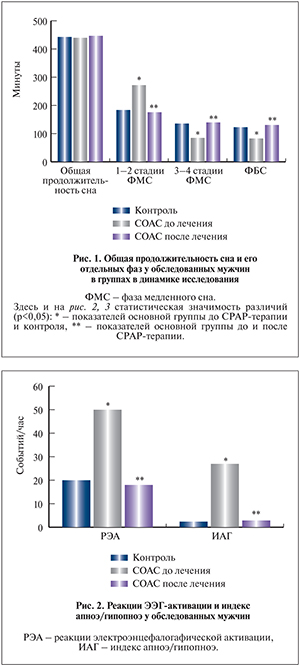
Результаты расширенного ПСГ – исследования представлены на рис. 1.
Следует отметить, что до лечения пациенты имели типичные для СОАС средней степени показатели ПСГ, значимо отличающиеся от контрольных значений (p<0,05). При оценке влияния СРАР-терапии на макроструктурную организацию сна, частоту микроактиваций головного мозга и остановок дыхания во время сна, а также на степень насыщения крови кислородом нами было выявлено значительное улучшение большинства параметров ПСГ (p<0,05). Так, грубая фрагментация сна, выраженная значимым преобладанием 1-й и 2-й стадий ФМС, дефицитом глубоких стадий сна и значимым недостатком длительности ФБС, была нивелирована применением постоянного положительного давления в верхних дыхательных путях (p<0,05). При этом следует отметить, что у пациентов, прошедших курс СРАР-терапии, наблюдался так называемый феномен рикошета медленноволнового сна и ФБС (резкое увеличение продолжительности 3–4-й стадий ФМС и ФБС при значительном уменьшении 1–2-й стадий ФМС) [12].
В группе пациентов после лечения также отмечены статистически значимые улучшения количественных показателей ПСГ, таких как индекс РЭА и ИАГ (уменьшение в 2,4 и 7,8 раза соответственно, p<0,05; рис. 2). Вследствие этого мы наблюдали исчезновение специфического феномена дизрегуляции сна – «альфа-дельта-сон».
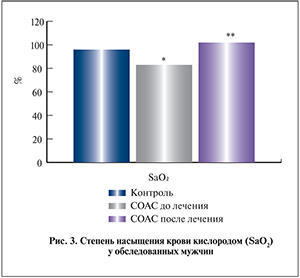
В результате устранения эпизодов апноэ/гипопноэ за счет восстановления проходимости верхних дыхательных путей постоянным положительным давлением в группе пациентов после лечения происходило значительное увеличение насыщения крови кислородом. По данным пульсоксиметрии, проведенной одновременно с ПСГ, наблюдалось статистически значимое повышение сатурации с 82,8±16,2 до 94,1±14,6, т.е. на 11,3% от исходного уровня (рис. 3).
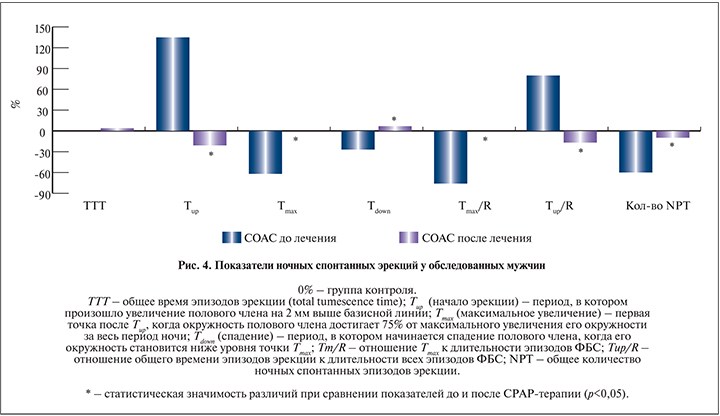
Графически представленная на рис. 4 четкая положительная динамика измененных (р<0,05 при сравнении с контролем) показателей ночных пенильных эрекций у пациентов с СОАС, прошедших курс СРАР-терапии, наглядно демонстрирует эффективность данной терапии. Так, после лечения было выявлено статистически значимое сокращение временного интервала периода Тup относительно показателя группы до лечения в 2,9 раза (р<0,05), т.е. отмечено восстановление отсроченного по времени относительно ФБС начала эректильного эпизода. Также на фоне СРАР-терапии наблюдалось значительное увеличение вплоть до нормальных значений показателя Тmax и периода Тdown относительно показателей группы до лечения в 2,5 и 1,5 раза соответственно (р<0,05 для обоих показателей). Следует отметить, что общая длительность всех эпизодов NPT (ТТТ) была близка к контролю еще до начала курса лечения и оставалась неизменной после СРАР-терапии. Однако количество NPT после лечения достигло нормальных значений, увеличившись в 2,3 раза (р<0,05). При анализе динамики показателей NPT относительно ФБС на фоне СРАР-терапии отмечена нормализация Тmax/R (увеличение в 4,2 раза относительно показателя до лечения, р<0,05) и Тup/R (уменьшение в 2,2 раза относительно показателя до лечения, р<0,05). Учитывая данные изменения, мы можем говорить о восстановлении паттерна NPT и максимальном его сохранении относительно временных границ ФБС у пациентов с СОАС, прошедших курс СРАР-терапии.
Обсуждение. За последние годы лечение мужчин с дефицитом тестостерона стало важной частью урологической и андрологической практики. Дефицит тестостерона и эректильная дисфункция часто встречаются на фоне некоторых соматических заболеваний и иногда служат их маркером или предиктором. Существенно, что эректильная дисфункция и синдром дефицита тестостерона тесно взаимосвязаны и при коррекции данных состояний следует учитывать специфику лечения их обоих [13].
Как было отмечено ранее, для пациентов с СОАС характерны андрогенный дефицит и эректильная дисфункция. При этом СРАР-терапия как единственный метод коррекции при определенной степени тяжести СОАС позволяет полностью устранять не только гипоксические состояния во время сна, но и его патофизиологические последствия. Так, в исследованиях [14, 15] отмечено положительное влияние СРАР-терапии на частоту никтурии у мужчин с СОАС, характерной для пациентов с гипогонадизмом.
Следует отметить, что ранее проведенные исследования довольно убедительно показали существование взаимосвязи индекса апноэ с увеличением массы тела [16, 17]. В другом исследовании [18] авторы продемонстрировали взаимосвязь низкого уровня тестостерона с ухудшением качества сна. Полученные нами результаты не противоречат описанным данным.
По мере накопления клинических и экспериментальных данных с развитием технических возможностей в клинической сомнологии стал доступен количественный и качественный анализ особенностей паттерна ночных пенильных эпизодов эрекции, основанный на взаимосвязи с ФБС.
А.А. Белкин и соавт. [19] с помощью аналогичной ПСГ-системы предприняли попытку оценки NPT на основе нормативных показателей по Ellis, описанных в 1988 г. [20]. Однако более подробно все эпизоды NPT во временном континууме при СОАС были проанализированы и описаны нами в 2014 г. [6]. В связи с этим представленные результаты позволили оценить влияние СРАР-терапии на паттерн ночных пенильных эпизодов с точки зрения количественных и качественных характеристик, а также на некоторые показатели андрогенного статуса и уровень тестостерона.
Необходимо подчеркнуть, что предпринятые ранее неоднократные попытки оценки влияния только СРАР-терапии на уровень тестостерона дали неоднозначный результат. Так, проведенный мета-анализ 7 исследований с участием 232 мужчин не обнаружил существенного различия в уровне тестостерона у пациентов с синдромом апноэ на фоне СРАР-терапии [21], что согласуется с нашими результатами, несмотря на тенденцию к некоторому улучшению этих показателей. В. Н. Журавлев и соавт. [22] констатировали улучшение эректильной функции (согласно опроснику IIEF-5) и показателей ПСГ на фоне СРАР-терапии и дополнительного приема препаратов селективного ингибитора цГМФ – специфической фосфодиэстеразы 5-го типа – варденафила и парентеральной формы тестостерона. Однако данное пилотное исследование не предусматривает полной количественной оценки как паттерна ночных пенильных эпизодов и показателей ПСГ, так и уровня общего Тс, что диктует необходимость дальнейших научных изысканий.
Заключение. Проведенное нами исследование убедительно доказало, что применение СРАР-терапии в отношении пациентов с СОАС в условиях ВАД значимо улучшает не только структуру сна, увеличивая представленность «быстрого сна», но и показатели паттерна ночных пенильных эпизодов. Однако тенденция к повышению уровня тестостерона не была значимой, поэтому необходима дополнительная заместительная тестостеронтерапия на фоне респираторной поддержки пациентов с СОАС в условиях ВАД, что является следующим этапом нашего исследования.


