Введение. Термины «адъювантная и неоадъювантная терапия» (гормональная, лучевая, химиотерапия и пр.) в современной урологии используются в основном при обсуждении различных вариантов лечения онкологических заболеваний. В то же время адъювантная терапия – это вспомогательное, дополняющее радикальные методы лекарственное лечение. Употребление понятия «адъювантная терапия» применимо не только в онкологии, но и в любых других областях медицины при обозначении дополнительного (т.е. в составе комплексного) лечения.
Проблема бесплодия у мужчин с варикоцеле уже более 100 лет актуальна, и до сих пор нет единого общепризнанного мнения о путях ее решения. До сих пор не утихают споры между специалистами во всем мире, как правильно поступать, если мужчина с бесплодием страдает варикоцеле.
В настоящее время бесплодный брак – важная медико-социальная и демографическая проблема. Доля бесплодных пар составляет около 15%. При этом установлено, что мужской фактор имеет место в половине случаев [1, 2].
Известно, что оплодотворяющая способность сперматозоидов зависит от секреторной активности вспомогательных половых желез: придатков яичек, простаты и семенных пузырьков. Наиболее важным биохимическим маркером нормального созревания сперматозоидов является L-карнитин, продуцируемый придатком яичка [3].

Физиологическая роль придатка яичка заключается в создании условий для нормального развития сперматозоидов путем секреции ряда соединений, в том числе L-карнитина, участвующего в переносе ацил-группы и окислительного фосфорилирования жирных кислот в митохондриях и как следствие – в обеспечении энергией, используемой сперматозоидами для созревания и приобретения ими подвижности. Кроме того, установлено, что L-карнитин и ацетил-L-карнитин обладают антиоксидантной активностью за счет удаления токсичного внутриклеточного ацетил-кофермента А и стабилизации клеточной мембраны сперматозоидов под действием активных форм кислорода, гиперпродукция которых является важным патогенетическим фактором патоспермии у мужчин. Следует отметить, что существует прямая корреляция между концентрацией в сперме карнитина, с одной стороны, и количеством, общей и прогрессивной подвижностью, способностью сперматозоидов проникать в цервикальную слизь, с другой.
Появляется все больше доказательств того, что от пагубных эффектов свободных радикалов сперматозоиды защищают мощные антиоксиданты, содержащиеся в семенной плазме. Защитные способности семенной плазмы имеют значительные индивидуальные колебания. Оксидативный стресс (ОС), характеризующийся массивным образованием свободных радикалов, существенно ухудшает сперматогенез и функцию спермы, что может приводить к бесплодию [4, 5]. Кроме того, ОС может стать причиной нарушения денатурации ДНК в одноцепочечной ДНК и двунитевых разрывов ДНК [6].
Фрагментация ДНК сперматозоидов — нарушение целостности ДНК сперматозоидов, связанное с упаковкой патологического хроматина или дефицита протамина, негативно влияет на репродуктивные исходы при естественном зачатии или в программах ВРТ. У бесплодных мужчин доля сперматозоидов с нарушением целостности ДНК составляет более 30%, при этом у здоровых фертильных мужчин она не превышает 15%. При фрагментации ДНК сперматозоидов более 30% вероятность наступления беременности крайне низка [7].
В семенной плазме бесплодных мужчин уровень антиоксидантов значительно ниже, чем у фертильных мужчин. При бесплодии, связанном с повышенным уровнем кислородных радикалов в сперме, отмечается терапевтический эффект антиоксидантов, влияющих на уровень свободных радикалов [8].
Наибольший и вполне обоснованный интерес представляют лекарственные комплексы, воздействующие на различные факторы нарушения сперматогенеза (олиго-, астено-, тератозооспермии) и уровень фрагментации ДНК сперматозоидов.
Новый нутрицевтик, содержащий ацетил-L-карнитин, L-карнитин и α-липоевую кислоту, СпермАктин Форте® (СА) может быть использован для адъювантной терапии бесплодия (лечения патозооспермии и нарушений целостности ДНК сперматозоидов) у мужчин с варикоцеле.
Целью настоящего исследования было изучить эффективность и безопасность комплекса ацетил-L-карнитина, L-карнитина фумарата и α-липоевой кислоты (СпермАктин Форте®) для пациентов с оперированным варикоцеле, изучить влияние его на изменение уровня фрагментации ДНК сперматозоидов в комбинации и без с витаминным комплексом для мужчин «Man’s formula® Больше, чем поливитаминыТМ» (БЧП).
Материалы и методы. В открытом проспективном рандомизированном исследовании участвовали 114 мужчин с различными изменениями эякулята в возрасте 25–45 лет (средний возраст – 34,1±12,1 года).
Критериями включения стали отсутствие беременности у супруги более 12 мес при регулярной половой жизни без контрацепции; олиго-, астено- и/или тератозооспермия; наличие при пальпации варикоцеле, подтвержденного результатами УЗДГ сосудов мошонки; нормальное конституциональное развитие по данным физикального обследования.
 Критерии исключения: установленные генетические причины бесплодия (синдром Клайнфельтера, микроделеции AZF, CFTR), азооспермия, клинические и лабораторные признаки воспалительных изменений придаточных половых желез, пиоспермия, гиперпродукция ФСГ, иммунная форма бесплодия (MAR-test IgG>10%), выраженная соматическая патология, психосексуальная и эякуляторная дисфункции.
Критерии исключения: установленные генетические причины бесплодия (синдром Клайнфельтера, микроделеции AZF, CFTR), азооспермия, клинические и лабораторные признаки воспалительных изменений придаточных половых желез, пиоспермия, гиперпродукция ФСГ, иммунная форма бесплодия (MAR-test IgG>10%), выраженная соматическая патология, психосексуальная и эякуляторная дисфункции.
Методом адаптивной динамической рандомизации со стратификацией все пациенты были разделены на 3 группы по 38 человек.
Группу А (МВЭ+СА) составили мужчины с оперированным варикоцеле субингвинальным доступом с использованием микрохирургической техники по Мармару (МВЭ), принимавшие ацетил-L-карнитин, L-карнитин фумарат и α-липоевую кислоту (СпермАктин Форте®) (по 1 саше 10 г 1 раз в день, утром, во время или после еды) на протяжении 3 мес.
В группу B (МВЭ+СА+БЧП) вошли мужчины с оперированным варикоцеле, принимавшие ацетил-L-карнитин, L-карнитин фумарат и альфа-липоевую кислоту (СпермАктин Форте®) (по 1 саше 10 г 1 раз в день, утром, во время или после еды) в комбинации с витаминным комплексом для мужчин «Man’s formula® Больше, чем поливитаминыТМ» (по 1 капсуле 2 раза в день во время еды) на протяжении 3 мес.
В группе С (МВЭ) были мужчины с оперированным варикоцеле, не получавшие никакой дополнительной консервативной терапии.
Критерии оценки эффективности: показатели спермограммы, показатели фрагментации ДНК сперматозоидов, а также информация о наступлении беременности, полученная путем опроса всех участников исследования.
Исследование показателей спермограммы осуществлено в соответствии с требованиями ВОЗ (2010) до лечения и через 3 мес от начала приема препарата. Оценены концентрация, подвижность, морфология сперматозоидов по строгим критериям Крюгера, а также фрагментация ДНК сперматозоидов.

Статистические методы
Все результаты по изучаемым параметрам в группах представлены с помощью описательных статистик – медианы (Me) и квартилей [Q1; Q3].
Группы сравнивали с помощью критерия Крускала–Уоллиса, для попарного сравнения групп использовали критерий Манна–Уитни с поправкой на множественность сравнений Бонферрони. Статистическая значимость динамики показателей оценена с помощью критерия Вилкоксона.
Для всех критериев установлен критический уровень α=0,05.
Результаты. Группы были сопоставимыми по возрасту, длительности бесплодия в браке, физикальным данным, степени и гемодинамическому типу варикоцеле, а также параметрам спермограммы, МАР-тесту и уровню фрагментации ДНК сперматозоидов (табл. 1).
Физико-химические показатели спермограммы. Нами оценены объем и рН эякулята. Оказалось, что после проведенного хирургического лечения варикоцеле объем эякулята вырос у всех больных, однако только в группе В (МВЭ+СА+БЧП) эти изменения стали статистически значимыми (табл. 2).
В то же время в группах лечения, где применялся СпермАктин Форте®, наблюдалось уменьшение рН эякулята, что может быть связано с фармакологическими свойствами препарата (табл. 3).
Концентрация сперматозоидов. Несколько неожиданным стал факт снижения концентрации сперматозоидов в двух из трех групп через 3 мес после операции (табл. 4).
Максимальное падение концентрации сперматозоидов (на 15,4%) отмечено в группе С. Это возможно объясить тем, что любая операция служит сильным стрессом как для всего организма человека в целом, так и для яичек как отдельно взятого органа. В такие ранние сроки (3 мес) еще нельзя говорить о полном восстановлении функций органа, подвергнутого хирургическому воздействию. При этом следует отметить, что концентрация не опустилась ниже границ нормы (менее 15 млн/мл), и данное снижение не сопровождалось развитием олигозооспермии.
Гораздо менее выраженное снижение концентрации сперматозоидов имело место при стимуляции сперматогенеза в послеоперационном периоде. Так, в группе А (МВЭ+СА) данный показатель снизился на 8,6 %, причем изменение было статистически не значимым (табл. 4).
В группе В (МВЭ+СА+БЧП), напротив, уже к 3-му месяцу отмечено статистически значимое (р<0,05) увеличение концентрации сперматозоидов на 27% (табл. 4).
Подвижность сперматозоидов. Согласно критериям ВОЗ (2010), по оценке показателей спермограммы проведен анализ результатов прогрессивной подвижности сперматозоидов (категория А+В); кроме того, оценивалась и активная подвижность (категория А; табл. 5, 6).
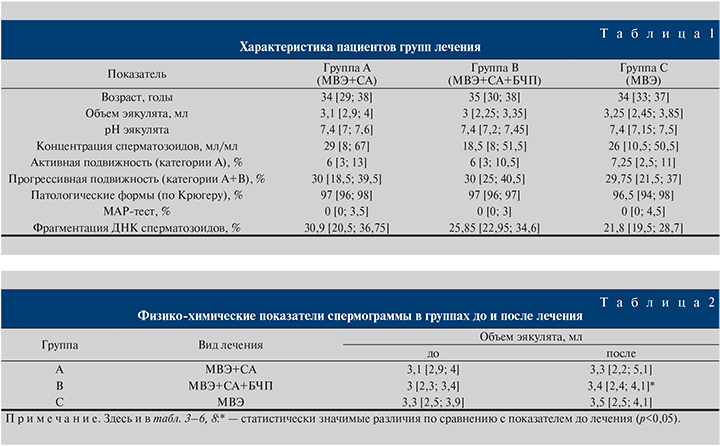
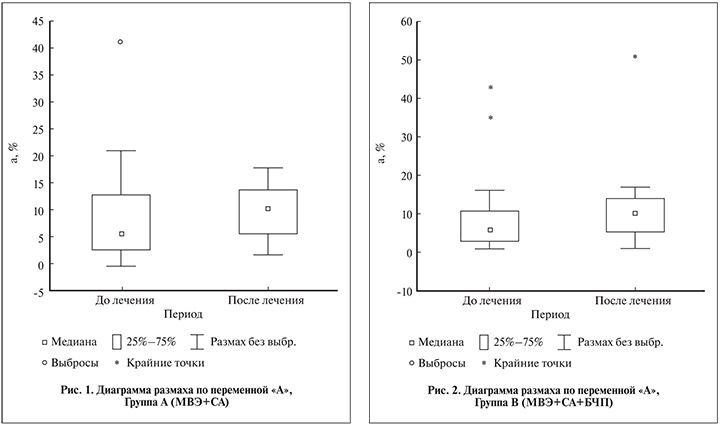
Наибольшее (76,7%) улучшение показателей подвижности сперматозоидов категории А отмечено в группе А (МВЭ+СА) (рис. 1). В то же время в группе В (МВЭ+СА+БЧП) активная подвижность сперматозоидов категории А также выросла на значимую величину – 66,7% (рис. 2), что было сопоставимо и статистически значимо (р<0,05; табл. 5).

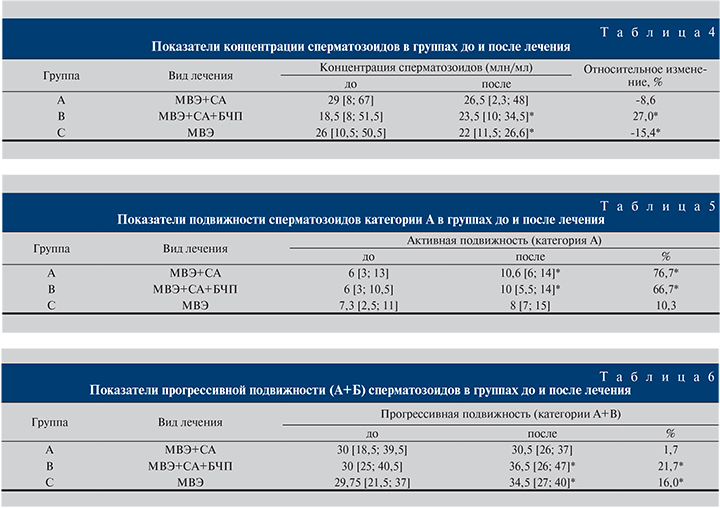
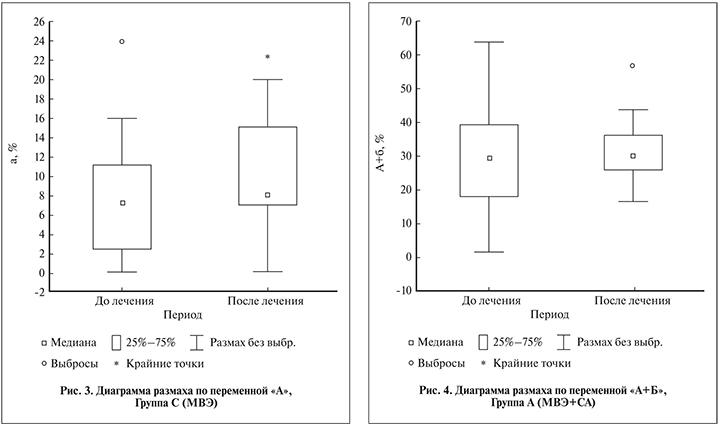
При этом в группе С (МВЭ) также наблюдалось увеличение активной подвижности сперматозоидов на 10,3%, однако оно не было статистически значимым (р>0,05) (рис. 3). Наименьшие изменения прогрессивной подвижности (категории А+В) сперматозоидов зарегистрированы в группе А (МВЭ+СА) (табл. 6) (рис. 4).
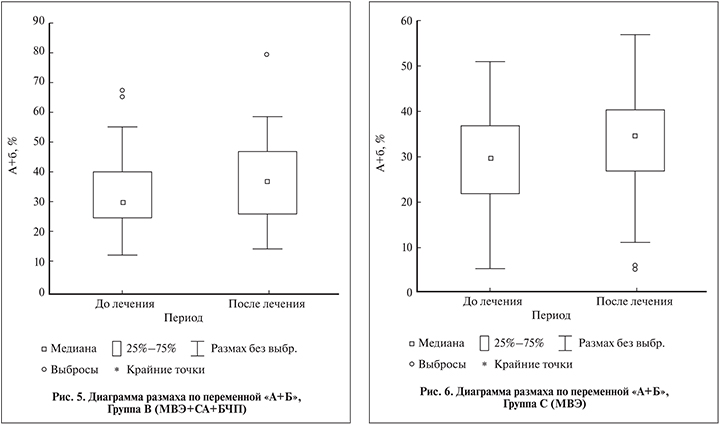
Наиболее выраженная динамика отмечена в группе В (МВЭ+СА+БЧП), в которой произошла нормализация показателя (табл. 6) (рис. 5).
В группе С (МВЭ) рассматриваемый показатель увеличился на 16% (р<0,05; табл. 6). Однако следует отметить, что если в группе А (МВЭ+СА) увеличение показателя произошло в основном за счет увеличения активной подвижности сперматозоидов, то в данной группе – за счет подвижности сперматозоидов категории В (рис. 6).
Патологические формы сперматозоидов. Количество патологических форм сперматозоидов статистически значимо не изменялось к 3-му месяцу вне зависимости от вида лечения (табл. 7). Скорее всего это связано с небольшим сроком (3 мес), прошедшим после операции и/или стимуляции, – морфологические характеристики сперматозоидов еще не могли измениться всего лишь за 1 цикл развития сперматозоидов.
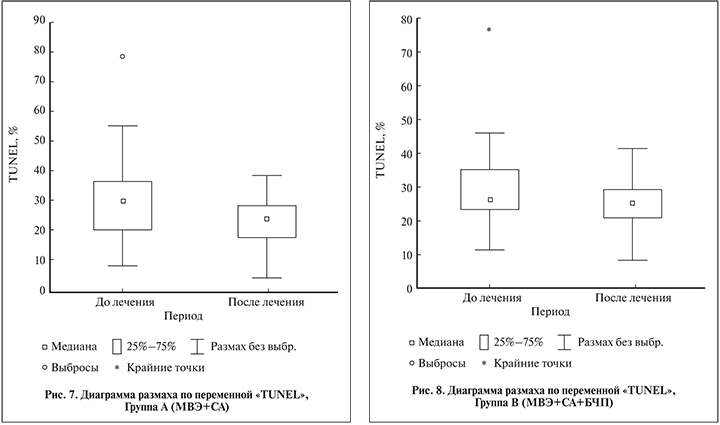
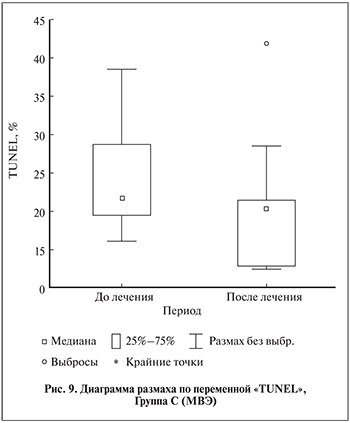
Фрагментация ДНК сперматозоидов. При определении степени фрагментации ДНК сперматозоидов методом TUNEL во всех трех группах лечения к 3-му месяцу отмечено снижение степени фрагментации ДНК сперматозоидов во всех группах исследования (табл. 8). Однако лишь в группе А (МВЭ+СА) такое снижение составило 22,3% и было статистически значимым (p<0,05) (рис. 7–9).
MAR-тест. Статистически значимых изменений показателей МАР-теста зафиксировано не было (p>0,05; табл. 9).
Побочные эффекты лечения. Побочных эффектов фармакотерапии зафиксировано не было.
Из ближайших интра- и послеоперационных осложнений встречались такие, как повреждение ствола яичковой артерии (1 больной), которое удалось ушить с помощью микрохирургической техники; подкожная гематома – 2 больных, лигатурный свищ – 1 больной. Все они были ликвидированы в послеоперационном периоде без повторного вмешательства.
Дополнительная информация. Двенадцать мужчин сообщили о наступлении беременности у супруги на фоне лечения, из них 4 человека из группы А (МВЭ+СА), 5 – из группы В (МВЭ+СА+БЧП) и 3 – из группы С (МВЭ).
Заключение. Назначение нутрицевтиков (СпермАктин Форте®) после микрохирургической варикоцелэктомии – эффективный и безопасный метод адъювантной антиоксидантной терапии мужского бесплодия у больных варикоцеле. Такой подход приводит к быстрому улучшению основных показателей спермограммы (концентрации, подвижности сперматозоидов) в ранние сроки. Прогрессивная подвижность сперматозоидов после микрохирургической варикоцелэктомии возрастает на 21,7% от исходного уровня, причем на фоне приема СпермАктин Форте® это происходит за счет активной подвижности сперматозоидов (категории А) – на 76,7% к 3-му месяцу лечения. Микрохирургическая варикоцелэктомия и применение СпермАктин Форте® способствуют снижению уровня фрагментации ДНК сперматозоидов уже через 3 мес лечения на 22,3%. Комплексная терапия мужского бесплодия при варикоцеле потенцирует эффекты монотерапии (как консервативной, так и хирургической) и приводит к увеличению ее эффективности, сокращению сроков наступления беременности. Прием СпермАктин Форте® не вызывал каких-либо нежелательных явлений. Требуется продолжение исследования в этой области для оценки отдаленных результатов лечения.



