Введение. Нефролитиаз – одно из самых распространенных урологических заболеваний, поскольку больные с камнями мочевыделительной системы составляют 2–3% населения нашей планеты [1], причем около 50% больных уролитиазом имеют камни мочеточника [2]. Трансуретеральный эндоскопический метод лечения камней мочеточника – контактная уретеролитотрипсия (КУЛТ) – получил широкое распространение в ведущих клиниках и урологических центрах нашей страны и за рубежом [1, 3, 4, 10], однако частота осложнений при использовании данного метода варьируетcя от 5 до 9%, а осложнений тяжелого характера – до 1% [1]. Несмотря на совершенствование методики проведения КУЛТ и снижение количества осложнений, обусловленных техникой вмешательства, осложненное течение раннего послеоперационного периода, особенно при полной окклюзии мочеточника, увеличивает потребность в катетеризации мочеточника и назначении анальгетиков, а также увеличивает сроки пребывания больных в стационарах. Существенный вклад в неблагоприятный исход лечения обструктивных уропатий вносит патология снижения экскреторной функции нефрона, приводящая к нарушению функции и патологическим изменениям структуры почек в зависимости от длительности окклюзии мочеточника, способа ее ликвидации, времени восстановления пассажа мочи. Это отражается на показателях водно-электролитного обмена и гормонального обеспечения гомеостатической функции почек. В связи с этим раннее выявление структурно-метаболических изменений в почках, возникающих вследствие развития осложнений мочекаменной болезни (МКБ), а также изменений, вызванных различными подходами в лечении МКБ, является актуальной задачей.
В последнее время существенно повысилось качество диагностики осложнений МКБ благодаря внедрению в диагностическую практику клинико-лабораторных, инструментальных, рентгенурологических, ультразвуковых методов исследования, однако ряд из них инвазивны (пункционная биопсия почек), другие не отражают ранних нарушений (концентрация креатинина сыворотки крови увеличивается спустя 1–2 сут при остром повреждении почек). К одному из перспективных направлений диагностики патологических изменений в почках, активно разрабатываемому в нашей стране и за рубежом, относят исследование молекулярных маркеров почечной дисфункции, рост концентрации которых в крови и моче происходит значительно раньше, чем креатинина и мочевины сыворотки крови. В качестве перспективных маркеров структурного и функционального повреждения почки рассматриваются цистатин С, желатиназоассоциированный липокалин нейтрофилов (NGAL), β2-микроглобулин (β2-МГ), интерлейкин-18 (ИЛ-18) [15, 16].
Цистатин C – белок массой 13 кДа, входящий в семейство ингибиторов цистеиновых протеиназ. Он синтезируется многими клетками организма, постоянно поступает в кровоток, свободно фильтруется в клубочках почек, полностью метаболизируется в проксимальных канальцах и не секретируется [5]. Многочисленные исследования подтвердили высокую диагностическую ценность использования цистатина C в качестве маркера почечной экскреторной дисфункции у взрослых пациентов. Преимущество исследования цистатина C как более раннего по сравнению с креатинином маркера повреждения почек (даже незначительного) обусловлено малой зависимостью его плазменного уровня от мышечной массы, пола и возраста (кроме детей до 1 года), а также практическим отсутствием канальцевой реабсорбции и секреции [6].
NGAL – белок с молекулярной массой 25 кДа, образующийся во всех клетках организма; его синтез возрастает при попадании клеток в «стрессовые» условия. Вероятная биологическая роль NGAL состоит в связывании ионов железа и торможении размножения микроорганизмов в очаге повреждения, угнетении процессов апоптоза и стимуляции пролиферативного и репаративного ответа клеток. Из плазмы крови NGAL свободно фильтруется в клубочках почек, а далее в значительной степени реабсорбируется клетками проксимальных канальцев путем эндоцитоза и расщепляется. В связи с этим экскреция с мочой плазменного NGAL может иметь место только при повреждении проксимальных канальцев почки, ведущем к снижению реабсорбции липокалина и/или увеличению синтеза NGAL в клетках канальцев. Ген NGAL в клетках почек – один из наиболее активируемых вскоре после острой травмы ишемического или токсического повреждения [7, 13, 14]. β2-МГ – белок с молекулярной массой 12 кДа, является частью легкой цепи мембраносвязанных HLA-антигенов. Небольшой размер позволяет β2-МГ проходить через мембрану клубочков, после чего он почти полностью поглощается в проксимальных канальцах. При патологии клубочков замедляется скорость фильтрации β2-МГ, поэтому его концентрация увеличивается в крови и уменьшается в моче. При повреждении канальцев уменьшается количество реабсорбированного β2-МГ, поэтому его уровень в моче растет, а в крови падает [12, 13]. ИЛ-18 секретируется и почти полностью расщепляется в проксимальных канальцах почек, при их повреждении он попадает в мочу и может быть обнаружен в ней. Уровень ИЛ-18 в моче значительно повышается у пациентов с установленным острым почечным повреждением (ОПП), в отличие от инфекции мочевыводящих путей, нефротического синдрома или преренальной азотемии. Повышение уровня ИЛ-18 в моче позволяет констатировать развитие ОПП за 24 ч до подъема уровня креатинина в сыворотке крови и прогнозировать потребность в заместительной почечной терапии. Вместе с тем плазменный уровень ИЛ-18 увеличивается не только при ОПП, но и при других патологических состояниях, таких как ревматоидный артрит, воспалительные заболевания кишечника и системная красная волчанка. Кроме того, повышение уровней провоспалительных цитокинов в моче характерно не только для ОПП, но и для сепсиса с поражением печени и легких, даже в отсутствие повреждения почек [13, 14].

Цель нашего исследования – оптимизация тактики трансуретрального эндоскопического лечения больных уретеролитазом на основе изучения информативности биомаркеров повреждения почечной паренхимы.
Материалы и методы. Проспективный анализ результатов эндоскопического и эндовидеохирургического лечения проведен в отношении 151 пациента с одиночными камнями мочеточника, прошедшего лечение на клинической базе кафедры урологии с курсом ИДПО Башкирского государственного медицинского университета и в Республиканской клинической больнице им. Г. Г. Куватова г. Уфы. Критерии исключения: коагулопатия, беременность, болезни сердечно-сосудистой и дыхательной системы в стадии декомпенсации, обострение инфекционно-воспалительных заболеваний, прием препаратов, подавляющих агрегацию тромбоцитов, аномалии органов мочевой системы с нарушением оттока мочи, хроническая почечная недостаточность в терминальной стадии. У 139 пациентов отмечена неполная окклюзия мочеточника, у 12 – полная (по данным экскреторной урографии). В лечении пациентов с частичной обструкцией мочевыводящих путей использовалась лазерная КУЛТ (75 человек) и пневматическая КУЛТ (64 человека). В отношении всех пациентов с полной окклюзией мочеточника применена лазерная КУЛТ. У пациентов с полной окклюзией мочеточника дополнительно исследована эффективность использования предварительного стентирования до начала оперативного вмешательства. Контролем служили здоровые добровольцы (30 человек). Пневматическую литотрипсию выполняли на аппарате Сalcusplit фирмы «Каrl Storz» с использованием ригидного уретероскопа фирмы «Karl Storz».
В качестве генераторов лазерного излучения использовали аппараты Сalculase фирмы «Karl Storz». Режимы настройки были следующие: частота импульсов – 4–12 Гц, энергия – 1,2 Дж. У всех обследованных осуществляли забор крови и мочи до начала оперативного вмешательства, а также после выполнения КУЛТ через 2 ч, на 1-е и 7-е сутки послеоперационного периода. Определение биомаркеров повреждения почек осуществляли иммуноферментным методом при помощи стандартных тест-систем: NGAL – набор реагентов NGAL Rapid ELISAK it («Bio Porto Diagnostics A/S», Дания), ИЛ-18 – набор Интерлейкин-18-ИФА-БЕСТ (ЗАО «Вектор БЕСТ», Новосибирск), цистатин С – набор реагентов производства «Alfresa Pharma Corporation» (Япония), содержание β2-МГ – тест-набор фирмы «Bio Porto» (Португалия). Для статистической обработки результатов исследования использован пакет программ Statistica 6.0 for Windows (2001). При соответствии распределения признака закону нормального распределения данные представлялись в виде М±σ, для демонстрации статистической значимости различий использован t-критерия с Стьюдента. При отсутствии нормального распределения данных результаты представляли в виде медианы значений и межквартильного интервала (Me [25%; 75%]), достоверность межгрупповых различий оценена по критерию Манна–Уитни. Различия расценивались как значимые при р<0,05. Связи признаков установлены с использованием корреляционного анализа по Спирмену.
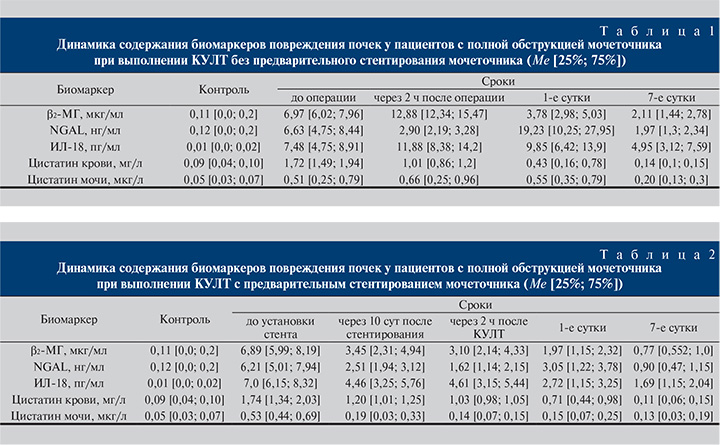
Результаты и обсуждение. Все пациенты с МКБ, включенные в исследование, не имели каких-либо клинико-лабораторных проявлений пиелонефрита, содержание креатинина и мочевины в крови не выходило за пределы нормы. Уже в дооперационном периоде отмечено повышение содержания почти всех исследуемых биомаркеров (за исключением цистатина крови и цистатина мочи, которые повышаются лишь при полной обструкции мочевыводящих путей). Это объясняется вовлечением в процесс при обструктивной уропатии канальцевого аппарата. Конкременты оказывают влияние на уродинамику, приводят к изменениям микроциркуляции, что усиливает активность воспалительных процессов в корковом и мозговом веществе почек.
После выполнения КУЛТ с использованием пневматической и лазерной энергии регистрировалось дальнейшее повышение содержания маркеров повреждения почек, имеющее для каждого показателя свои временные характеристики. Так, к наиболее ранним биомаркерам можно отнести β2-МГ и ИЛ-18, концентрация которых была максимально увеличена уже через 2 ч после оперативного вмешательства, а в последующем постепенно снижалась. Максимальная же концентрация NGAL регистрировалась через сутки после операции. В последующие сроки наблюдения содержание маркеров тубулярного повреждения падало и на 7-е сутки уровень маркеров был существенно ниже дооперационных значений, а при камнях до 5 мм соответствовал значениям здоровых добровольцев.
Нами была установлена зависимость между размером камня и уровнем повышения содержания NGAL и β2-МГ как до начала операции, так и в послеоперационном периоде. Так, в дооперационном периоде при камнях размером до 5 мм различий в содержании NGAL по сравнению со здоровыми добровольцами не было, а содержание β2-МГ было превышено в 2–5 раз (р≤0,01). При более крупных размерах конкрементов уровень NGAL превышал контрольные значения в 10–14 раз (р≤0,001), содержание β2-МГ было превышено в 16–26 раз (р≤0,01). После проведения КУЛТ максимальное повышение содержания NGAL происходило на 1-е сутки и уровень биомаркера был выше значений контроля при размере камня до 5 мм в 10–13 раз (р≤0,0001), от 6 до 10 мм – в 25–30 (р≤0,0001), свыше 10 мм – в 29–37 раз (р≤0,0001). Максимальное повышение содержания β2-МГ наблюдалось через 2 ч после оперативного вмешательства, причем при размере камня до 5 мм – в 12–17 раз (р≤0,01), от 6 до 10 мм – в 25–37 (р≤0,0001), свыше 10 мм – в 45–52 раза (р≤0,0001). На содержание биомаркеров почечного повреждения оказывала влияние и локализация камня (см. рисунок). Эндоурологическое вмешательство при камнях в верхней трети мочеточника приводило к значимому росту уровня NGAL в моче: через 2 ч в 10 раз, через сутки – в 55, через 7 сут – в 25 раз. При камнях в средней трети мочеточника уровень NGAL в моче через 2 ч статистически значимо возрастал в 3 раза, через сутки – в 35, а через 7 сут был выше контроля в 6 раз. Если камень локализовался в дистальных отделах мочеточника, проведение КУЛТ приводило к повышению NGAL через 2 ч в 1,3 раза, через сутки – в 23, через 7 сут – в 7 раз.
Уровень β2-МГ при локализации камня в верхней трети мочеточника до КУЛТ статистически значимо превышал контрольные значения в 33 раза. Через 2 ч после операции при локализации камня в верхней трети мочеточника уровень β2-МГ превышал исходный в 2 раза, в средней трети мочеточника – в 12, в нижней трети – в 9 раз. ИЛ-18 тоже может быть использован как ранний маркер повреждения почек, поскольку наибольший уровень биомаркера отмечен через 2 ч после оперативного вмешательства. Однако содержание биомаркера не всегда определен размером камня и локализацией его в мочеточнике, хотя в ходе исследования регистрировались более высокие значения показателя при средних и крупных конкрементах.
Проведенный статистический анализ эффективности использования пневматической и лазерной КУЛТ по данным содержания биомаркеров в моче показал, что при конкрементах до 5 мм независимо от вида энергии, используемой при выполнении КУЛТ, уровни NGAL, β2-МГ, ИЛ-18 значимо не отличаются и к концу периода наблюдения их содержание практически нормализуется. При средних (6–10 мм) и крупных (свыше 10 мм) конкрементах подъем содержания цитокинов при использовании пневматической КУЛТ был статистически выше и нормализации показателей к 7-м суткам послеоперационного периода не происходило, особенно при камнях, локализовавшихся в верхней и средней третях мочеточника. В связи с этим целесообразно рекомендовать использование лазерной энергии при выполнении КУЛТ проксимальных отделов. Безопасность использования лазерной КУЛТ в наших исследованиях была практически сопоставимой с показателями безопасности при выполнении пневматической КУЛТ.
В настоящем исследовании длительность выполнения лазерной КУЛТ была статистически значимо выше (р≤0,01). В отношении длительности оперативного вмешательства при лазерной и пневматической литотрипсии среди авторов нет единого мнения. Так, по данным R. Ganesamoni и соавт. (2014), она примерно одинакова [18], по данным же H. Kitano и соавт. (2014), длительность лазерной литотрипсии по сравнению с пневматической меньше [17]. В проведенном исследовании нами была предпринята попытка проанализировать содержание биомаркеров у пациентов с подтвержденной по данным экскреторной урограммы полной окклюзией мочеточника, а также выявить изменение уровня биомаркеров при различных тактиках ведения пациентов – выполнении КУЛТ после предварительного дренирования почки и без предварительной установки стента мочеточника. При выполнении КУЛТ в обеих группах использовалась энергия лазера, поскольку проведенные нами исследования пациентов с частичной окклюзией мочеточника доказали большую безопасность использования энергии лазера по сравнению с пневматической.
Установлено, что все исследуемые биомаркеры почечного повреждения демонстрируют высокую информативность у пациентов с МКБ при полной окклюзии мочевыводящих путей (табл. 1, 2). Высокие значения биомаркеров у пациентов с уролитиазом (NGAL≥5 нг/мл, β2-МГ≥6,0 мкг/мл, ИЛ-18≥5 пг/мл, обнаружение цистатина в крови моче) могут служить показанием к стентированию. Предварительное стентирование до проведения КУЛТ позволяет значимо снизить почечное повреждение как канальциевого аппарата, так и клубочков, поскольку в послеоперационном периоде уровни изучаемых биомаркеров были статистически значимо ниже на всех сроках наблюдения.
Заключение. В ходе проведенного исследования у всех обследованных больных уретеролитиазом выявлены признаки повреждения канальцевого аппарата почки, причем степень повреждения зависела от выраженности уродинамических нарушений, что подтверждается статистически значимым увеличением содержания биомаркеров повреждения почек NGAL, β2-МГ и ИЛ-18. Трансуретральная уретеролитотрипсия еще в большей мере способствует повреждению структур нефрона, при этом дополнительным фактором повреждения становится вид применяемой энергии для контактной уретеролитотрипсии. Степень повреждения элементов нефрона при трансуретральной уретеролитотрипсии тем выше, чем более проксимально локализуется конкремент мочеточника и чем больше его размер. Лазерная трансуретральная уретеролитотрипсия по сравнению с пневматической оказывает меньшее повреждающее воздействие на структуры нефрона, что особенно значимо проявляется при размерах камней более 5 мм, локализующихся в верхней и средней третях мочеточника. Выявленные критические значения маркеров повреждения почек при окклюзионном уретеролитиазе в ранние сроки (NGAL≥5 нг/мл, β2-МГ≥ 6,0 мкг/мл, ИЛ-18≥5 пг/мл, появление цистатина в моче и в крови) позволяют рассматривать их как прогностические критерии повреждения структур нефрона, указывающие на необходимость перед проведением КУЛТ предварительного дренирования верхних мочевых путей с целью уменьшения повреждающего воздействия на почки.



