Введение. Инфекции нижних мочевыводящих путей (ИНМП) – одни из самых распространенных бактериальных инфекций человека. Циститом страдают преимущественно женщины, что обусловлено особенностями женского организма. Установлено, что частота ИНМП у женщин в 14 раз больше, чем у мужчин, при этом уже к 30 годам почти половина женщин переносят по крайней мере один эпизод острого цистита [1, 2]. У женщин пременопаузального возраста в качестве основных факторов риска возникновения ИНМП рассматривают отягощенный семейный анамнез, интенсивную половую жизнь, особенно с частой сменой половых партнеров, применение спермицидов; в старшей возрастной группе – эстрогенодефицит, опущение тазовых органов, хроническую задержку мочи, операции на тазовых органах [3, 4]. Особенностью клинического течения ИНМП является их склонность к рецидивированию. Почти у каждой третьей женщины в течение года после первого эпизода ИНМП развиваются рецидивы, причем их частота может достигать 6 и более в течение года [2, 4]. Согласно клиническим рекомендациям, ИНМП относят к категории рецидивирующих при наличии трех эпизодов заболевания в течение года или двух эпизодов в течение 6 мес. [2].
Основными возбудителями острых и рецидивирующих циститов у женщин являются грамотрицательные микроорганизмы семейства Enterobacteriacecae. По данным отечественного исследования «ДАРМИС-2018», неосложненные ИНМП у взрослых в 89,5% случаев вызывают энтеробактерии, при этом доля E. coli составляет 72,3% [5]. Рассматривается также вклад в развитие рецидивирующей ИНМП аэробно-анаэробных бактериальных ассоциаций и вирусов [6].
Повышение эффективности лечения рецидивирующих ИНМП остается актуальной задачей современной урологии. Трудности лечения обусловлены свойствами уропатогенов, особенностями локальной реакции слизистой мочевого пузыря, а также растущей антибиотикорезистентностью возбудителей мочевой инфекции [4, 5, 7–9]. Факторы вирулентности (адгезины, ферментативная активность) обеспечивают фиксацию уропатогенных штаммов E. coli к мембранам зонтичных клеток уротелия с последующим их проникновением в клетки промежуточного слоя и формированием сообществ в виде внутриклеточных резервуаров [9]. Впоследствии из них образуются биопленки, располагающиеся как внутриклеточно, так и на поверхности клеточных мембран. Периодически происходит разрыв биопленок, и бактерии с током мочи попадают в соседние и нижележащие клетки уротелия. Таким образом, за счет циркуляции бактерий в уротелии формируется резервуар E. coli [9].
Устойчивость основных уропатогенов к антибактериальным препаратам считается глобальной проблемой медицины XXI в. Важной причиной антибиотикорезистентности остается продукция бактериями β-лактамаз расширенного спектра (БЛРС). Результаты проведенных в последние годы исследований свидетельствуют, что в РФ возбудителями ИНМП в 27–44% случаев является Е. coli, продуцирующая БЛРС [5, 10, 11]. В свою очередь у 93,3% БЛРС-продуцирующих штаммов E. coli отмечается устойчивость не только к β-лактамным антибиотикам, но и к фторхинолонам и ко-тримоксазолу [11].
К основной группе лекарственных средств для лечения и профилактики рецидивирующих ИНМП относятся антибактериальные препараты [2, 7, 12–14]. В связи с проблемой антибиотикорезистентности в последние годы большое внимание уделяют альтернативным неантибактериальным методам профилактики и лечения рецидивирующих ИНМП – поведенческой терапии, иммунотерапии, назначению пробиотиков, D-маннозы, фитопрепаратов [15–19]. Достичь успеха можно только при устранении потенциальных факторов риска развития ИНМП: нарушения оттока мочи из мочевого пузыря, атрофического вагинита и др. Антибактериальная терапия проводится при неэффективности неантибиотических методов лечения [2, 7]. При выборе антибактериального средства для лечения больных рецидивирующими ИНМП необходимо учитывать спектр антимикробной активности препарата, чувствительность к нему уропатогенов, профиль безопасности лекарственного средства и эффективность предыдущих курсов антибактериальной терапии [2, 7, 8]. Рекомендации по продолжительности назначения антибактериальных препаратов различны – от нескольких недель до года и более [2, 14]. При рецидивах ИНМП, связанных с половым актом, эффективна посткоитальная профилактика как антибактериальными, так и неантибактериальными лекарственными средствами [13, 20]. Среди пероральных антибактериальных препаратов наибольшую активность в отношении E. coli, по данным отечественного исследования «ДАРМИС-2018», продемонстрировали нитрофурантоин и фосфомицин [10]. Эти препараты включены в отечеcтвенные и зарубежные клинические рекомендации как антибактериальные препараты первой линии лечения больных ИНМП [2, 7, 14].
Фосфомицина трометамол длительное время используют как для лечения острого и рецидивирующего цистита, так и для профилактики рецидивов ИНМП. Эффективность препарата доказана результатами многочисленных клинических исследований [12, 21–25]. При этом рекомендуемые схемы лечения различаются длительностью лечения и интервалами между приемом препарата [21, 22].
Цель исследования: оценить эффективность применения фосфомицина трометамола в лечении женщин с рецидивирующей ИНМП.
Материалы и методы. Под наблюдением находились 50 женщин в возрасте от 18 до 65 лет (средний возраст – 44,6±13,2 года) с рецидивирующей ИНМП. Продолжительность заболевания варьировалась от года до 10 лет и в среднем составила 3,8±2,5 года. Количество рецидивов ИНМП в течение последнего года до начала исследования составило в среднем 5,1±1,9. Сексуально активными были 34 (68%) женщины, в постменопаузальном периоде находились 22 (44%) пациентки. В исследование включили женщин старше 18 лет, подписавших информированное согласие на участие в нем, с частотой рецидивов ИНМП не менее 2 раз за 6 мес. или 3 раза за год, предшествовавших началу лечения, и обострением заболевания на момент начала лечения. Все пациентки ранее получали как минимум один курс антибактериальной терапии по поводу ИНМП, завершившийся минимум за 1 мес. до начала лечения. На момент включения в исследование все женщины испытали обострение ИНМП, которое проявлялось клиническими симптомами и лейкоциурией (более 10 лейкоцитов в поле зрения в общем анализе мочи). Критерии невключения: осложненная инфекция мочевыводящих путей, острый или хронический пиелонефрит в активной фазе, другие заболевания, проявляющиеся расстройствами мочеиспускания (нейрогенные дисфункции нижних мочевыводящих путей, синдром хронической тазовой боли, гиперактивность мочевого пузыря и др.), беременность или период лактации, полиурия, а также повышенная чувствительности к фосфомицину трометамолу.
Всем пациенткам был назначен препарат Фосфомицин Эспарма (ФЭ, «Эспарма ГмбХ», Германия) в дозе 3 г (в пересчете на фосфомицин) однократно каждые 10 дней в течение 3 мес. Рекомендовано принимать ФЭ на ночь натощак, непосредственно после приготовления жидкой лекарственной формы препарата, для чего содержимое 1 пакетика с порошком растворяли в 150–200 мл воды.
До лечения всем пациенткам проведено тщательное обследование, включившее сбор анамнеза заболевания, оценку жалоб, физикальное обследование, лабораторные исследования, в т.ч. общий анализ мочи и бактериологическое исследование средней порции утренней мочи. Для исключения инфекций, передающихся половым путем, выполняли ПЦР-диагностику в соскобах из уретры, влагалища и шейки матки с целью выявления C. trachomatis, M. genitalium, M. hominis. Выраженность симптомов оценивали с помощью шкалы оценки симптомов острого цистита ACSS [26] и данных дневников мочеиспускания, которые пациентки заполняли в течение 3 сут. Клинические и лабораторные показатели оценивали на 3-й день после первого приема ФЭ, а затем через 1, 3 и 6 мес. от начала лечения. На каждом сроке пациентки заполняли опросник ACSS, дневники мочеиспускания, им выполняли общий анализ мочи, а на визитах через 3 и 6 мес. после начала исследования проводился и микробиологический анализ мочи. Объективные данные дополняли субъективной оценкой пациентками эффективности проводимой терапии по 5-балльной шкале: 1 балл – отсутствие эффекта, 2 – незначительное улучшение, 3 – умеренное улучшение, 4 – значительное улучшение, 5 баллов – излечение.
Переносимость лечения оценивали по наличию нежелательных явлений, выраженность которых пациентки оценивали по 3-балльной шкале: 0 баллов – отсутствие нежелательных явлений, 1 – легкая степень, 2 – умеренная степень, 3 балла – тяжелая степень.
Продолжительность периода наблюдения составила 6 мес., из которых первые 3 мес. проводилось лечение.
При развитии рецидива ИНМП (клинические и лабораторные проявления инфекционно-воспалительного процесса в мочевыводящих путях) больных исключали из исследования.
Систематизацию, обработку и статистический анализ материалов исследования проводили с помощью компьютерной программы STATISTICA 10 En (StatSoft, Inc.) с использованием критерия Хи-квадрат, точного метода Фишера, t-критерия. Различия считали достоверными при уровне значимости р≤0,05. Средние значения показателей в тексте указывали со средним квадратическим отклонением (M±σ).
Результаты и обсуждение. До начала лечения у 41 (82%) пациентки при микробиологическом исследовании мочи была выявлена бактериурия в титре ≥1000 КОЕ/мл. Чаще всего выявляли E. coli – у 30 (73,2%) пациенток; значительно реже другие энтеробактерии: K. pneumoniae – у 5 (12,2%), E. faecalis – у 4 (9,8%) пациенток. S. aureus в клинически значимом титре был выявлен только в 1 (2,4%) случае.
Пациентки отмечали уменьшение выраженности симптомов цистита уже на следующий день после первого приема ФЭ, к 3-м суткам от начала лечения сумма баллов по шкале ACSS уменьшилась с исходных 9,2±2,1 до 1,4±1,0 (p<0,001), средняя частота мочеиспусканий снизилась с 12,3±2,3 до 7,5±1,4 (p<0,05). Средняя оценка эффективности лечения на 3-е сутки после его начала составила 4,2±0,7 балла. В последующие 3 мес. лечения клинические результаты практически не отличались от достигнутых к 3-му дню от начала терапии (табл. 1).
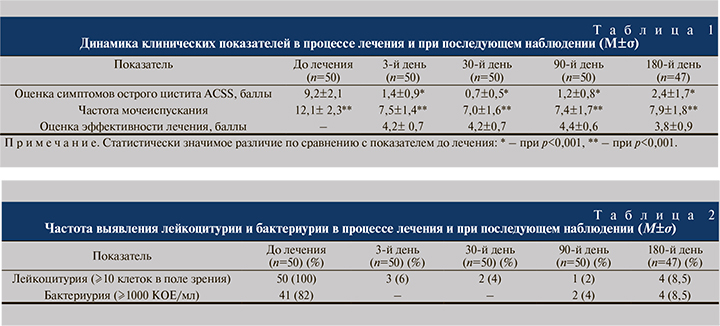
Клиническая эффективность проводимого лечения подтверждалась результатами лабораторных исследований (табл. 2). На 3-е сутки после первого приема ФЭ лейкоцитурия выявлена только у 3 (6%) женщин. В процессе лечения частота выявления лейкоцитурии сохранялась примерно на одном уровне и только через 3 мес. после его окончания выросла до 8,5%. Частота бактериурии по результатам микробиологического исследования снизилась с исходных 82% до 4% к окончанию лечения.
В течение 3-месячного периода лечения не зарегистрировано ни одного клинического рецидива ИНМП. В ходе последующего наблюдения в течение 3 мес. у 3 (6%) пациенток отмечено обострение ИНМП, что было расценено как рецидив заболевания. У женщин развилась характерная клиническая картина дизурии, в общем анализе мочи была выявлена лейкоцитурия. Необходимо отметить, что рецидив у этих пациенток возник в интервале от 47 до 73 дней после окончания курса лечения, в среднем через 57,8±9,2 дня.
У всех 3 женщин рецидив ИНМП был связан с половым актом, 2 пациентки находились в менопаузальном периоде.
Переносимость лечения была удовлетворительной. За период лечения нежелательные явления, связанные с приемом препарата, были отмечены у 10 человек. Самым частым нежелательным явлением была диарея – 6 (12%) пациенток, реже изжога – 3 (6%), дисбиоз влагалища – 3 (6%), тошнота – 2 (4%), кожная сыпь – 1 (2%) больных. Несовпадение общего количества нежелательных проявлений с числом больных, у кого они были зарегистрированы, связано с тем, что у 1 пациентки были отмечены 3 нежелательных проявления, у 3 – по 2. Из 15 зарегистрированных нежелательных явлений 12 (80%) соответствовали легкой степени, 3 (20%) – умеренной. Ни одно из нежелательных явлений не потребовало прекращения лечения. Субъективная оценка пациентками выраженности побочных явлений подтверждает хорошую переносимость терапии. Средняя оценка больными интенсивности нежелательных явлений составила 0,4±0,6 балла по 3-балльной шкале.
Таким образом, результаты проведенного исследования показали высокую эффективность ФЭ, назначаемого по 3 г каждые 10 дней в течение 3 мес. В период лечения ни у одной женщины не возникло рецидива ИНМП. Предотвратить развитие ИНМП в последующие 3 мес. после окончания прием ФЭ удалось 94,5% больных.
Полученные в настоящем исследовании результаты согласуются с данными ранее проведенных клинических исследований, свидетельствующих об эффективности фосфомицина в лечении и профилактике рецидивирующих ИНМП [23–25].
Необходимо отметить уникальное долголетие клинической эффективности фосфомицина, который относится к «старым» антибиотикам, поскольку был синтезирован еще в 1969 г. Исходно получена кальциевая соль фосфомицина, и только потом синтезирован фосфомицина трометамин, более известный как фосфомицина трометамол. Именно этот препарат и вошел в широкую клиническую практику.
Фосфомицин является бактерицидным антибиотиком и имеет широкий спектр антимикробной активности в отношении как грамотрицательных, так и грамположительных микроорганизмов. Механизм бактерицидного действия фосфомицина основан на ингибировании синтеза клеточной стенки бактерий путем необратимого инактивирования фермента пирувилтрансферазы. Это первый этап синтеза пептидогликана – компонента клеточной стенки практически всех бактерий. Кроме того, фосфомицин способен ингибировать процесс адгезии бактерий к слизистой мочевого пузыря и, что выделяет его из ряда других антибактериальных препаратов, обладает иммуномодулирующим эффектом, подавляя выработку фактора некроза опухоли α, интерлейкинов-1β, -2, -8 и др., а также улучшая фагоцитарную активность нейтрофилов [27].
Несмотря на длительное использование фосфомицина в клинической практике, резистентность E. coli к нему не превышает 1–4% [2, 5, 14]. Устойчивость к фосфомицину связывают с наличием генов fosA и fosB у грамотрицательных и грамположительных микроорганизмов соответственно [28].
Фосфомицина трометамол всасывается из просвета желудочно-кишечного тракта, при этом биодоступность пероральной формы препарата составляет 34–58% [29]. Препарат гидрофилен и незначительно связывается с белками, выводится исключительно посредством клубочковой фильтрации, причем его клиренс хорошо коррелирует со скоростью клубочковой фильтрации. После однократного приема 3 г фосфомицина максимальная концентрация в сыворотке (Cmax) составляет 22–32 мкг/мл и достигается примерно через 2–2,5 ч, а период полувыведения препарата составляет 5,7 ч [29]. Пиковые концентрации в моче достигают примерно 4000 мкг/мл, концентрация более 100 мкг/мл сохраняется в течение 48 ч, что служит фармакокинетической основой однократного приема фосфомицина [30]. Концентрация фосфомицина в моче выше MПК90 для E. coli (4 мкг/мл) сохраняется до 80 ч [30].
В целом фосфомицин имеет благоприятный профиль безопасности, при этом к наиболее частым нежелательныи явлениям относятся диспепсические расстройства. Их частота варьируется от 2 до 6%. Пожилым пациентам и больным с нарушением функции почек или печени коррекция дозы фосфомицина не требуется.
В связи с тем что патентная защита оригинального фосфомицина трометамола закончилась, на российском рынке появилось несколько генерических форм данной субстанции. Как известно, генерический препарат представляет собой лекарственный продукт с установленной терапевтической взаимозаменяемостью с оригинальным лекарственным средством подобного состава и выпускаемый без лицензии разработчика оригинального препарата. При этом при его производстве может использоваться другой по сравнению с оригинальным препаратом технологический процесс, что может отражаться на количестве и составе примесей. В итоге качество, в конечном счете – эффективность и безопасность препарата в значительной степени зависят от компании-производителя. В настоящем исследовании мы использовали препарат Фосфомицин Эспарма, производимый известной немецкой фармацевтической компанией, гарантирующей его качество.
Таким образом, результаты проведенного исследования подтвердили, что фосфомицин служит препаратом выбора для лечения и профилактики рецидивирующих ИНМП у женщин. Назначение фосфомицина по предложенной схеме показало высокую клиническую эффективность и хорошую переносимость.


