Введение. С момента первого упоминания в 1890 г. резекция почки эволюционировала из «операции отчаянья» в «операцию выбора» [1]. Еще недавно это вмешательство было вынужденной мерой при билатеральном опухолевом поражении или для больных с единственно функционирующей почкой. Случаи работающей, но скомпрометированной контралатеральной почки, равно как и сопутствующая патология, грозящая утратой ее функции в будущем (например, сахарный диабет), расценивались как относительные показания к операции. При здоровой противоположной почке резекция предполагалась лишь в избирательных, элективных, случаях [2, 3]. Сегодня органосберегающие технологии приоритетны, все чаще применяются, а их эффективность и безопасность подтверждены многочисленными исследованиями [4, 5]. Современные клинические рекомендации предусматривают возможность сохранения органа в случае резектабельности опухоли [6]. Однако это понятие весьма субъективно, ведь каждый хирург воспринимает трудности ее удаления по-своему и в рамках своих возможностей. Одно дело – экстракортикальное образование передней поверхности нижнего сегмента почки и совсем другое – полностью эндофитное или интрасинусное. Принципы доказательной медицины требуют объективизации получаемых данных для корректности интерпретации и сравнения по учетным признакам в сопоставимых группах [7]. Подобный подход был реализован в номограмме «R.E.N.A.L.», где на основании радиологических анатомических особенностей (в зависимости от размера, характера роста, взаимоотношений с чашечно-лоханочной системой, синусом почки и ее магистральными сосудами) опухоли присваивается определенное число баллов. Их сумма, в шкале от 4 до 12, определяет как непосредственно резектабельность, так и периоперационные риски. При нефрометрическом индексе R.E.N.A.L. >9 хирург получает индульгенцию на нефрэктомию, ибо резекция в таких случаях считается трудновыполнимым вмешательством, сопряженным с высокой риском развития как интра-, так и послеоперационных осложнений [8, 9]. Сообщения о лапароскопических резекциях при таких образованиях носят эксклюзивный характер и, как правило, освещают лишь отдельные случаи из практики. Обзор литературы показывает, что чаще всего эти редкие операции выполняются открыто или с роботической ассистенцией [9, 10].
Цель исследования: оценить эффективность и безопасность лапароскопической резекции почки при сóлидных образованиях ее паренхимы с нефрометрическим индексом R.E.N.A.L. 10 и выше.
Материалы и методы. Проведено одноцентровое ретроспективное сравнительное исследование посредством сплошной выборки. Критерии включения: все пациенты с опухолями почки, подвергшиеся лапароскопической резекции в урологическом отделении ЧУЗ «КБ “РЖД-Медицина” г. Нижний Новгород» с января 2015 по январь 2020 г. Критерии исключения: билатеральные или мультифокальные образования; резекция единственной или единственно функционирующей, а также подковообразной почки; одновременное ипсилатеральное сочетание парциальной нефрэктомии с пиелолитотомией. Каких-либо ограничений не устанавливали. Группу исследования («R.E.N.A.L.10+») составили пациенты с новообразованиями R.E.N.A.L.≥10, группу сравнения («R.E.N.A.L.≤9») – все остальные пациенты.
Критериям включения соответствовали 109 больных, из которых 45 (41,3%) женщин. Средний индекс массы тела (ИМТ) в сводной когорте составил 29,5±4,4 кг/м2, возраст – 54,6±11,5 (от 23 до 78) лет, размер образования в максимальном измерении – 43 [33; 52] мм. Опухоли левой почки иссечены у 61 (56%) пациента, причем у 30 (49,18%) из них трансмезентериально. Резекция в условиях тепловой ишемии выполнена 78 (71,56%) раз, без нее – 25 (22,94%).
В отношении оставшихся шестерых использован сегментарный вариант (5,5%). Общая характеристика групп исследования и сравнения приведена в табл. 1.

Группа исследования «R.E.N.A.L.10+» сформирована из 40 пациентов в возрасте 53,1±11,9 года (см. табл. 1). Медиана размера опухоли в максимальном измерении составила 50 [43; 60,3] мм. Семеро (17,5%) человек оперированы в условиях нулевой ишемии. Регионарная лимфаденэктомия реализована в 30% случаев. Симультанные операции (аллопластика при паховых и вентральных грыжах, холецистэктомия, резекция печени, иссечение кист придатков матки и миомэктомия) предприняты в отношении каждого пятого. Группу сравнения «R.E.N.A.L.≤9» составили 69 человек, сопоставимых с группой исследования по основным характеристикам (см. табл. 1), за исключением трех. Так, в группе «R.E.N.A.L.10+» размер опухоли был достоверно больше, лимфодиссекция выполнялась чаще и более половины больных опухолями левой почки оперированы с использованием трансмезентериального доступа (р<0,05 для всех). Однако эти различия вполне понятны и явились одним из критериев сравнительного анализа. Так, высокий нефрометрический индекс коррелирует с размером образования и его локализацией. В группе исследования подавляющее большинство резекций проводилось в воротах почки. В подобных условиях при левосторонней локализации трансмезентериальный доступ особенно эргономичен, поэтому использовался достоверно чаще. С другой стороны, принимая во внимание характер опухолевого роста в группе «R.E.N.A.L.10+», обусловливавший риск конверсии лапароскопической резекции в нефрэктомию, у трети этих пациентов выполнена регионарная лимфаденэктомия. Последняя обеспечила, с одной стороны, максимально корректное стадирование, с другой – наиболее безопасную диссекцию почечных сосудов и контроль над ними.
Оценивали частоту развития и структуру интра- и послеоперационных осложнений, причины конверсий доступа, объем кровопотери и сроки ишемии, продолжительность операции и стационарного лечения больных.
Полученные результаты сведены в единую компьютерную базу приложения «IBM SPSS 22.0». При нормальном распределении признаков в выборке анализ проводили методами параметрической статистики, а результаты представляли в виде среднего арифметического и стандартного отклонений (М±SD). Для их сравнения использовали критерий Стьюдента. В случае отклонения от нормального распределения использовали непараметрический анализ Манна–Уитни, а данные представляли в виде медианы и 25-го и 75-го перцентилей (Ме [25р; 75р]), указывая минимальные и максимальные значения. Качественные признаки сопоставляли с помощью критерия χ2 Пирсона. Различия считали статистически значимыми при р<0,05. Для изучения онкологических результатов использовали метод Каплана–Мейера. При оценке безрецидивной выживаемости цензурированными считали случаи дожития пациентов до окончания 36-месячного срока наблюдения в отсутствие рецидива. В качестве нецензурированных принимали его развитие до истечения трех лет наблюдения. Рассматривали исходы как в общей когорте, так и в группах, сформированных в зависимости от нефрометрического индекса R.E.N.A.L. Зависимость функции риска изменения длительности выживаемости от влияния независимых факторов определяли посредством регрессионного анализа Кокса пошаговым включением статистически значимых предикторных переменных. Для оценки статистической значимости полученных моделей использовали критерий χ2. Характер влияния переменных интерпретировался по значениям отношения рисков (Hazard ratio, HR). Для верификации достоверности различий выживаемости при разбивке общей выборки на группы по значениям R.E.N.A.L. использовали лог-ранговый критерий Мантела–Кокса и критерий Бреслау. Изучали влияние ряда факторов на длительность безрецидивной выживаемости. В качестве предполагаемых предикторов использовали показатели R.E.N.A.L., пол, возраст, индекс массы тела, ишемию, кровопотерю, уровень падения гемоглобина после операции, размер опухоли и переход клинической стадии cT1–2 в патоморфологическую pT3а.
Результаты. Летальности, конверсий доступа в лапаротомию и трансформаций в нефрэктомию удалось избежать во всех наблюдениях, равно как положительных хирургических краев и гемотрансфузии. В сводной когорте больных время операции составило 2 ч 20 мин при кровопотере 250 мл.
Подавляющее большинство резекций выполнено на фоне тепловой ишемии длительностью примерно 18 мин. Интраоперационные осложнения возникли в 3,7% случаев и были купированы интракорпорально, не повлияв на сроки выздоровления. Послеоперационные осложнения Clavien III отмечены у 4 (3,7%) пациентов. Медиана стационарного пребывания больных в клинике – 7 сут. По результатам гистологического исследования удаленных препаратов практически у каждого пятого верифицировано доброкачественное образование, а из 88 пациентов со злокачественными опухолями переход из стадии сТ1–2 в pТ3а произошел у 6 (6,82%). Ни в одном удаленном лимфоузле метастазов не обнаружено. Рецидив или прогрессирование заболевания имели место в 5,5% наблюдений; 3 (2,8%) пациента погибли от основного заболевания. Сроки наблюдения за больными варьировались от 6 мес. до 5 лет. Результаты межгруппового сравнительного анализа представлены в табл. 2.
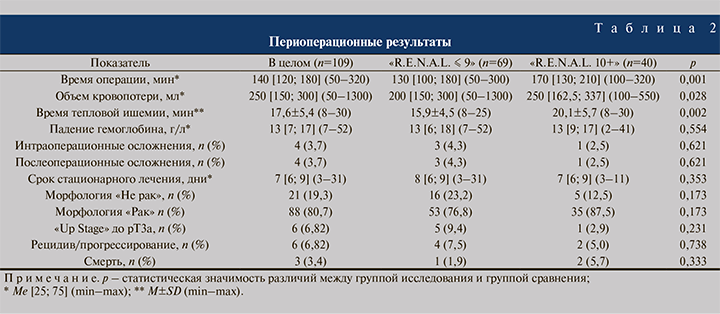
Как видно из табл. 2, резекция почки в группе «R.E.N.A.L.10+» сопровождалась достоверно более продолжительным временем операции и тепловой ишемии при бóльшем объеме кровопотери. Ни по каким другим критериям статистически значимых различий с группой «R.E.N.A.L.≤ 9» обнаружить не удалось.
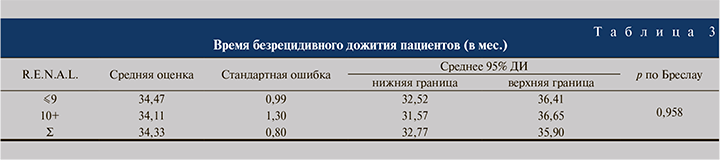
При оценке безрецидивной выживаемости в общей группе пациентов доля цензурированных случаев составила 93,2%. Среднее время безрецидивного дожития для всех пациентов составило 34,33±0,80 мес. (95% доверительный интервал [ДИ]: 32,76–35,90). Анализ Каплана–Мейера продемонстрировал более чем 90%-ную вероятность дожития до окончания 36-месячного срока наблюдения среди всех оперированных, а при сопоставлении групп эти значения превысили 90% и достоверно не различались (табл. 3).
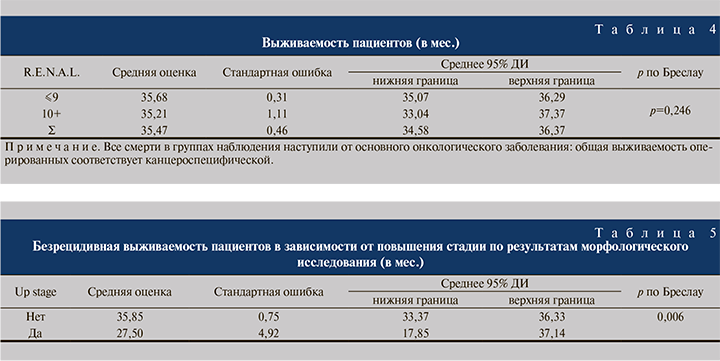
Помимо безрецидивного дожития проведена оценка выживаемости пациентов с учетом летальных исходов, случившихся в течение 3 лет после операции. Все смерти до истечения этого периода наблюдения отнесены к нецензурированным. Поскольку все три печальных события в группах наблюдения наступили от основного онкологического заболевания, общая выживаемость исследуемых соответствует канцероспецифической. В сводной когорте доля цензурированных случаев составила 96,6%, среднее время дожития – 35,47±0,46 мес. (95% ДИ: 34,58–36,37). При сравнении групп пациентов получены сопоставимые данные (табл. 4).
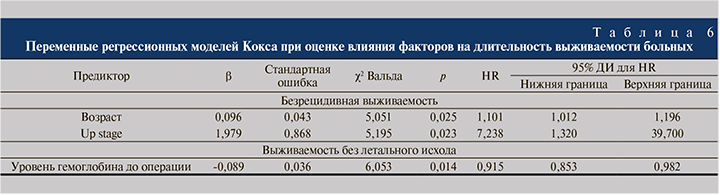
Также была проведена оценка выживаемости пациентов в зависимости от повышения стадии сТ1–2 до pT3a по результатам морфологического исследования удаленных препаратов. При этом из-за небольшого количества летальных исходов удалось оценить только длительность безрецидивного дожития. Доля цензурированных случаев в отсутствие «up stage» составила 95,1%, в то время как при наличии трансформации стадии – 66,7%. Отмечены статистически значимые различия точечных оценок длительности безрецидивного дожития в отсутствие повышения стадии по сравнению с пациентами, у которых она произошла: 35,85±0,75 против 27,50±4,92 мес. (р=0,006; табл. 5).
Таким образом, вероятность достижения 3-летней безрецидивной выживаемости в отсутствие «up stage» находится на уровне 95%, в то время как при его наличии – порядка 66%. Для длительности дожития в регрессировании Кокса вне зависимости от нефрометрического индекса статистически значимыми параметрами оказались только «up stage» и возраст (табл. 6). Для безрецидивной выживаемости в качестве наиболее статистически значимого параметра стал переход из стадии сТ1–2 в рТ3а (НR=7,23, 95% ДИ: 1,320–39,700). Кроме того, определенный вклад во время дожития внес и возраст пациентов: чем старше больной, тем более выражена тенденция к увеличению вероятности безрецидивного дожития (HR=1,101, 95% ДИ: 1,012–1,196). Из рассмотренных предикторов статистически значимую роль для выживаемости без летального исхода сыграл только надир гемоглобина до операции. Более низкий его предоперационный уровень знáчимо снижал вероятность 3-летней выживаемости (HR=0,915, 95% ДИ: 0,853–0,982). Ни размер опухоли, ни значение R.E.N.A.L. не оказали влияния, равно как и объем кровопотери или ишемия.
Обсуждение. Резекция почки является, пожалуй, одной из самых непредсказуемых операций: риски трансформации в нефрэктомию, неконтролируемого кровотечения, мочевых затеков и прочих проблем подстерегают хирурга на каждом шагу. При сложнорезектабельных новообразованиях вероятность развития периоперационных осложнений особенно высока. Именно поэтому такие опухоли чаще расцениваются как показание к нефрэктомии или в лучшем случае – к открытой резекции [8, 9].
Обратившись к доступной литературе, мы обнаружили похожую работу сотрудников урологической клиники НМИЦ онкологии им. Н. Н. Блохина [9]. В этом исследовании изучались непосредственные функциональные и онкологические результаты резекций почки пациентов с опухолямя паренхимы с высоким нефрометрическим индексом. Приняв за последний значение R.E.N.A.L.≥7, авторы проследили исходы лечения 122 таких пациентов, оперированных традиционно – «открыто». Из них доля обладателей новообразования R.E.N.A.L.≥10 составила 23,8% (29 человек). Практически все (98,4%) резекции в сводной когорте выполнены на фоне тепловой ишемии, медиана продолжительности которой составила 23 мин (от 6 до 47 мин). Сама операция длилась в среднем 2,5 ч при объеме кровопотери 600 мл. Гемотрансфузия потребовалась во время 15 (12,2%) резекций почки. Интраоперационные осложнения зафиксированы в 4,9% случаев, послеоперационные осложнения Clavien III – в 7 (5,7%). Мочевые затеки отмечены у 12 больных, но лишь трижды возникла необходимость внутреннего стентирования. Авторы не оценивали продолжительность стационарного пребывания и не рандомизировали больных, но в целом продемонстрировали схожие с нашими периоперационные и онкологические показатели.
Результаты настоящего исследования говорят о принципиальной возможности исполнения лапароскопической резекции почки даже при образованиях R.E.N.A.L.≥10. Безусловно на это уходит больше времени и сил, чем при стандартных операциях, но, рассмотрев сухую статистику цифр с точки зрения персонифицированного подхода к лечению пациентов этой непростой категории, следует отметить следующее. Лапароскопическая резекция почки в группе пациентов «R.E.N.A.L.10+» отнимала в среднем лишние 40 мин операционного времени, что, на наш взгляд, не критично ни для больного, ни для хирурга. Среди тех, кому вмешательство проведено в условиях тепловой ишемии, ее достоверно бóльшая продолжительность не выходила за рамки безопасных сроков и не превышала 30 мин при средних значениях 20,1±5,7 мин. Кроме того, четверть пациентов оперирована на фоне сегментарной ишемии или вовсе без нее. Сравнивая средний объем кровопотери, показатели которого разнились достоверно, необходимо заострить внимание на его медианном значении в группах 200 и 250 мл в отсутствие различий уровней падения гемоглобина. Что касается интраоперационных осложнений, количественно их оказалось больше в группе «R.E.N.A.L.≤9». У одного пациента ожог мочеточника неостывшим элементом ультразвукового диссектора был расценен как критичный – выполнена резекция этого участка с формированием анастомоза на внутреннем стенте. Другой больной потребовалось ушивание десерозированной на этапе мобилизации стенки ободочной кишки, а у третьего пациента кровотечение из травмированной селезенки остановлено спрей-коагуляцией. У пациентки в когорте «R.E.N.A.L.10+» произошел отрыв надпочечниковой вены у места впадения в почечную, наложен интракорпоральный сосудистый шов; общий объем кровопотери, включая этап иссечения опухоли, составил 500 мл.
Все описанные инциденты исчерпаны по мере их возникновения интракорпорально и не привели ни к каким проблемам в последующем. Послеоперационное осложнение Clavien III в группе «R.E.N.A.L.10+» возникло только у одного пациента. Молодой человек с крупной опухолью ворот левой почки (R.E.N.A.L.12) без осложнений перенес энуклеорезекцию, во время которой группа чашечек, подлежавшая удалению с препаратом, обрабатывалась пластиковыми клипсами. Нефрорафия не выполнялась, а раневой дефект укрыт гемостатической пластиной (видео операции доступно по ссылке: https://youtu.be/1254WSFMxJ0). На 6-е сутки обычного послеоперационного периода выписан на амбулаторное лечение по месту жительства, но боли в пояснице и повышение температуры тела по прошествии нескольких дней послужили причиной обращения к врачу. При ультразвуковом сканировании верифицирован мочевой затек, дренированный перкутанно, мочевые пути – внутренним стентом с последующим выздоровлением. Через 1,5 года после операции контрольное обследование подтвердило нормальную функцию почки в отсутствие рецидива и прогрессирования заболевания.
В группе сравнения послеоперационные осложнения возникли у троих больных. У одного из них развился мочевой затек. Мужчина перенес идентичную описанной выше операцию, выполненную трансмезентериально в связи с опухолью ворот почки. Кстати сказать, нефрометрический ее индекс – «9», а осложнение купировано аналогичным образом и с тем же исходом, но в нашем стационаре. У другой пациентки, чей ИМТ достиг 45 кг/м2, нагноение раны извлечения препарата потребовало вскрытия и дренирования абсцесса под наркозом. Третий оперирован повторно в связи с ранней спаечной тонкокишечной непроходимостью, развившейся на 5-е сутки, – выполнены релапароскопия и адгезиолизис с благоприятным исходом.
При оценке удовлетворительных онкологических результатов, не различавшихся в группах, следует акцентировать внимание на том, что у 12,5% больных, перенесших лапароскопическую резекцию почки при опухолях R.E.N.A.L. ≥10, морфологически верифицированы доброкачественные новообразования. А ведь это были претенденты на нефрэктомию. В целом среди всех оперированных этот показатель составил 19,3%, у пациентов с невысоким нефрометрическим индексом – 23,2%. Более того, несмотря на отсутствие статистически значимых различий, переход клинической стадии СТ1–2 в патоморфологическую РТ3А случался чаще именно в группе «R.E.N.A.L.≤9», в пропорции 5:1. Это могло бы служить дополнительным основанием в пользу органосберегающего вмешательства в отношении пациентов со «сложными» опухолями.
Заключение. Безусловно, «открытая» резекция почки лучше минимально инвазивной нефрэктомии, а попытка сохранения органа должна предприниматься при любой возможности в рамках здравого смысла и онкологической безопасности. Однако наше исследование демонстрирует эффективность и безопасность лапароскопической резекции, в том числе и при опухолях R.E.N.A.L.≥10.


