Под нейрогенными дисфункциями нижних мочевыводящих путей (НДНМП) понимают расстройства, связанные с накоплением мочи и опорожнением мочевого пузыря, развивающиеся вследствие неврологических заболеваний [1]. Значимость НДНМП обусловлена их высокой частотой, существенным ухудшением качества жизни больных, риском развития тяжелых, зачастую жизнеугрожающих осложнений и значительной экономической нагрузкой на систему здравоохранения [2]. Согласно экспертной оценке, в Российской Федерации насчитывается около 910 тыс. пациентов с НДНМП, а текущие экономические затраты на их лечение составляют 84,9 млрд руб. [3].
Нейрогенная детрузорная гиперактивность
Одним из наиболее частых уродинамических диагнозов у пациентов с НДНМП является нейрогенная детрузорная гиперактивность (НДГ), характеризующаяся наличием непроизвольных сокращений детрузора в фазу наполнения [4]. Клинически НДГ проявляется нейрогенной гиперактивностью мочевого пузыря, к симптомам которой относят ургентные позывы на мочеиспускание с ургентным недержанием мочи или без него, обычно в сочетании с учащением дневного и ночного мочеиспускания в отсутствие инфекции мочевыводящих путей или других явных неневрологических заболеваний [4]. Ургентное недержание мочи является частым клиническим проявлением НДГ. Результаты опубликованного A. Ruffion и соавт. (2013) мета-анализа свидетельствуют, что недержание мочи, обусловленное НДГ, развивается у более чем половины больных с травмой спинного мозга (52%) и рассеянным склерозом (51%) [5]. Эпидемиологические данные о высокой распространенности указанных заболеваний, достигающей 280–316 и 800 на 1 млн взрослого населения для травмы спинного мозга и рассеянного склероза соответственно [2, 6, 7], свидетельствуют об актуальности данной проблемы.
Симптомы гиперактивного мочевого пузыря (ГМП), и в первую очередь ургентное недержание мочи, крайне отрицательно влияют на качество жизни больных [8]. Установлено, что нейрогенная гиперактивность мочевого пузыря оказывает более выраженное негативное влияние на качество жизни пациентов, чем идиопатическая форма заболевания [9].
Важнейшим аспектом клинического течения НДНМП вообще и НДГ в частности является высокий риск развития осложнений, среди которых наиболее существенное значение имеет нарушение функции верхних мочевыводящих путей. Основную роль в развитии данного осложнения играют повышение внутрипузырного давления, снижение растяжимости стенки мочевого пузыря и уменьшение его емкости [10]. Установлено, что НДГ чаще всего развивается у пациентов с неврологическими заболеваниями, приводящими к супрасакральным поражениям центральной нервной системы [11]. Так, при спинальной травме НДГ выявляют у 65% пациентов с поражением цервикального отдела, у 78% – торакального отдела и у 49% – поясничного отдела спинного мозга [12]. Частота выявления НДГ у пациентов с рассеянным склерозом составляет 65%, болезнью Паркинсона – от 45 до 93%, множественной системной атрофией – 35–56% [12, 13]. При сочетании НДГ и детрузорно-сфинктерной диссинергии, развивающихся у больных с супрасакральными спинальными поражениями, отмечается наиболее высокое внутрипузырное давление и, соответственно, наибольший риск развития осложнений со стороны верхних мочевыводящих путей.
Фармакотерапия нейрогенной детрузорной гиперактивности
При лечении всех НДНМП, включая НДГ, основными задачами являются защита верхних и восстановление функции нижних мочевыводящих путей, обеспечение удержания мочи или обеспечения контроля над недержанием мочи, что в конечном итоге должно вести к улучшению качества жизни больных [1, 14]. Обеспечение сохранности функции почек рассматривается как приоритетная цель при планировании лечебных мероприятий у больных с НДНМП. Ведущее значение при этом придается удержанию величины детрузорного давления в безопасных пределах как в фазу наполнения, так и в фазу опорожнения цикла мочеиспускания. В качестве независимых факторов риска поражения верхних мочевыводящих путей у неврологических больных рассматривают высокое максимальное детрузорное давление в фазу опорожнения (>80 см H2O у мужчин и >60 см H2O у женщин), высокое детрузорное давление в точке утечки мочи (>40 см H2O), низкую растяжимость мочевого пузыря (<20 мл/см H2O), уменьшение максимальной цистометрической емкости (<200 мл) и увеличение объема остаточной мочи (>100 мл или более 30% от функциональной емкости мочевого пузыря) [15, 16].
Антихолинергическая терапия является первой линией лечения больных с нейрогенной детрузорной гиперактивностью [17–19]. Используемые лекарственные препараты препятствуют активации М-холинорецепторов нейромедиатором ацетилхолином, а основными целями их назначения являются снижение сократительной активности детрузора и повышение функциональной емкости мочевого пузыря [17, 20, 21]. В мочевом пузыре находятся два субтипа М-холинорецепторов – М2- и М3-, причем плотность М2-рецепторов существенно, примерно в 4 раза, больше, чем М3-рецепторов [22]. У здоровых и пациентов с идиопатическими дисфункциями мочевыводящих путей сокращения миоцитов детрузора обеспечиваются за счет активации M3-холинорецепторов. Однако при НДНМП наблюдается увеличение плотности и, что наиболее важно, изменение функции М2-холинорецепторами [23]. Вследствие повышения олинорецепторов, которые начинают уже непосредственно участвовать в обеспечении сокращений детрузора наряду с М3-холинорецепторами [23]. Вследствие повышения количества участвующих в сокращении детрузора мускариновых рецепторов назначение антихолинергических препаратов в стандартных дозах больным с НДГ зачастую оказывается неэффективным. В связи с этим таким пациентам рекомендуют принимать М-холиноблокаторы в более высоких дозах, а также назначают комбинацию двух лекарственных средств с антимускариновой активностью [14, 24]. Это обстоятельство предопределяет высокую частоту и тяжесть негативных проявлений при назначении антихолинергической терапии пациентам с НДГ. Особенно значимым для больных неврологического профиля является способность большинства антимускариновых препаратов проникать через гематоэнцефалический барьер и вызывать побочные действия со стороны ЦНС: когнитивные нарушения, ухудшение памяти, сонливость, спутанность сознания, эмоциональную лабильность [25, 26]. Недостаточная эффективность антихолинергической терапии в обычных дозах и высокая частота и тяжесть побочных эффектов при их повышении определяют относительно низкую приверженность лечению больных с НДГ по сравнению с пациентами с идиопатической детрузорной гиперактивностью. Так, в ретроспективном исследовании A. Manack и соавт. (2011), изучавших истории болезни 26 922 пациентов с НДНМП, установлено, что 38% больных отказались от антихолинергической терапии в течение первого года лечения [27].
У неврологических пациентов часто обнаруживают сочетание НДГ и детрузорно-сфинктерной диссинергии. В этих случаях наряду с высоким внутрипузырным давлением обычно также выявляют большое количество остаточной мочи, что крайне неблагоприятно влияет на состояние верхних мочевыводящих путей. Для снижения внутрипузырного давления и обеспечения опорожнения мочевого пузыря таким пациентам наряду с назначением антихолинергических препаратов проводят периодическую катетеризацию мочевого пузыря, как правило, с частотой 4–6 раз в сутки [28].
В ряде публикаций указывается на эффективность назначения больным с НДГ селективных агонистов β3-адренорецепторов [29]. Однако препараты этой группы пока не включены в клинические рекомендации по лечению НДНМП, что связано главным образом с недостаточным количеством клинических исследований, особенно носящих долгосрочный характер.
В случаях неэффективности пероральной медикаментозной терапии НДГ ее относят к категории рефрактерной (резистентной). На сегодняшний день отсутствуют четкие критерии рефрактерности НДГ. При этом необходимо учитывать, что в отличие от идиопатической гиперактивности детрузора, при которой можно длительное время искать оптимальные схемы назначения антихолинергических препаратов и ориентироваться на клинические проявления заболевания, у больных с НДГ более важны уродинамические критерии, а именно величина внутрипузырного давления. В качестве рефрактерных необходимо рассматривать НДГ в тех случаях, когда на фоне приема М-холиноблокаторов не происходит нормализации внутрипузырного давления [14]. В связи с тем что больные с НДГ имеют высокое детрузорное давление в фазу наполнения и значительный риск поражения верхних мочевыводящих путей, выявление рефрактерных форм НДГ и переход к следующей линии лечения, ботулинотерапии, должны осуществляться значительно быстрее, чем при идиопатической форме заболевания [1, 14].
Ботулинотерапия: общие принципы и применение в урологии
Показаниями к проведению ботулинотерапии больным с НДГ являются недостаточная эффективность и/или неудовлетворительная переносимость антихолинергических препаратов, а также наличие противопоказаний к их назначению [1, 14]. Несмотря на название, ботулинотерапия относится к малоинвазивным хирургическим методам лечения и заключается в выполнении инъекций ботулинического токсина (ботулотоксина) в стенку мочевого пузыря. Ботулинический токсин является нейротоксином белковой природы, вырабатываемым грамположительными спорообразующими анаэробными бактериями Clostridium botulinum. Ботулотоксин относится к самым сильным нейротоксинам живой природы: биологическую активность проявляет уже 1 нг (10 -9 г) данной субстанции [30].
В зависимости от антигенных свойств выделяют 7 вариантов (серотипов) ботулинического токсина, обозначаемых литерами A, B, C, D, E, F и G. Наибольшее распространение в медицине получило применение ботулинического токсина типа А (БТА). Последний представляет собой белок с молекулярной массой около 150 кДа, состоящий из двух субкомпонентов – легкой (50 кДа) и тяжелой (100 кДа) цепей, соединенных дисульфидной и нековалентными связями [31]. В основе нейротоксичного действия БТА лежит его способность расщеплять мембранный белок SNAP-25 (synaptosomal-associated protein), который участвует в обеспечении соединения синаптической везикулы с пресинаптической мембраной холинергического нейрона. Расщепление SNAP-25 блокирует высвобождение нейромедиатора ацетилхолина в синаптическую щель и приводит к стойкой хемоденервации мышечных волокон. При введении БТА в детрузор происходит торможение его сократительной активности [32].
Ботулинотерапия с успехом применяется во многих областях медицины с начала 1990-х гг. Особенно широкое распространение она получила в неврологии (различные формы спастичности, цервикальная дистония, блефароспазм и др.) и косметологии. Первое сообщение об использовании ботулинотерапии в урологии относится к 1988 г., когда D. Dykstra и соавт. опубликовали результаты успешного применения БТА у больных с детрузорно-сфинктерной диссинергией [33]. В 2000 г. B. Schurch и соавт. впервые с положительными результатами использовали БТА у больных с НДГ [34]. Проведенные впоследствии многоцентровые клинические исследования подтвердили эффективность ботулинотерапии у пациентов с нейрогенной и идиопатической детрузорной гиперактивностью, гиперактивным мочевым пузырем и ургентным недержанием мочи [35, 36], что позволило включить ее в отечественные и зарубежные клинические рекомендации в качестве второй линии лечения при неэффективности или невозможности проведения пероральной фармакотерапии [1, 14]. В настоящее время ботулинотерапия используется в клинической практике для лечения идиопатической и нейрогенной гиперактивности детрузора [37–39]. В Российской Федерации ботулинотерапия в урологии активно применяется более 12 лет. Накопленный опыт позволяет утверждать, что при проведении ботулинотерапии в течение длительного периода уровень ее эффективность не снижается, а переносимость лечения не ухудшается [40]. Как в нашей стране, так и за рубежом проводится изучение эффективности длительной ботулинотерапии, а также накапливается опыт ее применения при таких урологических заболеваниях, как детрузорно-сфинктерная диссинергия [41], синдром хронической тазовой боли/интерстициальный цистит [42, 43], доброкачественная гиперплазия предстательной железы [44], эректильная дисфункция [45].
Абоботулотоксин (Диспорт®) в лечении нейрогенной детрузорной гиперактивности
Для лечения урологических заболеваний применяют два варианта БТА, известных под непатентованными международными названиями «абоботулотоксин» и «онаботулотоксин». Субтипы БТА различаются главным образом белками, окружающими активную субстанцию – собственно сам нейротоксин. В естественных условиях БТА синтезируется в виде протеинсодержащего комплекса, который имеет в своем составе активную часть — ботулинический нейропротеин (активный нейротоксин), молекулярная масса которого составляет 150 кДа, и специальные нетоксиновые протеины (NAPs) с молекулярной массой от 350 до 750 кДа в зависимости от конкретного производителя препарата БТА. В состав препаратов БТА также входят вспомогательные вещества, выполняющие роль стабилизаторов. При попадании молекулы БТА в физиологические условия (pH=7,4, при растворении физиологическим раствором во флаконе) происходит диссоциация нейротоксинового комплекса, в результате которой отделяются активная часть молекулы (активный нейропротеин, молекулярная масса которого 150 кДа) и комплексообразующие нетоксиновые протеины (NAPs) [46].
Длительное время единственным БТА, разрешенным к применению для лечения урологических заболеваний, был онаботулотоксин. В 2011 г. он был одобрен FDA в США для лечения ургентного недержания мочи вследствие гиперактивности детрузора, а впоследствии национальными регуляторными инстанциями во многих других странах, в том числе и в Российской Федерации.
Другой препарат БТА, абоботулотоксин А (абоБТА), выпускающийся под торговым названием Диспорт® (Ипсен, Франция), впервые был зарегистрирован в 1990 г. в Великобритании для лечения блефароспазма и гемифациального спазма. С тех пор применение препарата Диспорт® было одобрено более чем в 90 странах по целому ряду других показаний (фокальной спастичности у взрослых и детей, цервикальной дистонии, гипергидроза подмышечной области), а его эффективность и безопасность были доказаны в многочисленных клинических исследованиях. Урологическим показанием к применению абоБТА является НДГ. Проводимые в течение длительного времени исследования продемонстрировали высокий уровень клинической эффективности и оптимальный профиль безо-пасности внутридетрузорных инъекций абоБТА в дозах от 500 Ед до 1000 Ед у данной категории больных [47–51]. При использовании абоБТА отмечалась положительная динамика симптоматики НДГ и значимое повышение качества жизни больных. Наряду с клинической эффективностью отмечено достоверное улучшение уродинамических показателей, в том числе снижение максимального детрузорного давления и повышение максимальной цистометрической емкости (см. таблицу).
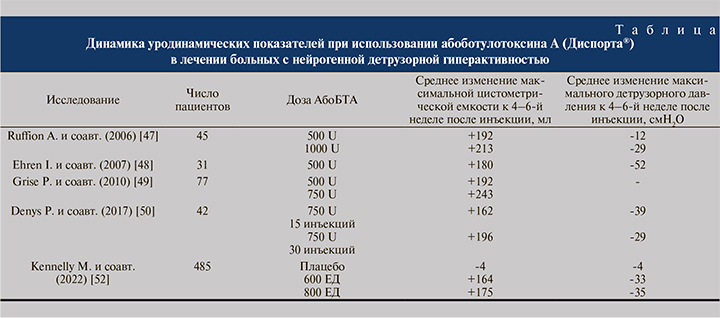
В 2018 г. были опубликованы результаты ретроспективного исследования F. Bottet и соавт. [53], в котором изучали эффективность внутридетрузорных инъекций абоБТА у 57 пациентов с НДГ, у которых ранее проводившееся лечение с использованием онаБТА оказалось неэффективным. Авторы отметили достоверное снижение количества эпизодов недержания мочи в сутки у 52,6% больных и увеличение максимальной цистометрической емкости на 41,2 мл при среднем снижении максимального детрузорного давления на 8,1 см H2O и сделали вывод о том, что большинство пациентов с НДГ, не восприимчивых к онаБТА, получают пользу от последующих внутридетрузорных инъекций абоБТА.
Результаты приведенных выше исследований свидетельствуют о высоком уровне эффективности и хорошей переносимости внутридетрузорных инъекций абоБТА у больных с НДГ, однако количество участвовавших в них больных было относительно невелико. Первой по-настоящему масштабной программой изучения применения абоБТА у пациентов с НДГ стала серия из двух идентичных по дизайну двойных слепых мультицентровых рандомизированных клинических исследований III фазы CONTENT1 и CONTENT2, в которых приняли участие 485 больных в 131 центре во многих странах мира, в том числе и в Российской Федерации [52]. В исследование включали пациентов с ургентным недержанием мочи вследствие НДГ на фоне спинальной травмы (70% больных) при уровне поражения ≤T1 или рассеянного склероза (30% больных), выполняющих периодическую самокатетеризацию мочевого пузыря, Исследование состояло из двух этапов. На первом из них в зависимости от результатов рандомизации пациентам выполняли внутридетрузорные инъекции абоБТА в дозе 600 ЕД (162 пациента), абоБТА в дозе 800 ЕД (161 пациент) или плацебо (162 пациента). На втором этапе проводили повторные инъекции абоБТА 600 ЕД или 800 ЕД через 12 и более нед. после исходного лечения уже без плацебо контроля. Повторное лечение проводили, если количество эпизодов ургентного недержания мочи сокращалось менееьчем на 30% от исходного уровня.
Улучшение клинических и уродинамических показателей было отмечено уже через 2 нед. после выполнения внутридетрузорных инъекций. К 6-й неделе после их проведения у пациентов из групп АбоБТА 600 ЕД и 800 ЕД наблюдали достоверное по сравнению с плацебо снижение частоты эпизодов недержания мочи в неделю (-22,7 и -23,6 для 600 ЕД и 800 ЕД соответственно, для плацебо -12,7). Полностью исчезло ургентное недержание мочи у 36% больных в группе абоБТА 600 ЕД, у 29% в группе абоБТА 800 ЕД и только у 3% больных в группе плацебо (p<0,001). У пациентов обеих групп абоБТА выявили достоверное по сравнению с плацебо увеличение среднего объема мочеиспускания и средней суммы баллов по опроснику I-QOL, повышение максимальной цистометрической емкости, снижение максимального детрузорного давления в фазе наполнения, повышение объема наполнения мочевого пузыря к моменту появления первого непроизвольного сокращения детрузора. Если исходно непроизвольные сокращения детрузора (НСД) при уродинамическом исследовании выявляли у всех больных, то к 6-й неделе после проведения внутридетрузорных инъекций их не обнаружили у 44% больных в группе абоБТА 600 ЕД, у 55% больных – в группе абоБТА 800 ЕД и только у 7% больных – в группе плацебо. Независимо от дозы абоБТА более 40% пациентов не требовалось повторного лечения по крайней мере в течение 48 нед. после внутридетрузорных инъекций на первом этапе исследования.
Переносимость лечения была удовлетворительной у пациентов всех трех групп и достоверно не различалась в зависимости от проводимого лечения. Наиболее частым негативным проявлением была симптоматическая инфекция нижних мочевыводящих путей, причем достоверных различий в частоте ее возникновения в зависимости от вида лечения обнаружено не было. В течение 12 нед. после первого курса инъекций данное негативное проявление отмечали у 14% больных в группе абоБТА 600 ЕД, 15% больных – в группе абоБТА 800 ЕД и 17% больных – в группе плацебо.
Проведенный дополнительный анализ результатов клинических исследований CONTENT1 и CONTENT2 показал, что эффективность абоБТА одинаково высока у пациентов с НДГ независимо от лежащего в его основе неврологического заболевания [54]. При этом было отмечено, что среднее время до повторной инъекции было несколько большим у пациентов с рассеянным склерозом, у которых также наблюдался более выраженный дозозависимый эффект абоБТА по сравнению с больными с повреждением спинного мозга.
F. Cruz и соавт. (2023) [55] опубликовали результаты си-стматического анализа и непрямого сравнения эффективности и безопасности абоБТА и оноботулотоксина-А (оноБТА) у больных рефрактерным НДГ вследствие рассеянного склероза и спинальной травмы. Авторы изучили результаты описанных выше исследований CONTENT1 и CONTENT2 и четырех рандомизированных клинических исследований онаБТА, в которых участвовали 1306 пациентов с НДГ. Авторы отметили, что через 12 и 24 нед. после проведенного лечения у больных, которым вводили абоБТА в дозе 800 ЕД, отмечалось более выраженное снижение частоты ургентного недержания мочи по сравнению с пациентами, которым вводили онаБТА в дозе 200 ЕД.
В ряде исследований показана эффективность применения абоБТА при идиопатической гиперактивности детрузора [56] и детрузорно-сфинктерной диссинергии [57].
В 2022 г. в Российской Федерации было зарегистрировано первое урологическое показание к применению абоБТА (Диспорт®) – недержание мочи у пациентов с нейрогенной гиперактивностью детрузора (нейрогенный мочевой пузырь) в результате повреждения спинного мозга (травматического или нетравматического характера) или рассеянного склероза, которым выполняется периодическая чистая катетеризация мочевого пузыря. Согласно инструкции на препарат доза Диспорта® для лечения нейрогенной детрузорной гиперактивности составляет 600 ЕД (два флакона по 300 ЕД) или 800 ЕД (один флакон 300 ЕД и один флакон 500 ЕД), а вводить рекомендуется внутридетрузорно в 30 точек. Использование абоБТА для лечения НДГ включено в отечественные клинические рекомендации по лечению нейрогенных дисфункций нижних мочевыводящих путей [1].
Особый интерес представляют работы, посвященные анализу расчета содержания активного нейротоксина в разных препаратах БТА и оценке его потенциального влияния на длительность клинического эффекта терапии. В рамках исследования M. Field и соавт. (2018) был произведен расчет количества активного нейротоксина в каждом продукте БТА – абоБТА (Диспорт®) и онаБТА (Ботокс®). Согласно проведенному тесту получены следующие результаты: количество активного нейротоксина во флаконе препарата Диспорт® 500 ЕД составляет 2,69 нг, во флаконе препарата Ботокс® 100 ЕД – 0,9 нг. Стоит отметить, что единицы действия препаратов являются специфическими и не могут сравниваться с таковыми других препаратов, содержащих ботулинический токсин, что исключает прямое сравнение. Вместе с тем значения, полученные из анализа расчета содержания активного нейротоксина, строение которого одинаково для всех препаратов БТА, в максимально одобренной дозе, согласно инструкции, позволяют допущение прямого сравнения препаратов БТА [58]. Следовательно, в пересчете содержания активного нейротоксина на максимально одобренную дозу препаратов для лечения НДГ можно определить различие в количестве активного нейропротеина. Так, в препарате Диспорт® его содержание составляет 4,3 нг, в Ботоксе® – 1,8 нг. Достижение продолжительного контроля симптомов может быть обусловлено более высоким уровнем содержания активного нейротоксина в максимально разрешенной дозе препарата Диспорт® по сравнению с другими БТА [58–60].
Повышение эффективности лечения больных с НДНМ является не только важной урологической, но и значимой медико-социальной проблемой. Поиск новых подходов к ее решению является актуальной задачей современной медицины. В связи с этим внедрение в клиническую прак-тику ботулинотерапии открыло новую эру в лечении дисфункций мочевого пузыря, а появление в арсенале уролога лекарственного препарата Диспорт® (абоботулотоксин) открывает дополнительные возможности в лечении НДГ. Инъекции препарата Диспорт® способствуют длительному, до 48 нед., снижению внутридетрузорного давления, устранению непроизвольных сокращений детрузора и улучшению большинства уродинамических параметров. Результаты проведенных клинических исследований показали высокий уровень эффективности и хорошую переносимость Диспорта®, что позволяет рекомендовать его к широкому применению при лечении больных с НДГ.



