Введение. На современном этапе развития пластической хирургии создание аритифициального мочевого резервуара (АМР) является общепризнанным способом лечения, обеспечивающим естественную деривацию мочи после радикальных операций по поводу рака и хронических декомпенсированных инкурабельных заболеваний мочевыводящих путей [1–4]. В настоящее время в качестве эксплантатов используют различные отделы желудочно-кишечного тракта (ЖКТ) – подвздошную, толстую кишку, желудок [2–11]. Накоплен значительный клинический и морфологический материал с изучением клинических и морфофункциональных показателей, позволяющих дать сравнительную многоплановую оценку различным вариантам АМР: оперативной
технике, уродинамике, динамическим процессам клинической и морфологической адаптации АМР
и организма в целом [5, 8, 9, 12–18]. Во всем мире при создании АМР приоритет по-прежнему отдается тонкокишечной пластике [5, 8, 9, 12, 13, 16–18]. Тем не менее в литературе опубликован ряд работ,
посвященных изучению результатов использования сегмента желудка для создания АМР, в которых
подчеркивается оптимальная динамика его морфофункциональной адаптации с наименее выраженной тканевой и клеточной перестройкой [1, 2, 7, 11, 13, 16]. Указанный вариант использования пластического материала для создания АМР является альтернативой кишечному, но выполняется в единичных клиниках [7, 11, 14, 15]. Во многом такое положение определяется отсутствием исследований с многоплановой сравнительной оценкой различных вариантов цистопластики на разных сроках функционирования АМР. Это, очевидно, связано с отсутствием комплекса показателей индивидуального выбора сегмента ЖКТ для детубуляризации с учетом клинических параметров оперативной техники, возможности инфекционных осложнений,
показателей уродинамики, адаптационного процесса, обеспечивающих оптимальный уровень послеоперационной коррекции при динамическом наблюдении за больными.
Цель исследования: комплексная сопоставительная клинико-морфологическая оценка различных
вариантов АМР – тонко-, толстокишечного и желудочного – в ранние и поздние сроки с использованием различных клинических показателей для уточнения особенностей его клинико-морфологической адаптации.
Материалы и методы. За 1996–2012 гг. на базе клиники урологии ГМПБ № 2 ортотопическая цистопластика (ЦП) выполнена 265 больным: илеоцистопластика (ИЦС) – 204, сигмоцистопластика (СЦП) – 29 и гастроцистопластика (ГЦП) – 24. Среди них: 207 (77%) мужчин и 61 (23%) женщина в возрасте 22–75 лет (средний возраст – 57,5±1,3 года). Холодная биопсия АМР (от 1 до 6) в динамике проведена 105 больным. Общее число биопсий – 150: после ИЦП – 97 (64,7%), ГЦП – 38 (25,3%), СЦП – 15 (10%). Морфологическое исследование проведено в сроки 2, 4, 5–12 лет в 100 (66,7%), 33 (22,0%) и 17 (11,3%) случаях соответственно. Клиническое обследование включило оценку показателей кислотно-основного состояния и электролитного баланса крови в сроки 3–24 мес.; параметров уродинамики (объем АМР, дневная и ночная континенция, объем мочеиспускания); частоты, характера инфицирования, резистентности микрофлоры к антибактериальным препаратам и проявлений воспалительной реакции в сроки 1–90 мес. после операции.
Материал, полученный в результате холодных биопсий и фиксированный на парафиновых блоках, был
изучен морфологически. Проведены исследования: гистологическое (окраска гематоксилином и эозином, пикрофуксином по Ван Гизону); гистохимическое (изучение реакции слизи, ШИК-реакция без и в комбинации с альциановым синим); иммуногистохимическое (показатели пролиферации и апоптоза – экспрессия р53, Ki67, Bcl2, нейроэндокринных клеток – экспрессия хромогранина А, клеток Кахаля –
экспрессия синаптофизина, Т- и В-лимфоцитов – экспрессия CD8, CD20); морфометрическое (подсчет и полуколичественная оценка показателей [0 – отсутствие показателя, + – слабая степень выраженности, ++ – умеренная степень выраженности, +++ – интенсивная степень выраженности] структурных и клеточных элементов проведены в 10 полях зрения при увеличении 40 с расчетом средних величин). Результаты морфометрического исследования количественно оценены с использованием системы компьютерного анализа микроскопических изображений, состоящей из микроскопа Nikon Eclipse E 400, цифровой камеры Nikon DXM 1200, персонального компьютера на базе Intel Pentium-4, программного обеспечения АСТ-1, версия 2.12, и “ВидеоТесТ-Морфология 5.0”.
Статистическая обработка полученных результатов осуществлена с использованием методов параметрической и непараметрической статистики. Методы описательной (дескpиптивной) статистики включали оценку сpеднего аpифметического (M), сpедней ошибки сpеднего значения (m) – для признаков, имеющих непрерывное распределение, а также частоты встречаемости признаков с дискретными значениями.
Для оценки межгрупповых различий значений признаков, имеющих непрерывное распределение, применили t-критерий Стьюдента, ранговый U-критерий Вилкоксона–Манна–Уитни, а при сравнении частотных величин – χ2-критерий Пирсона и точный метод Фишеpа (ТМФ).
Анализ зависимости между признаками проведен с помощью критерия ранговой корреляции (rs-крите-
рия Спиpмена) и χ2-критерия Пирсона.
Выполнена компьютерная статистическая обpаботка матеpиала с использованием стандаpтного
пакета пpогpамм пpикладного статистического анализа (Statistica for Windows v. 6.0, StatSoft Inc., США)
Кpитический уpовень достовеpности нулевой статистической гипотезы (об отсутствии значимых pазличий или фактоpных влияний) пpинят pавным 0,05.
Результаты и обсуждение. Все оперированные больные независимо от вида ЦП пережили все сроки
наблюдения. Послеоперационные ранние осложнения возникли у 7 (12,1%) больных: кишечная
непроходимость – у 1 (1,7%) больной, несостоятельность шва АМР, эвентрация, перитонит – у 1 (1,7%), несостоятельность шва уреторорезервуарного анастомоза – у 1 (1,7%); свищи, как правило, возникали у женщин: влагалищный – у 3 (5,2%), кожный – у 1 (1,7%). У 4 (6,8%) больных развились поздние осложнения: стриктура анастомоза, метаболический ацидоз, гематурия. Повторные операции проведены восьми больным.
При оценке функционирования почек и верхних мочевыводящих путей существенных нарушений не
выявлено: уровень креатинина в сыворотке крови независимо от сроков исследования не превышал
160 мкмоль/л, скорость клубочковой фильтрации была не ниже 80 мл/мин. По данным УЗИ и экскреторной урографии, умеренным расширением чашечно-лоханочной системы обеих почек страдали 16 больных, чаще после ИЦП, чем после ГЦП, – 10 и 6 соответственно.
Важной проблемой ЦП является профилактика и компенсация возможных нарушений гомеостаза у
оперированных больных. Известно, что после ИЦП в результате резорбции электролитов слизистой АМР
может развиваться гиперхлоремический метаболический ацидоз. По данным разных авторов, такие
изменения после ИЦП могут возникать у 20–50% больных. Имеются сообщения, что гиперхлоремический алкалоз возможен и после ГЦП [1–11, 15]. В связи с этим в работе изучены показатели кислотно-основного состояния и электролитного баланса крови больных через 3 и 6–24 мес. после операции. После ГЦП указанные показатели во все исследованные сроки ни у одного пациента не отличались от нормы. При ИЦП у некоторых больных отмечены незначительная гиперкалиемия, гиперхлоремия и дефицит оснований в крови (ВЕ). В срок 3 мес. концентрация калия колебалась от 3,1 до 4,0 ммоль/л (в среднем 3,6±0,07 ммоль/л), хлора – от 103,6 до 110,5 ммоль/л (в среднем 105,6±2,5 ммоль/л), дефицит ВЕ составил от 2,2 до -6,5 (в среднем -2,53±1,6). Через
6–24 мес. после операции уровень калия составил от 3,0 до 4,2 ммоль/л (среднее – 3,7±0,06 ммоль/л),
хлора – от 104,1 до 112,3 ммоль/л (среднее – 105,8±1,9ммоль/л), изменения в основном касались
лишь дефицита ВЕ, который стал составлять от -3,6 до -6,5 (в среднем -4,65±0,19). Проведенные
данные свидетельствуют о том, что после ИЦП в отдаленном послеоперационном периоде лишь
у некоторых больных сохраняются гипокалиемия, гиперхлоремия и ацидоз, тогда как большинство
больных имели нормальные показатели этих электролитов. При этом в группе больных, у которых
при формировании АМР использован детубуляризованный сегмент подвздошной кишки, была лишь
тенденция к гипокалиемическому, гиперхлоремическому метаболическому ацидозу, что, очевидно, необходимо учитывать при индивидуальной терапии.
Полученные клинические данные коррелируют с морфологическими особенностями адаптационной
перестройки детубуляризованного сегмента кишки при ИЦП. Тонкокишечный АМР характеризуется
наиболее выраженной компенсаторно-приспособительной перестройкой, что во многом определяется
архитектоникой и морфофункциональной сложностью организации тонкой кишки, обусловленными выполняемыми функциями — пристеночным пищеварением и абсорбцией. В тонкокишечном АМР отмечена прогрессирующая атрофия и редукция ворсинчатых структур с ранним замещением каемчатых эпителиоцитов бокаловидными клетками и качественным изменением их секреции, что,
очевидно, является отражением резко измененных новых условий его функционирования.
В отличие от тонкокишечного в желудочном и толстокишечном АМР адаптационная перестройка характеризуется минимальными архитектоническими и морфофункциональными изменениями (рис. 1).
Рисунок 1. Архитектоника АМР в разные сроки ункционирования. Ув. 100.
Важными клиническими показателями функционирования АМР являются максимальный объем АМР, дневная и ночная континенция, динамика сохранения управляемости мочеудержания и мочеиспускания. Максимальный объем АМР через 12 мес. у больных после ИЦП составил 605,0±132,5 мл, что существенно выше, чем после ГЦП, – 387±33,5 мл; в поздние сроки (48 мес.) эти соотношения сохранялись – 612,5±150,2 и 392,4±88,5 мл соответственно. Показатели дневной и ночной континенции в ранние сроки (12–17 мес.) у больных после ИЦП составили соответственно 93,3 и 84,2%, после ГЦП — 59,9 и 87,8%. В более поздние сроки (40 мес.) у больных после ИЦП эти показатели составили 92,6 и 9%, после ГЦП – 85 и 31,5% соответственно. Ночное удержание мочи сохранялось в массе наблюдений и в наиболее поздние сроки, составив 42,5% после ИЦП и 32,8% после ГЦП. Эти данные коррелируют с исследованными параметрами уродинамики: объем мочеиспускания, объем первого позыва на мочеиспускание и максимальная емкость АМР были ближе к физиологическим в группе с ГЦП. Тем не менее такой важный показатель, как объем остаточной мочи, в группе больных, оперированных с использованием сегмента желудка, был существенно ниже, чем у больных после ИЦП, как через 3 мес. (29,2±12,1 и 62,5±52,5 мл соответственно), так и через 6–24 мес. (32±17,2 и 128,8±116,2 мл) после операции.
В целом эти положительные клинические данные соответствуют и определяются свойственным всем
вариантам АМР постоянством органного строения детубуляризованного сегмента, сохранением регенераторных зон, гипертрофией мышечного слоя, отсутствием деформирующего склероза. В работе установлена корреляция компенсаторной рабочей гипертрофии мышечного слоя с постоянством высокой экспрессии иммуногистохимического маркера клеток Кахаля, осуществляющих нейроэндокринную стимуляцию сократительной функции гладкомышечных структур (рис. 2) [10, 19].
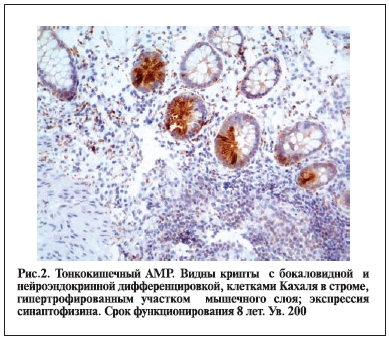
Для оценки повреждающего действия мочи на слизистую резервуара и ее стромальной клеточной
инфильтрации проведено изучение и сравнительный анализ количественных показателей плотности,
реакции, осадка, бактериологической характеристики мочи в двух вариантах АМП (ИЦП, ГЦП).
Относительная плотность мочи больных при этих вариантах ЦП не отличалась существенно от нормы.
Более низкий показатель уровня рН в сроки 1 и 12 мес. после ГЦП (5,6±0,2 и 6,3±0,5 соответственно)
по сравнению с ИЦП (7,1±0,4 и 7,3±0,2 соответственно), очевидно, отражает типовые органные особенности желудка. При исследовании осадка мочи лейкоцитурия в течение первого месяца наблюдалась у всех пациентов после ИЦП и у 95,8% – после ГЦП (p>0,1). К 6-му месяцу функционирования АМП лейкоцитурия после ИЦП имелась у всех обследованных, после ГЦП – у трети. В более поздние сроки (к 24-му месяцу) различия в частоте выявления лейкоцитурии уже отсутствовали: только у 3 (13%) из 23 обследованных после ГЦП и у 14 (14,1%) из 99 пациентов после ИЦП (p>0,1). Эти данные дополняются оценкой содержания слизи, которая сохранилась у 10 (10,1%) из 99 больных после ИЦП через 12 мес. со значительным снижением в более поздние сроки, при ГЦП – через 6 и 24 мес. содержание слизи в моче было у 33,3 и 17,6% больных соответственно.
Согласно результатам бактериологического исследования мочи, основным возбудителем инфекционно-воспалительного процесса в мочевой системе независимо от формы цистопластики была Е. coli.
В поздние сроки бактериурия и лейкоцитурия более характерны для больных после ИЦП: она была
выявлена у 22 (18,5%) из 119 обследованных пациентов с АМР, причем у 18 после ИЦП, у 2 после
ГЦП и у 2 после СЦП. Как правило, у этих 22 больных имелось предшествующее цистопластике гнойное воспаление в мочевой системе (цистит, пиелонефрит). Морфологические признаки агрессивно
текущего гнойного воспаления с деструкцией слизистого и подслизистого слоя установлены только
в 11,3% наблюдений. Особенностью бактериурии при всех вариантах ЦП является преимущественно
бессимптомный характер течения. Установлено, что уровень и частота бактериурии не являются
безусловным признаком реализации воспалительного процесса независимо от варианта АМР. Эта
важная клиническая особенность находит объяснение в результатах морфофункционального и иммуногистохимического исследований. Выявлено, что после ИЦП независимо от сроков функционирования АМР постоянно реализуется комплекс мер, имеющих защитно-приспособительное значение на органном и тканевом уровнях: постоянство клеток Панета и нейроэндокринных клеточной дифференцировки в криптах, секреция бокаловидными клетками эпителия крипт и покровного эпителия слизистой оболочки сиаломуцинов, постоянство инфильтрации стромы кооперацией иммунокомпетентных клеток, экспрессирующих CD8 и СD20 (Т-и В-лимфоцитов), тучных клеток, клеток Кахаля (рис. 3).
Рисунок 3. Экспрессия маркеров CD8 (а) и CD20 (б) в клеточном стромальном инфильтрате тонкокишечного АМР при сроке функционирования 10 лет. Ув. 400.
Это, очевидно, определяет значительное снижение повреждаемости тканевых и клеточных структур
при всех вариантах ЦП, редкость морфологических признаков острого агрессивного, деструктивного и
хронического воспаления и связанного с ним деформирующего склероза даже на самых поздних этапах функционирования АМР.
Постоянно обсуждаемой и спорной проблемой, во многом определяющей рациональность выбора
эксплантата при формировании АМР, является риск его опухолевой трансформации, особенно при значительных сроках функционирования. На нашем материале независимо от варианта ЦП в эпителии
АМР не установлено даже ранних стадий опухолевого морфогенеза в виде дисплазии, атипии, рака
in situ. Лишь в отдельных наблюдениях после ГЦП имелась очаговая гиперплазия покровного эпителия
и обкладочных клеток АМР.
Отсутствие тенденции к предопухолевым и опухолевым процессам в изученном материале, повидимому, во многом определяется сохранением постоянства высокого уровня апоптоза как в
ранние, так и в поздние сроки наблюдения: после ИЦП уровень экспрессии р53 составил соответственно 68,6±2,1–23,5±2,5 клеток в поле зрения, Ki67 — 77,9±2,2—46,7±2,1, Bcl2 — ++—+, после ГЦП — 40,8±2,3—19,3±1,1 клеток в поле зрения; 30,2±2,6—11,2±3,5; ++—+ , что соответствует нормативным показателям (рис. 4).
Рисунок 4. Экспрессия маркеров апоптоза и полиферации (Ki67, Bcl2) в эпителии крипт и лимфоцитах стромы в различных вариантах АМР. Ув. 200.
Заключение. Таким образом, примененный комплекс клинических, морфологических, иммуногистохимических исследований позволяет более обоснованно выбирать индивидуальный для каждого больного вариант ЦП и создает предпосылки для коррекции процесса адаптации в АМР независимо от его вида как в ранние, так и в поздние сроки его функционирования.
В связи с тем что адаптация всех трех видов АМР к новым условиям хороша и тенденции его слизистой
к опухолевой трансформации не выявлено, методом выбора при его создании остается ИЦП, а альтернативными вариантами – ГЦП и СЦП.



