Введение. Среди инфекций нижних мочевыводящих путей хронический цистит (ХЦ) является самой сложной проблемой: показатели его распространенности не имеют тенденции к снижению, кроме того, он склонен к рецидивирующему течению. К возрасту 18–20 лет хотя бы один эпизод цистита развивается у 20% девушек, а рецидивы возникают в 50% случаев [1–3]. Антибактериальные препараты [4], рекомендованные к применению при лечении ХЦ, не излечивают большинства больных, что связано с нарастанием в последние годы множественной лекарственной устойчивости различных штаммов возбудителей ХЦ.
Как известно, в этиологической структуре ХЦ доминируют представители семейства Enterobacteriaceae с ведущей ролью эшерихий (70–95%), реже из мочи выделяют клебсиеллы, протей и другие грамотрицательные бактерии [5]. До настоящего времени дискутируется этиологическая роль коагулазоотрицательных стафилококков (КОС), в частности S. saprophyticus [6, 7], дрожжеподобных грибов рода Candida, неферментирующих грамотрицательных бактерий, микоплазм, уреаплазм, хламидий и вирусов [8–11].
К сожалению, в литературе практически не освещен вопрос об инфицированности мочи женщин с ХЦ неклостридиальными анаэробами (НА). Отчасти это связано с техническими трудностями культивирования данной группы микроорганизмов. Однако нами в эксперименте доказана роль НА, в частности Peptococcus niger, в развитии острого обструктивного пиелонефрита [12], а также определен спектр НА, в норме выделяемых из мочи условно здоровых женщин [13].
Цель работы – изучение микрофлоры мочи и слизистой мочевого пузыря при ХЦ у женщин, включая определение НА и вирусов.
Материалы и методы. Обследованы 28 женщин в возрасте 20–30 лет с хроническим рецидивирующим циститом в период очередной манифестации заболевания до назначения антибактериальной терапии. Бактериологическое исследование средней порции утренней мочи проведено с соблюдением правил забора материала. По принятым показаниям всем больным произведены цистоскопия и щипковая биопсия стенки мочевого пузыря с последующим бактериологическим исследованием биоптатов. Транспортировка мочи и биоптатов в лабораторию не превышала 1 ч. Бактериологическое исследование биоптатов и мочи, а также определение уровня бактериурии проведены согласно методике В. В. Меньшикова [14], но с использованием расширенного набора питательных сред (Эндо, ХайХром селективный агар для грибов рода Candida, ХайХром селективный агар для энтерококков, желточно-солевой агар, 10%-кровяной агар, приготовленный на основе агара Мюллер–Хинтон). Для выделения НА использован агар Мюллер–Хинтон, агар и бульон Шадлера, желчно-эскулиновый агар для бактероидов, среду Блаурокка. С целью определения концентрации НА в моче проведены десятикратные разведения в тиогликолевом буфере с высевом на соответствующие питательные среды. Посевы инкубировали в аэробных и анаэробных (10% СО2, 10% Н2, 80% N2) условиях культивирования. Идентификация выделенных бактерий проведена по морфологическим, тинкториальным, культуральным и биохимическим признакам с помощью энтеро-, стафило-, неферм-, анаэротестов («Lachema», Чехия). В биоптатах мочевого пузыря определено присутствие ДНК хламидий, микоплазм, вирусов простого герпеса 1-го и 2-го типов (ВПГ-1, ВПГ-2), цитомегаловируса (ЦМВ), вирусов Эпштейна–Барр (ВЭБ) и папилломы человека (ВПЧ) с помощью стандартной полимеразной цепной реакции (ПЦР) и использованием ПЦР-диагностических наборов производства АО «ДНК-технология», «ДиаЛат», «Литех» (Москва).
Результаты. По результатам бактериологического исследования ни одна из 28 порций мочи не оказалась стерильной (табл. 1). В 14,3% наблюдений выделены только НА, в 85,7% обнаружена аэробноанаэробная микст-инфекция, включая НА. Из вирусов в моче определен лишь ВПГ-1 (7,1%).
Только в 50% случаев из мочи выделены представители семейства Enterobacteriaceae. КОС и Corynebacterium sрp. регистрировали с одинаковой частотой – по 42,8%. Реже в моче присутствовали S. aureus, E. faecalis, C. albicans (по 21,4%); M. hominis и U. urealytium были обнаружены в моче у 35,7% пациенток, Chlamidia sрp. – у 7,1%.
Паттерн НА, обнаруженных в моче больных ХЦ, был представлен Propionibacterium sрp. (50±4,3) со средним уровнем бактериурии lg4,3, Peptostreptococcus sрp. (35,7±5,4) – lg4, Eubacterium sрp. (28,6±4,1) – lg4,8, Peptococcus niger (28,6±4,7) – lg4,5, Bacteroides sрp. (14,3±4,4) – lg4,4.
Во всех случаях НА находили в моче в количествах, превышающих формально допустимые для нормы показатели бактериурии (>103 КОЕ/мл) с максимальным уровнем для Eubacterium sрp., составившим lg4,8.
Среди представителей семейства Enterobacteriaceae доминировали E. coli (21,4%), реже выделяли C. freundii (14,3%), P. vulgaris и K. pneumoniae (по 7,1%) с уровнем бактериурии ниже формально допустимых, за исключением штаммов P. vulgaris (lg10).
Группу КОС составили S. haemolyticus (lg2,5) и S. epidermidis (lg1,5) – по 28,6%. Среди представителей грамположительной флоры только S. aureus выделяли из мочи со средним уровнем бактериурии lg4, формально превышающим нормативные показатели.
Стерильные биоптаты мочевого пузыря не были определены ни в одном из 28 наблюдений. Только НА выделены в 85,7% случаев, только аэробные – в 7,1%, аэробно-анаэробные ассоциации – в 7,1%.
Из аэробных бактерий в биоптатах регистрировали Corynebacterium sрp. (7,1%). Mycoplasma sрp. и Chlamidia sрp. обнаружили у 7,1% больных.
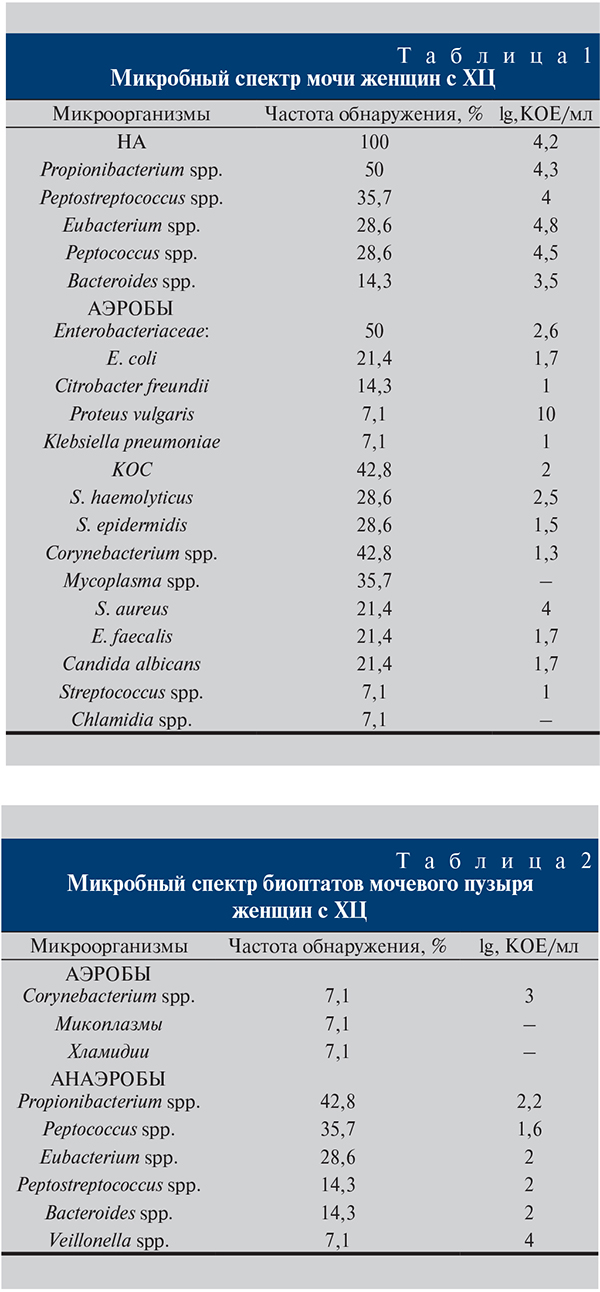
В биоптатах стенки мочевого пузыря, так же как и в моче, доминировали Propionibacterium sрp. (42,8±3,8; табл. 2). Eubacterium sрp. и Bacteroides sрp. выделяли с такой же частотой, как и из мочи, – 28,6 и 14,3% соответственно. В биоптатах чаще обнаруживали Peptococcus sрp. (35,7%) и реже Peptostreptococcus sрp. (14,3%). Veillonella sрp. регистрировали только в биоптатах (7,1%).
В 64,3% наблюдений обнаружено полное или частичное совпадение бактерий, выделенных из средней порции утренней мочи и биоптатов мочевого пузыря, при этом установлена высокая теснота ранговой коррелятивной связи (r=0,39, p<0,05) между видовыми характеристиками микроорганизмов. Совпадение по 1 микробу регистрировали в 35,7% случаев, по 2 микроорганизмам – в 21,4%. Лишь у 2 (7,1%) пациенток в моче и биоптатах регистрировали 3-компонентные ассоциации.
Вирусы достоверно чаще (35,7%) обнаруживали в биоптатах мочевого пузыря по сравнению со средней порцией утренней мочи (7,1%) (р<0,05). Спектр выделенных вирусов был представлен ВЭБ (21,4% наблюдений), ВПГ-2 (14,3%), ВПЧ (7,1%).
Моноварианты вирусов были выделены в 28,6% случаев, в составе вирусо-вирусной микст-инфекции – в 7,1%. В биоптатах мочевого пузыря вирусные патогены всегда обнаруживали совместно с бактериальными.
Обсуждение. Результаты проведенного расширенного микробиологического исследования с использованием классических бактериологических и питательных сред для аэробных, анаэробных бактерий и ПЦР-диагностики свидетельствуют о доминировании НА в моче женщин с ХЦ. Различные энтеробактерии присутствовали в моче лишь в половине случаев. Ни в одном случае нами не получено стерильных биоптатов мочевого пузыря. Из анаэробных бактерий в биоптатах обнаруживали лишь коринебактерии и микоплазмы. Представители семейства Enterobacteriaceae не были выявлены ни в одном из биоптатов. Герпеси папилломавирусы достоверно чаще обнаруживались в биоптатах мочевого пузыря. Только НА были выделены из биоптатов в 85,7% случаев. Данное обстоятельство, на наш взгляд, представляется чрезвычайно важным. Обнаружение идентичных видов НА в моче и биоптатах мочевого пузыря свидетельствует о существовании единого процесса инфицирования. В рамках данной работы мы не пытаемся дать объяснение этому факту, а лишь констатируем его.
Вопрос причастности НА к развитию инфекционного процесса в нижних мочевыводящих путях требует дальнейшего изучения. Однако у всех НА нами выявлен достаточно широкий арсенал различных факторов патогенности. Гемолитической активностью обладали 82% штаммов НА, выделенных из мочи, и 74% – из биоптатов мочевого пузыря. Подавляющее большинство культур (87 и 69% соответственно) обладали каталазной и уреазной активностью. Адгезивная активность выявлена у 73% штаммов НА, выделенных из мочи, и 68% – из мочевого пузыря.
Полученные нами данные о выделении НА из мочи и биоптатов мочевого пузыря с высоким уровнем бактериурии корреспондируют с патогенетической концепцией В. А. Гриценко [11] о транслокации бактерий из кишечника и экстраренальных очагов инфекции при возникновении инфекционного процесса различной локализации.
Выводы
- При хроническом рецидивирующем цистите у женщин в моче и биоптатах мочевого пузыря доминируют НА, причем уровень бактериурии для НА превышает во всех случаях предельно допустимую норму.
- Идентичные виды бактерий из средней порции утренней мочи и биоптатов мочевого пузыря выделяются в 64,3% случаев.
- Герпес- и папилломавирусы достоверно чаще (р<0,05) обнаруживаются в биоптатах мочевого пузыря по сравнению со средней порцией утренней мочи.



