Введение. Трансуретральная резекция (ТУР) мочевого пузыря остается основным видом вмешательства, выполняемым для диагностики и стадирования мышечно-неинвазивного рака мочевого пузыря (МНИРМП). Несмотря на то что ТУР – стандартная операция, все же в силу ряда объективных и субъективных причин ожидаемые лечебные и диагностические результаты достичь удается не всегда [1–5]. Частота выявления остаточной опухоли после первичной ТУР мочевого пузыря по поводу рака, по данным ряда авторов, составляет от 28 до 78%, а частота недооценки стадии – от 1,7 до 8% [1, 5, 6]. При морфологическом исследовании возможны трудности в точном определении стадии опухоли, a также всегда имеется некоторая неоднозначность при определении степени злокачественности опухоли [7–11]. Неправильная оценка степени злокачественности и глубины инвазии опухоли стала причиной выбора субоптимальной тактики лечения [2–4, 6, 12, 13].
Исследование морфологического материала, полученного при повторной ТУР, позволяет определять степень злокачественности и инвазии опухоли, т.е. устанавливать истинную стадию заболевания, и разрабатывать оптимальную тактику лечения.
Материалы и методы. С 2009 по 2012 г. был проведен ретроспективный анализ истории болезни 101 пациента, перенесшего повторную ТУР мочевого пузыря по поводу рака. Интервал между операциями составил от 2 до 8 нед. Для всех пациентов был подтвержден диагноз переходно-клеточного РМП. Среди больных были 82 (81,2%) мужчины и 19 (18,8%) женщин. Средний возраст пациентов составил 67,3±9,2 (32–88) года (табл. 1). Показанием к повторной ТУР служили отсутствие мышечного слоя при плановом гистологическом исследовании препарата, стадия опухоли Т1, степень анаплазии G3, большие размеры опухоли, «неполная» ТУР. При выполнении повторной ТУР резецировали ткани в области ложа ранее удаленной опухоли, а также все подозрительные участки. Морфологические результаты оценивали в зависимости от размера и количества опухолей, степени дифференцировки и наличия мышечного слоя в препарате. Как видно из табл. 1, единичные опухоли диагностировали чаще, чем мультифокальные поражения. Более половины (58,4%) пациентов имели опухоли высокой степени злокачественности. Отсутствие мышечного слоя при плановом гистологическом исследовании препарата после первичной ТУР выявлено у 33,7% пациентов.
Результаты. Повторный морфологический анализ биопсийного материала позволил выявить 35,6% резидуальных опухолей, причем в 23% случаев диагностирован рак той же стадии, в 5% – более низкой стадии: Та. Недооценка стадии по результатам первичной ТУР мочевого пузыря зарeгистрирована в 7,9% наблюдений.
 У 24,7% пациентов резидуальные опухоли выявлены по данным гистологического исследования (табл. 2).
У 24,7% пациентов резидуальные опухоли выявлены по данным гистологического исследования (табл. 2).
К причинам, снижающим эффективность первичной ТУР, относят размер опухоли и множественность поражения. Нами отмечена статистически значимая разница в выявляемости резидуальных опухолей и мышечной инвазии в зависимости от размера опухоли. Так, при опухолях размером более 3 см частота выявления резидуальных опухолей и мышечной инвазии составила 44,8 и 12,1%, менее 3 см – 23,2 и 2,3% соответственно (табл. 3).
Статистически достоверной разницы в частоте выявления резидуальной опухоли и мышечной инвазии в зависимости от количества опухолей мы не получили, тем не менее резидуальные опухоли немного чаще выявлялись при множественных опухолях по сравнению с единичными – 42,6 и 31,7% соответственно (табл. 4).
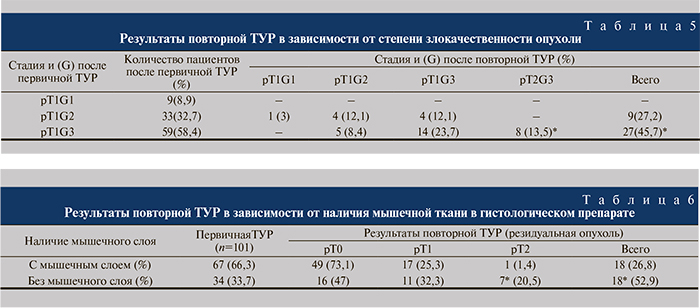
Важным фактором, влияющим на тактику лечения, является степень злокачественности опухоли. Анализ результатов показал статистически достоверную разницу в выявлении резидуальных опухолей и инвазии в мышечный слой в зависимости от степени злокачественности. Так, резидуальная опухоль выявлена в 45,7% случаев при рТ1G3 и в 27,2% – при рТ1G2. При этом мышечная инвазия отмечена только при низкодифференцированной опухоли в 13,5% случаев. У 8,4% пациентов с первично диагностированной опухолью высокой степени злокачественности по данным повторной ТУР констатирована более низкая степень злокачественности. Изменение степени злокачественности опухоли в сторону усугубления и уменьшения отмечено и у пациентов с Т1G2: в 12,1 и 3% наблюдений соответственно (табл. 5).
Одной из причин постановки неадекватной стадии заболевания при первичной ТУР является отсутствие в гистологическом препарате мышечной ткани. На основании данных, представленных в табл. 6, установлено, что частота выявления резидуальной опухоли и мышечной инвазии статистически достоверно отличалась в отсутствие или при наличии мышечной ткани в гистологическом материале после первичной ТУР. Резидуальная опухоль выявлена в 52,9% случаев в отсутствие мышечной ткани в препарате и в 26,8% – при наличии мышечной ткани в препарате после первичной ТУР. Частота выявления мышечной инвазии также статистически значимо зависела от того, определялась ли мышечная ткань в препарате после первичной ТУР. При наличии мышечной ткани инвазия отмечена в 1,4% случаев, а в ее отсутствие – в 20,5%.
Обсуждение. Несмотря на то что ТУР является стандартной операцией при раке мочевого пузыря, выполняемой многими урологами, все же диагностические и лечебные результаты после ее выполнения достигаются не всегда. Так, частота выявления резидуальной опухоли при выполнении повторной ТУР у пациентов с Т1, по данным литературы, составляет от 28 до 78%, а частота недооценки стадии заболевания – от 1,7 до 8% [1–4, 6]. Согласно нашим данным, эти показатели составили 35,6 и 7,9% соответственно. Невысокую частоту выявления резидуальной опухоли при повторной ТУР в нашей клинике можно объяснить агрессивным характером ее выполнения и достаточным опытом оперирующих урологов. Впрочем, по данным литературы, у пациентов, подвергнутых ТУР, даже у опытных урологов частота рецидивов была довольно высокой. Так, M. Zurkirchen и соавт. [13] из 214 пациентов, подвергнутых повторной ТУР, рецидив отметили у 37% больных, оперированных молодыми хирургами, и у 26%, оперированных опытными докторами.

Почему же так высока частота резидуальной опухоли после первичной ТУР, и, с другой стороны, почему даже опытные урологи часто не способны удалить опухоль целиком с первого раза? Ответ кроется в трудностях некоторых операций. Иногда ТУР трудновыполнима при множественных опухолях, особенно при сочетании Т1 и cis, опухоль можно не обнаружить, если она расположена в труднодостижимой области, например в верхушке, на передней стенке, в шейке мочевого пузыря или в уретре. Все это делает ТУР наверняка нерадикальной операцией – даже в руках опытного уролога [2, 5, 14]. Кроме того, развитие МНИРМП трудно предугадать из-за гетерогенности самой опухоли [1, 15]. У части пациентов наблюдается длительное безрецидивное течение заболевания, в то же время у определенной категории пациентов отмечается прогрессирование рака в мышечно-инвазивный.

К объективным причинам, снижающим эффективность стандартной ТУР мочевого пузыря, следует отнести характер первичного поражения мочевого пузыря – единичный или множественный, размер опухоли более или менее 3 см [2, 5]. Так, по данным M. Babjuk и соавт. [16], если при первичной ТУР была обнаружена единичная опухоль, резидуальная опухоль обнаруживается с частотой до 25%, соответственно, при множественном поражении выявляемость резидуальной опухоли составляет 59%. Нами получены статистически значимые различия в частоте выявления резидуальной опухоли и инвазии в мышечный слой в зависимости от размера опухоли. В то же время мы не отметили достоверной разницы в частоте выявления резидуальной опухоли и инвазии в мышечный слой в зависимости от количества опухолей. Тем не менее резидуальные опухоли чаще выявлялись при множественном поражении, что можно объяснить небольшими размерами опухолей, которые легко могли быть не замечены и пропущены при ТУР, особенно если одна из опухолей больших размеров.
Важными параметрами, влияющими на тактику лечение, являются степень злокачественности и глубина инвазии опухоли. Конечно, точность трактовки напрямую зависит от патоморфолога, изучающего микропрепарат, и разные специалисты могут дать разную оценку указанным показателям. Так, по данным A. Van Der Meijden и соавт. [7], только в 61% из 160 случаев опухолей G3 патоморфолог повторно согласился с наличием низкодифференцированного рака и лишь в 47% из 88 случаев при T1G3 повторное морфологическое заключение совпало с первичным. Анализ собственных результатов повторного морфологического исследования удаленных тканей показал изменение степени злокачественности опухоли у 10,8% пациентов. При этом все выявленные инвазивные резидуальные опухоли имели высокую степень злокачественности, что, безусловно, подтверждает мнение о целесообразности проведения повторной ТУР.
Однако патоморфолог исследует тот материал, который ему предоставляет оперирующий уролог, а этот материал может быть неполноценным. Отсутствие мышечной ткани в препарате делает ТУР нерадикальной операцией и увеличивает частоту выявления резидуальных опухолей и мышечной инвазии [8, 9, 11, 12, 16, 17]. По данным R. Divrik и соавт. [8], собственная пластинка в гистологическом материале после первичной ТУР присутствовала только в 49% изучаемых препаратов. По данным N.A. Maruniak и соавт. и Grigor K.M. и соавт., отсутствие lamina propria и мышечного слоя в препарате после первичной ТУР наблюдалось от 34 до 66% (9, 10). В нашей работе мы также сравнивали результаты в зависимости от наличия мышечной ткани в удаленном препарате. Отсутствие мышечного слоя у пациентов при плановом гистологическом исследовании препарата после первичной ТУР выявлено у 33,7%, но и после повторной ТУР также имело место отсутствие мышечного слоя в препарате у 16,8% пациентов, что подтверждает мнение, будто ТУР является операцией с непредсказуемым результатом; зачастую о глубине инвазии опухоли можно только догадываться. Резидуальную опухоль и мышечную инвазию статистически достоверно чаще наблюдали в отсутствие мышечного слоя после первичной ТУР, что подтверждает мнение об абсолютном показании к повторной ТУР при неуверенности хирурга в радикальности выполненной операции и в отсутствие мышечного слоя в гистологическом препарате.
Выводы
- Проведение повторной ТУР мочевого пузыря по поводу мышечно-неинвазивного рака позволяет обеспечивать оптимальный местный контроль, получать дополнительный гистологический материал для морфологического исследования с целью уточнения стадии заболевания, на основании этого определиять адекватную тактику лечения и удалять резидуальную опухоль.
- Повторная ТУР должна рассматриваться как обязательная процедура при лечении МНИРМП с неблагоприятным прогнозом.



