Введение. Ведущее место в структуре инфекционно-воспалительных заболеваний мочевыводящих путей занимает пиелонефрит, доля которого превышает таковую всех заболеваний почек вместе взятых, при этом ежегодно 1% населения Земли заболевает пиелонефритом. В связи с этим большое значение уделяется хроническому пиелонефриту (ХП) как одному из наиболее часто встречающихся заболеваний почек.
Вопросы, касающиеся этиологии, механизмов развития и прогрессирования ХП, довольно широко освещены в трудах отечественных и зарубежных ученых [1–6].
В настоящее время в патогенезе пиелонефрита важное значение придается мембранопатологическим процессам, в частности процессам липопероксидации, избыточной активности эндогенных фосфолипаз, дефициту антиоксидантов, которые реализуют свое патологическое действие в очаге воспаления [7–11]. Однако, несмотря на широкий спектр выявленных патологических факторов, некоторые вопросы, касающиеся конкретных механизмов мембранодестабилизации, приводящих к прогрессированию ХП, изучены недостаточно и требуют уточнения.
В настоящее время доказано, что хронические заболевания почек сопровождаются активацией симпатоадреналовой системы, что в свою очередь увеличивает риск развития сердечно-сосудистых заболеваний и скорость прогрессирования хронической почечной недостаточности [12]. Однако до сих пор практически не изучена активность данной системы при ХП.

Цель исследования: дать характеристику процессов липопероксидации, антиоксидантной защитной функции мембран нейтрофилов и состояния симпатоадреналовой системы у больных ХП.
Материалы и методы. Под нашим наблюдением находились 108 пациентов в возрасте от 18 до 59 лет (средний возраст – 40,26±10,09 года) с вторичным ХП на фоне нефролитиаза в фазе активного воспаления. Большинство — 89 (82,4%) человек — составили женщины. Длительность заболевания у женщин – 6,54±3,23, у мужчин – 4,35±2,67 года (р<0,05).
Диагноз ХП устанавливали в соответствии с клинической классификацией Н.А. Лопаткина и В.Е. Родомана (1974).
Обследование включило сбор жалоб, анамнеза, физикальное обследование, биохимическое исследование крови с определением уровня глюкозы, мочевины, креатинина, общего белка и белковых фракций, билирубина, общего холестерина, фибриногена. Определяли скорость клубочковой фильтрации по формуле Кокрофта—Голта. Концентрационная и выделительная способность почек оценивалась по результатам пробы Зимницкого. Проводили бактериологическое исследование мочи с определением чувствительности выделенных микроорганизмов к противомикробным средствам.
Для исключения венерических и воспалительных заболеваний репродуктивной системы пациенты были обследованы дерматовенерологом и гинекологом (женщины).
Специальные методы исследования включили определение активности процессов липопероксидации, антиоксидантной системы и структурных параметров клеточных мембран полиморфно-ядерных лейкоцитов (ПЯЛ). Уровень диеновых конъюгатов (ДК) определяли по методу И. Д. Стальной (1977), малонового диальдегида (МДА) — по методу И. Д. Стальной, Т. Г. Гаришвили (1977). Для определения содержания α-токоферола использовали дипиридин в присутствии хлорного железа (Рудакова-Шилина Н. Р., Матюков Л. Д., 1982).
Содержание основных фракций фосфолипидов (лизофосфатидилхолина — ЛФХ, фосфатидилсерина — ФС, сфингомиелина — СМ, фосфатидилхолина — ФХ, фосфатидилэтаноламина — ФЭА, фосфатидных кислот — ФК) и холестерина (свободного холестерина — СХ, эфиров холестерина — ЭХ, общего холестерина — ОХ) в мембранах ПЯЛ определяли методом тонкослойной хроматографии.
Активность симпатоадреналовой системы оценивали по уровню суточной экскреции с мочой катехоламинов, который определяли флюориметрическим методом на анализаторе биожидкостей Флюорат–02-АБЛФ. Концентрацию адреналина в суточной моче определяли по формуле: Ссут А =(СобрА×7×4×Д)/(17,5×1000)=(СобрА×1,6×Д)/1000 мг/сут (коэффициент перевода в нмоль/л=5,455). Концентрацию норадреналина в суточной моче определяли по формуле: СсутА=(СобрА×7×4×Д)/(17,5×1000)=(СобрА×1,6×Д)/1000 мг/сут (коэффициент пересчета в нмоль/24 ч=5,91), где СсутА (концентрация в суточной моче адреналина), СобрА, Д (концентрация адреналина в обрабатываемой порции мочи).

Комплексное обследование, динамическое наблюдение и лечение пациентов исследуемых групп проводили на базе отделения урологии ОКБ № 2 и многопрофильной клиники ТюмГМА в течение 2004–2007 гг.
В качестве контроля использовали показатели 30 практически здоровых лиц аналогичного места жительства, сопоставимых по полу и возрасту.
Тестирование параметров распределения проводилось с помощью критериев Колмогорова–Смирнова, асимметрии и эксцесса. Для определения статистической значимости различий непрерывных величин использовали двусторонний непараметрический U-критерий Манна–Уитни, для качественных признаков различия установлены методом χ2. Непрерывные переменные представлены в виде средней и стандартного отклонения (M±SD). Для исследования зависимостей между переменными использовали коэффициент ранговой корреляции Спирмена (r).
Результаты. При анализе клинических проявлений заболевания обнаружено, что боли в поясничной области отмечались у 86% больных ХП, различные проявления интоксикационного синдрома регистрировали у 100% пациентов, дизурия — у 72%, отечность параорбитальной клетчатки — у 27,8% и повышение АД — у 36,11%. Температура тела на момент госпитализации составила в среднем 37,45±0,94ОС, ЧСС — 83,65±12,42 в 1 мин, систолическое АД – 143,9±13,87 мм рт. ст., диастолическое АД – 85,57±10,34 мм рт. ст.

Односторонний характер патологического процесса констатирован у 47 (43,52%) пациентов, из них у 3 (2,78%) отмечалось поражение единственной почки, двусторонний — у 61 (56,48%). Анализ частоты обострений ХП показал, что у 67 (62,04%) пациентов частота обострений составляла 1–2 раза в год, у 32 (29,63%) — реже 1 раза в год, у 9 (8,33%) — более 2 раз в год. В среднем частота обострений у пациентов исследуемых групп составила 1,35±0,62 случая в год.
По результатам общего и биохимического анализа крови отмечен достоверно более высокий уровень абсолютного количества лейкоцитов (р<0,01), СОЭ (р<0,001) и фибриногена (p<0,001). Также обнаружено увеличение относительного количества α2-глобулинов (p<0,01) и γ-глобулинов (p<0,05; табл. 1).
 В пробе мочи по Нечипоренко лейкоцитурия (более 4000 в 1 мл) выявлена у 92 (85,19%) пациентов, эритроцитурия (более 1000 в 1 мл) — у 23 (21,3%). По результатам пробы Зимницкого суточный диурез составил 2132,29±315,07 мл, в том числе дневной 1461,87±242,61 мл, ночной 583,5±96,13 мл; удельный вес колебался от 1005,625±1,11 до 1019,750±3,93.
В пробе мочи по Нечипоренко лейкоцитурия (более 4000 в 1 мл) выявлена у 92 (85,19%) пациентов, эритроцитурия (более 1000 в 1 мл) — у 23 (21,3%). По результатам пробы Зимницкого суточный диурез составил 2132,29±315,07 мл, в том числе дневной 1461,87±242,61 мл, ночной 583,5±96,13 мл; удельный вес колебался от 1005,625±1,11 до 1019,750±3,93.
У 54 (50%) больных признаки хронической болезни почек (ХБП) отсутствовали, у 31 (28,7%) констатировали ХБП-2 (снижение скорости клубочковой фильтрации от 60–89 мл/мин), у 23 (21,3%) — ХБП-3(с умеренным снижением скорости клубочковой фильтрации от 30Ц59 мл/мин). Рост патогенной микрофлоры выявлен у 83 (76,85%) пациентов. Было выделено 89 штаммов микроорганизмов. В 93,25% случаев выявлялся один возбудитель, в 6,75% – наблюдались микробные ассоциации, наиболее часто регистрировали двухкомпонентную ассоциацию – E. coli и Enterococcus.
Таким образом, в расчете на общее число пациентов с ХП в фазе активного воспаления у 25 (23,15%) больных микрофлора по результатам бактериологического исследования мочи не обнаружена. Грамотрицательная флора выявлена у 58 (53,7%), грамположительная — у 17 (15,74%), Candida albicans — у 4 (3,7%), двухкомпонентная ассоциация микроорганизмов — у 3 (2,78%) и трехкомпонентная ассоциация — у 1 (0,93%).
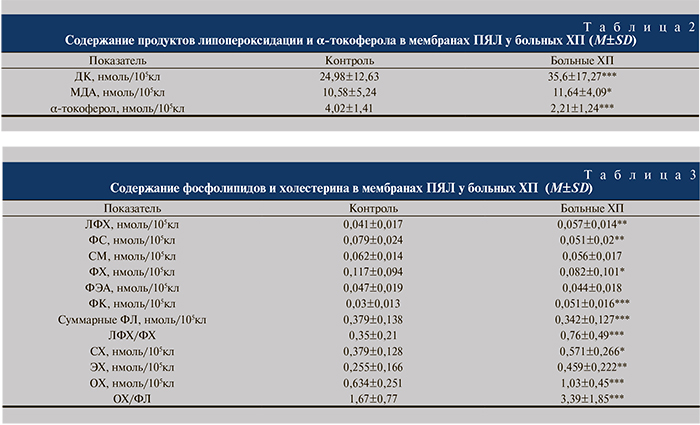
Среднее содержание ДК в мембране ПЯЛ (табл. 2) в 1,43 раза превосходило контрольные величины (p<0,001), МДА — в 1,1 раза (p<0,05). Содержание α-токоферола в мембранах ПЯЛ составило 55% от уровня практически здоровых лиц (p<0,001).
При исследовании фракционного состава липидного бислоя мембран ПЯЛ обнаружено достоверно более высокое содержание агрессивных фракций фосфолипидов (ЛФХ, ФК) на фоне уменьшения содержания ФХ и ФС относительно контрольных показателей, что привело к снижению общего количества ФЛ (p<0,001), при этом общее содержание холестерина было увеличено (табл. 3). Увеличение соотношения ЛФХ/ФХ и ОХ/ФЛ у пациентов с ХП в 2,16 и 2,03 раза соответственно следует рассматривать как подтверждение нестабильности мембран ПЯЛ в период активности микробно-воспалительного процесса в мочевыводящих путях.
У больных ХП в фазе активного воспаления с выраженным интоксикационным синдромом в мембранах ПЯЛ достоверно повышено содержание ДК (p<0,01), ФК (p<0,05), ЛФХ (p<0,01) и соотношение ОХ/ОФЛ (p<0,05) относительно пациентов с умеренно выраженным интоксикационным синдромом (табл. 6). Также у пациентов с ХП в фазе активного воспаления и выраженным интоксикационным синдромом в мембранах ПЯЛ достоверно уменьшается концентрация α-токоферола (p<0,05) и ФХ (p<0,05), тогда как суммарное содержание ФЛ практически не изменяется.
Кроме этого обнаружена статистически значимая взаимосвязь (табл. 4) выраженности болей в поясничной области с содержанием в мембранах ПЯЛ продуктов липопероксидации, ФЛ и холестерина.
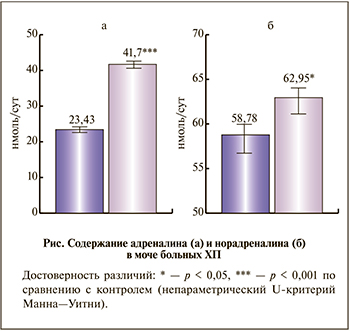
Выявлено достоверное увеличение экскреции с мочой адреналина (p<0,001) и норадреналина (p<0,05), что косвенно свидетельствует о повышении активности симпатоадреналовой системы (см. рисунок). В свою очередь активация данной системы способствует росту АД, что обусловливает дополнительное повреждающее действие на структуры мембран ПЯЛ. Подтверждением данного предположения служат результаты корреляционного анализа АД с показателями, отражающими состояние мембран нейтрофилов (табл. 5).
Обсуждение. В ходе проведенного исследования установлено, что у больных ХП на фоне МКБ имеют место изменения активности процессов липопероксидации и структурно-функционального состояния клеточных мембран ПЯЛ в активную фазу воспалительного процесса в почках.

В проведенных ранее исследованиях [13] обнаружено, что у больных ХП происходит увеличение уровня вторичного продукта липопероксидации — МДА в моче, причем наиболее значительные изменения активности процессов липопероксидации отмечены при максимально выраженной активности инфекционно-воспалительного процесса в почках. По мнению автора [14], повышенная экскреция вторичных продуктов липопероксидации с мочой и повышение ее антиокислительной активности являются, вероятно, отражением локальной активации перекисных и антиперекисных процессов почечной паренхиме.
В дальнейшем в ходе проведенного исследования нами было установлено, что у больных ХП на фоне МКБ выявляются достоверные корреляционные взаимосвязи средней силы, активности процессов липопероксидации, структурно-функционального состояния мембран ПЯЛ со степенью выраженности болей, интоксикационного синдрома, с рядом лабораторных проявлений, отражающих активность воспалительного процесса в почечной ткани.
Течение ХП осложняется нарушением метаболизма липидов, зависящих как от функционального состояния почек, так и от активности воспалительного процесса [4, 15].
В настоящей работе также выявлено, что у больных ХП на фоне МКБ в фазе активного воспаления отмечается повышение экскреции с мочой катехоламинов (адреналина и норадреналина), что косвенно свидетельствует о повышении активности симпатоадреналовой системы, которая способствует повышению артериального давления и оказывает повреждающее действие на структурно-функциональное состояние мембран полиморфно-ядерных лейкоцитов.
В реализации инфекционно-воспалительного процесса большая роль уделяется стресс-системе – сложному регуляторному комплексу, который помогает координировать гомеостаз в обычных условиях и играет ключевую роль в активации и координации всех изменений в организме, составляющих адаптивную реакцию на стрессоры, в том числе на инфекционные заболевания [16, 17].
Главным фактором, приводящим к активации симпатоадреналовой системы при хронических заболеваниях почек, большинство исследователей считают ишемию почек, что было подтверждено в экспериментальных исследованиях, в ходе которых отмечено повышение активности симпатоадреналовой системы на фоне стенозирования почечной артерии [18].
Таким образом, в реализации мембранопатологических процессов при инфекционно-воспалительных заболеваниях почек существенное значение придается гипоксии [19]. Роль гипоксии при инфекционно-воспалительных заболеваниях в почках приобретает первостепенное значение и влечет за собой не только прекращение процессов синтеза структурных компонентов мембран, но и непосредственно их разрушение [20].
На основании данных об уровне катехоламинов в моче у больных ХП можно судить о прогрессировании заболевания, а также об эффективности нефропротективной терапии.


