Введение. Хронический рецидивирующий цистит у женщин представляет собой важную социально-экономическую проблему [1].
Персистенция микроорганизмов – одна из основных причин развития рецидивов инфекционно-воспалительного процесса в стенке мочевого пузыря. Данное обстоятельство обусловлено ростом рези- стентности микроорганизмов к традиционно используемым антибактериальным препаратам [2–4]. Даже после полной эрадикации патогенов из просвета мочевых путей инфекция способна сохраняться в стенке мочевого пузыря, тем самым обусловливая риск рецидива инфекции нижних мочевых путей (ИНМП) [3, 4].
Рост резистентности микроорганизмов к антибиотикам является, в частности, следствием их бесконтрольного применения, зачастую без учета результатов культурального исследования мочи и индивидуальных антибиотикограмм [5].
Как известно, уротелий представляет собой уникальный тонкий защитный слой, препятствующий проникновению бактерий в стенку мочевого пузыря. Результатом длительного инфекционно-воспалительного процесса в стенке мочевого пузыря может быть гипоксия и ишемия уротелия с последующим нарушением проницаемости гликозаминогликанового (ГАГ) слоя слизистой мочевого пузыря. Вследствие этого рецепторы уротелия открываются и становятся готовыми к взаимодействию с рецепторами микроорганизма [6]. Нарушение проницаемости ГАГ-слоя слизистой мочевого пузыря с изменениями в различных звеньях местной иммунологической защиты: синтез лактоферрина, лизоцима, интерферона и т.д., могут способствовать активации ИНМП. В сложившейся ситуации проводимая антибактериальная терапия не всегда эффективна, а иногда ее необоснованность и нерациональность служат дополнительным фактором, приводящим к хронизации процесса, нарушениям местных и общих иммунорегуляторных механизмов [7]. Именно поэтому с целью повышения эффективности антибактериальной терапии в последние годы приобрели актуальность альтернативные методы лечения: пробиотики, фитопрепараты, иммуномодуляторы [7, 9]. Естественно, при назначении лекарственных средств указанных групп необходимо учитывать различия в механизмах действия и скорости наступления лечебного эффекта.
 Наиболее эффективная элиминация бактерий из мочевых путей достигается в результате проведения комплексной терапии антибиотиками в сочетании с иммуномодуляторами [8, 9].
Наиболее эффективная элиминация бактерий из мочевых путей достигается в результате проведения комплексной терапии антибиотиками в сочетании с иммуномодуляторами [8, 9].
За последние годы появился ряд публикаций, демонстрирующих эффективность иммуномодулирующей терапии, в частности интерферонов [2, 8]. Включение интерферона в комплексное лечение инфекций мочевой системы обусловлено тем, что персистирующие бактериальные патогены повреждают клетки уроэпителия и препятствуют синтезу собственных интерферонов [1]. Из трех идентифицированных видов интерферона человека – α, β и γ – в терапии латентных форм ИНМП используют препараты интерферона-α [7, 8, 10]. Среди них наиболее известен виферон® – комплексный препарат, содержащий интерферон-α2b, токоферола ацетат и аскорбиновую кислоту. Он оказывает противовирусное, иммуномодулирующее, антипролиферативное и антибактериальное действия. Токоферол и аскорбиновая кислота, являясь компонентами антиоксидантной системы, обладают мембрано- cтабилизирующим эффектом, способствуют регенерации тканей, улучшают тканевое дыхание, тем самым уменьшая выраженность процессов воспаления в стенке мочевого пузыря при нарушенной проницаемости его мукополисахаридной субстанции. Данные обстоятельства позволяют использовать виферон® как при нарушении проницаемости ГАГ-слоя слизистой мочевого пузыря, когда необходима антиоксидантная и регенеративная активность для снижения инфекционно-воспалительного процесса в стенке мочевого пузыря, так и при дисбалансе иммунорегуляторных механизмов защиты, произошедших от воздействия различных этиологических факторов при ИНМП [2].
Цель – изучение эффективности комбинированной терапии, сочетающей антибактериальное средство и препарат интерферона, в лечении рецидивирующего цистита.
Материалы и методы. В исследование включены 43 женщины (средний возраст – 39,5±1,2 года) с хроническим рецидивирующим циститом. Продолжительность заболевания в среднем составила 6,5±1,8 года. Критерии включения: наличие симптомов ИНМП, тяжелое рецидивирующее течение (более 6 за год), отсутствие анатомических и функциональных нарушений мочевых путей, этиологическая причастность Е. coli≥103 КОЕ/мл, отсутствие персистирующей вирусной инфекции, чувствительность микроорганизма к фосфомицину по результатам бактериологического исследования мочи. Обследование пациенток включило общеклиническое и культуральное исследования мочи, молекулярно-биологическое исследование (ПЦР – полимеразная цепная реакция) мазков из уретры, цистоскопию с биопсией с молекулярно-биологическим и морфологическим исследованием биоптатов по показаниям, консультацию гинекологом и УЗИ. Посевы мочи и определение степени бактериурии проводили по общепринятым методикам. Идентификацию выделенных штаммов микроорганизмов осуществляли по морфологическим, тинкториальным, культуральным и биохимическим свойствам. Чувствительность выделенных из мочи микроорганизмов к антибиотикам определяли дискодиффузионным методом в соответствии с МУК 4.2.1809-06 с помощью стандартных дисков фирмы «Himedia» (Индия).
Для анализа интенсивности боли использовали визуальную аналоговую шкалу (ВАШ); пациенткам предлагали оценить интенсивность болей по 5-балльной системе: 4 – очень интенсивные боли, 3 – интенсивные, 2 – умеренные, 1 – слабовыраженные, 0 – отсутствие болей.
В зависимости от проводимой терапии пациентки разделены на две группы. Пациентки 1-й группы (n=20) получали только фосфомицина триметамол 3 г через каждые 10 дней в течение 3 мес, во 2-й группе (n=23) – аналогичную антибактериальную терапию в сочетании с препаратом виферон®, (суппозитории ректальные), который назначали по 1 млн МЕ per rectum 2 раза в сутки с интервалом 12 ч в течение 20 дней.
Группы пациенток были сопоставимы по возрасту, длительности заболевания, этиологической структуре (характеру и количеству уропатогена). Средний возраст пациенток в 1-й группе составил 37,2±1,0 год, во 2-й – 39,0±1,2 года, продолжительность заболевания – 6,3±2,2 и 5,9±1,3 года соответственно. В обеих группах при бактериологическом исследовании мочи была идентифицирована Е. coli в количе- стве≥103 КОЕ/мл.
Статистическую обработку результатов осуществляли с использованием программы STATISTICA 7.0 (StatSoftInc., США), MedCalc (версия 9.3.5.0) и MicrosoftExcel.
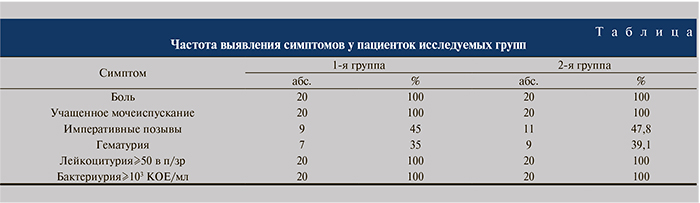
Результаты. При оценке исходных данных между группами не было выявлено статистически значимых (p<0,05) различий в частоте выявления симптомов. У всех обследованных женщин регистрировали болевой синдром и учащенное мочеиспускание (см. таблицу).
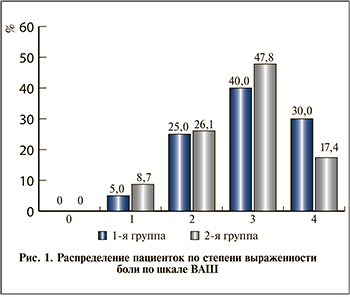
По степени интенсивности болевого синдрома пациентки обеих группы были сопоставимыми. У большей части пациенток оценка по шкале ВАШ соответствовала 3 баллам (рис. 1).
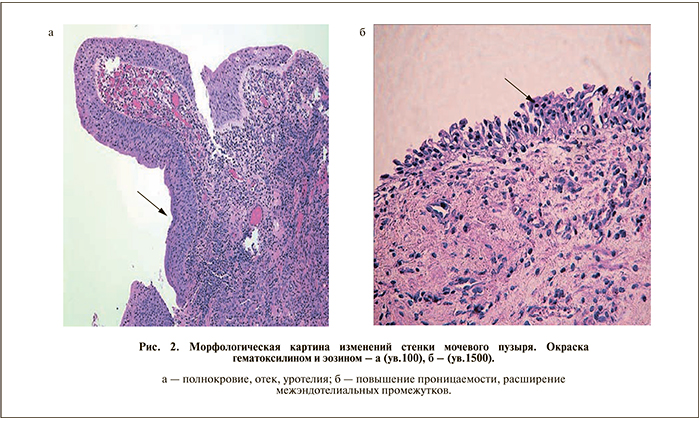
С учетом наличия рецидивирующего процесса и неэффективности проводимой прежде антибактериальной и противовоспалительной терапии 15 пациенткам (7 в 1-й группе и 8 во 2-й) выполнили цистоскопию с биопсией мочевого пузыря с целью исключения иного патологического процесса мочевого пузыря. Визуально эндоскопическая картина характеризовалась наличием поверхностных сосудистых изменений стенки мочевого пузыря, характер изменений зависел от степени воспалительной реакции. При гистоморфологическом анализе обнаружена выраженная воспалительная реакция, характеризующаяся отеком и полнокровием уротелия, местами отмечены десквамация и реактивные изменения уротелия с нарушением проницаемости ГАГ-слоя (рис. 2).
Повышение проницаемости ГАГ-слоя характеризовалось нарушением плотных контактов зонтичных клеток, которые составляют верхние слои уротелия, сообща выполняя работу по поддержанию целост- ности поверхности эпителия. Данные изменения привели к нарушению функционирования одного из главных защитных механизмов слизистой оболочки мочевого пузыря.
Эффективность терапии оценивали через 1 и 12 мес после ее завершения. Через 1 мес положительная динамика с нормализацией клинических и лабораторных показателей отмечена у всех пациенток обеих групп. Однако спустя 12 мес рецидив болевого синдрома в 1-й группе имел место у 25% пациенток, а во 2-й не отмечен ни у одной пациентки (p<0,05). Учащенное мочеиспускание выявлено в 1-й и 2-й группах в 30 и 8,6% случаев соответственно. Лейкоцитурию регистрировали у пациенток 1-й группы в 40% наблюдений, во 2-й – в 8,6% (p<0,05).
Через 12 мес при контрольном культуральном исследовании мочи E. coli достоверно чаще (p<0,05) обнаруживали в 1-й группе (8 пациенток) по сравнению со 2-й (3 пациентки). Уровень бактериурии в 1-й группе составил 103 КОЕ/мл, во 2-й – 102 КОЕ/мл.
Обсуждение. Персистирующая ИНМП – распространенное и трудноизлечимое заболевание у женщин вследствие многогранности патогенеза заболевания. Поиск путей лечения и профилактики ИНМП требует понимания всех механизмов патогенеза заболевания, роли макроорганизма и особенностей персистенции бактериальных факторов. Когорта пациенток, которую оценивали в этом исследовании, была сложной, так как выделенные из мочи уропатогены обладали множественной лекар- ственной устойчивостью из-за многократного применения антибактериальной терапии.
В ходе морфологического исследования была подтверждена роль нарушения целостности и как следствие – проницаемости ГАГ-слоя как главного барьера против любого бактериального фактора в патогенезе инфекционно-воспалительного процесса в стенке мочевого пузыря. Так, через 12 мес после завершения терапии клинико-лабораторную эффективность достоверно чаще (p<0,05) регистрировали во 2-й группе по сравнению с 1-й – 91,4 против 60,0% пациентов. Включение иммуномодулятора в комплексную терапию персистирующей ИНМП способствовало сокращению частоты рецидивов в 1,5 раза и уменьшению числа пациенток с рецидивами в 4 раза. Назначение только антибактериальных препаратов, а особенно тех, которые плохо проникают в ткани мочевого пузыря, не решает задачу лечения рецидивирующего цистита. Наиболее эффективно применение иммуномодулирующей терапии в сочетании с антибактериальной. Использование препаратов интерферона-α2b в сочетании с антиоксидантами при рецидивирующем цистите патогенетически обосновано, так как ряд возбудителей ИМП обладает супрессивным действием как на местный иммунитет МП в целом, так и на выработку самих интерферонов.
Выводы
- Патогенез хронического рецидивирующего цистита многогранен и может характеризоваться нарушением некоторых механизмов иммунологической защиты мочевого пузыря.
- Различные нарушения иммунологической защиты мочевого пузыря диктуют необходимость использования лекарственных средств, способствующих активации иммунокомпетентных звеньев, снижающих персистенцию микроорганизмов в мочевых путях. Комбинированная терапия, включающая антибактериальный препарат и препарат интерферона в лечении рецидивирующего цистита, приводит к снижению болевого синдрома, выраженности и частоты выявления дизурии, лейкоцитурии и бактериурии.
- Использование препарата виферон® (суппозитории ректальные) в сочетании с антибактериальной терапией снижает частоту рецидивов хронического цистита и, на наш взгляд, является одним из успешных подходов к лечению заболевания.


