Введение. Второй по частоте причиной развития обструктивного мочеиспускания у мужчин после доброкачественной гиперплазии предстательной железы являются приобретенные сужения (стриктуры) и облитерации мочеиспускательного канала (CУ) [1–3]. При этом статистически к ним не относят меатостеноз и первичный стеноз шейки мочевого пузыря, возникновение которых, как правило, связано со склеротическим баланитом и склерозом предстательной железы соответственно.
В основе возникновения стриктур и облитераций мочеиспускательного канала в настоящее время различают несколько наиболее часто встречающихся причин:
- травмы костного тазового кольца со смещением отломков, приводящие к дистракционным повреждениям уретры на уровне тазовой диафрагмы;
- прямые открытые и закрытые травмы промежности;
- ятрогенные повреждения мочеиспускательного канала при трансуретральных эндоскопических вмешательствах на простате, мочевом пузыре и верхних мочевыводящих путях;
- недостаточная эффективность антибактериального лечения острых уретритов (гонорейных, хламидийных и др.);
- длительная уретральная катетеризация больных в палатах реанимации и интенсивной терапии (так называемые катетерные стриктуры);
- использование при коротких стриктурах уретры паллиативных методик лечения, главным образом внутренней оптической уретротомии (ВОУТ) [1, 3–7].

Общепризнанным и доказанным фактом является то, что при возникновении рецидива СУ, а также вследствие повторных хирургических вмешательств в виде резекции протяженность дефекта мочеиспускательного канала увеличивается на 2–3 см и более [1, 8–10]. Главной причиной такого «роста дефицита» уретральной ткани служит особенность анатомической структуры спонгиозного тела, которая в свою очередь является не чем иным, как обширным и протяженным венозным сплетением, где возникает типичное флебитическое воспаление с исходом в спонгиофиброз [1]. Именно эти два обстоятельства – хроническое вялотекущее воспаление и дефицит естественной уретральной ткани – определяют сложность повторной хирургии, увеличивают раз от раза риск неудовлетворительного результата и нередко побуждают хирурга выбирать многоэтапную тактику выполнения оперативного лечения [1, 11–13].

Целью данного исследования стал клинико-статистический анализ «годичного среза» хирургии стриктур и облитераций уретры различного генеза в урологическом центре, имеющем опыт лечения более 5500 больных СУ на протяжении 60 лет.
Материалы и методы. В 2013 г. для лечения стриктур и облитераций уретры были госпитализированы 113 мужчин в возрасте 18–80 лет. В табл. 1 и 2 представлены показатели возраста пациентов и длительности болезни в зависимости от этиологического фактора ее возникновения. Только 23 пациента были жителями г. Ростова-на-Дону и Ростовской области, 78 больных – россияне из других регионов страны и 12 пациентов – граждане стран СНГ.
Согласно существующим клиническим рекомендациям по диагностике данного заболевания, всем больным были выполнены ретроградная и микционная уретроцистографии. Урофлоуметрия была возможна для пациентов с сохраненным естественным мочеиспусканием. Для определения степени выраженности и распространенности спонгиофиброза при рецидивных спонгиозных поражениях выполняли МРТ уретры и кавернозных тел полового члена по оригинальной методике [14].
Хирургическое лечение не было выполнено 20 (17,7%) больным по следующим причинам:
- у 5 пациентов – противопоказания к соматической патологии;
- у 15 пациентов – после обследования были выявлены СУ, не требующие хирургической коррекции, в связи с чем им было рекомендовано программное бужирование (самобужирование) с диспансерным наблюдением.
Из 113 больных прооперированы 93 (82,3%).

В 46,2% (43 пациента) наблюдений на момент выполнения реконструктивной операции на уретре деривация мочи осуществлялась по цистостомическому дренажу. Оперативное лечение СУ у 18 (19,4%) пациентов было выполнено без цистотомии; а 9 пациентам из 43 с цистостомой потребовалась рецистотомия.
В табл. 3 представлены общие сведения о больных с СУ, находившихся на лечении в 2013 г.
Результаты и обсуждение. Главными факторами, которые определяли выбор той или иной операции для лечения СУ, являлись:
- причина возникновения СУ;
- локализация СУ и ее протяженность;
- первичность хирургии СУ или хирургия рецидивного состояния.
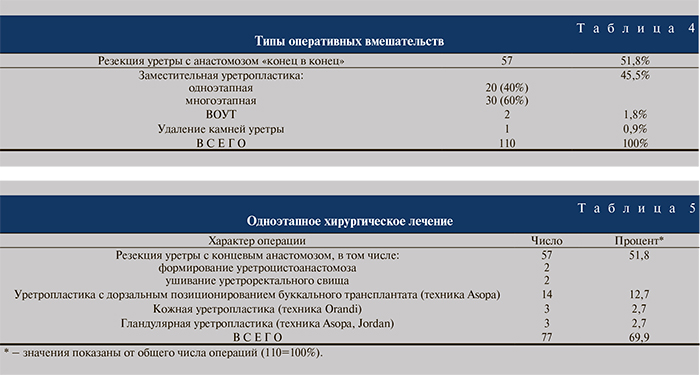
 93 больным было выполнено 110 операций (табл. 4), т.е. 1,18 операции на одного пациента.
93 больным было выполнено 110 операций (табл. 4), т.е. 1,18 операции на одного пациента.
Тактика оперативного лечения представлена следующим образом:
- одноэтапная хирургия – 70,9%;
- двухэтапная хирургия – 23,6%;
- многоэтапная хирургия – 3,6%;
- внутренняя оптическая уретротомия (ВОУТ) – 1,8%.
Варианты одноэтапного хирургического лечения СУ представлены в табл. 5.
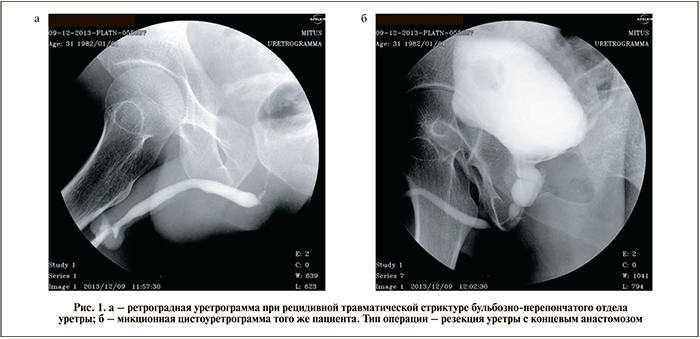
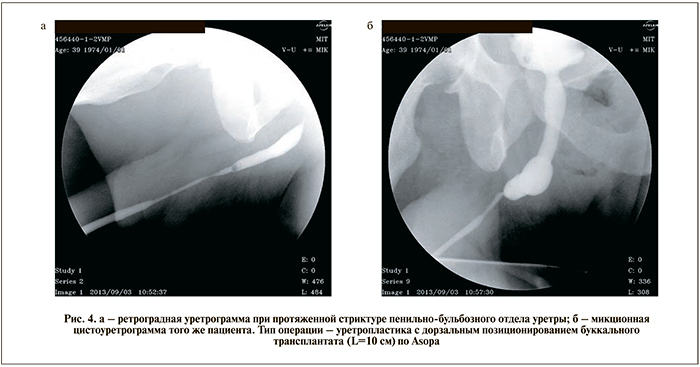
Спектр операций, позволивших осуществить излечение больных одномоментным вмешательством, преимущественно был представлен резекцией уретры с концевым анастомозом и только треть из них составили заместительные уретропластики. Сложность выполнения резекций уретры определялась тем, что у 28 (49%) пациентов имели место рецидивные СУ, в 2 наблюдениях одномоментно с восстановлением целостности мочеиспускательного канала при резекции производилось ушивание прямой кишки, а 2 больным анастомоз бульбарного отдела уретры производили с шейкой мочевого пузыря (уретроцистоанастомоз). В особо сложных случаях для наложения швов на проксимальный конец уретры и шейку мочевого пузыря использовали авторские инструменты: «игла-полуавтомат» и «буж-игла» [15]. На рис. 1–4 представлены ретроградные уретрограммы и микционные цистоуретрограммы больных, которым была произведена одномоментная хирургия СУ.

Двухэтапный подход к лечению больных (табл. 6) осуществлен двумя способами. Первый вариант оперативного лечения предполагал использование при уретропластике буккального трансплантата, а при втором варианте для формирования неоуретры использована собственная уретральная пластинка, которую на I этапе марсупиализировали по Йогансену.
Главными причинами выбора двухэтапной тактики лечения стриктурной болезни стали не столько большая протяженность поражения уретры, сколько наличие активной фазы воспаления как в самой стенке уретры, так и в парауретральных тканях. При наличии данных факторов было крайне рискованно выполнять одномоментную уретропластику. Это обстоятельство оказалось определяющим для выполнения на I этапе лечения в 12 наблюдениях марсупиализации уретры по Йогансену с формированием 2 неомеатусов, что позволило избавить больных от деривации мочи через цистостому и восстановить мочеиспускание естественным путем через сформированный проксимальный неомеатус в промежности или пеноскротальном углу.
 Завершенный спонгиофиброз с полной облитерацией уретры, требовавший выполнения ее фрагментарной резекции (2 наблюдения) или тотального удаления уретральной пластинки на большом протяжении (1 наблюдение), также послужили основанием к проведению двухэтапного лечения.
Завершенный спонгиофиброз с полной облитерацией уретры, требовавший выполнения ее фрагментарной резекции (2 наблюдения) или тотального удаления уретральной пластинки на большом протяжении (1 наблюдение), также послужили основанием к проведению двухэтапного лечения.
Клинический пример
П а ц и е н т С. 42 лет. Госпитализирован 11.02.2013 с жалобами на отсутствие мочеиспускания естественным путем, наличие надлобкового мочепузырного свища.
Болен 4 года, когда после острого уретрита появилась тенденция к ухудшению мочеиспускания. При обследовании была выявлена стриктура уретры, в связи с чем проводили бужирование и однократно выполняли оптическую уретротомию. С сентября по ноябрь 2012 г. прогрессирование болезни усилилось, и в декабре возникла острая задержка мочи, которая ввиду невозможности проведения катетера по уретре была разрешена путем выполнения троакарной цистостомии.
Объективно: буж № 16 на расстоянии 1,5 см от меатуса встречает непреодолимое препятствие.
На ретроградной уретрограмме – протяженная стриктура гландулярного и пенильного отделов уретры (рис.5).
14.02.2013 выполнена операция: резекция 5 см пенильного отдела уретры. Замещение пенильного и гландулярного отделов уретры буккальным трансплантатом длиной 11 cм. Формирование неомеатуса в пеноскротальном углу.
Характер вмешательства был окончательно определен интраоперационно, когда было выявлено наличие фрагмента уретры (5 см) с тотальным спонгиофиброзом и отсутствием уротелиальной пластинки, что исключало выполнение одномоментной уретропластики. Внешний вид полового члена после I этапа уретропластики представлен на рис. 6 а.

Послеоперационный период протекал без осложнений. На 7-е сутки больной выписан на амбулаторное лечение без цистостомического дренажа, но с деривацией мочи посредством уретрального катетера и следующими рекомендациями:
- удаление уретрального катетера через 14–18 дней после операции;
- выполнение следующего этапа уретропластики через 5–6 месяцев.
5.09.2013 пациент госпитализирован для уретропластики. Больной мочится самостоятельно, свободно через неомеатус, расположенный в пеноскротальном углу. Внешний вид трансплантата, служащего дорзальной стенкой будущей неоуретры, удовлетворительный (рис. 6 б).
9.09.2013 выполнена операция: модифицированная уретропластика по Дюплею с использованием кожи полового члена и буккального трансплантата, конечный результат которой представлен на рис. 6 в.
Послеоперационный период без осложнений. Уретральный катетер удален на 14-е сутки. Пациент выписан из отделения с восстановленным мочеиспусканием на 15-е сутки после операции.
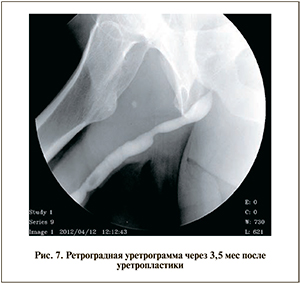
Контрольное обследование 25.12.2013 – жалоб нет. Пациент мочится свободно, хорошей струей. Эректильных расстройств нет. По данным урофлоуметрии максимальная скорость мочеиспускания – 22 мл/с.
Уретрограмма представлена на рис. 7.
Многоэтапное хирургическое лечение с целью восстановления мочеиспускательного канала при его стриктурном поражении всегда не стандартное, сложное и требует действительно индивидуального подхода: как по последовательности оперативных шагов, так и по четкому пониманию задач, которые требуется решить на каждом из этапов хирургии.
В табл. 7 приведены данные о числе наблюдений СУ, где изначальное лечение пациентов предполагало тактику многоэтапного хирургического лечения.
Следует особо подчеркнуть, что интервалы между этапами хирургического лечения при двух- или многоэтапном подходе должны быть не менее 4–6 месяцев.
Редкие эндоскопические вмешательства в клинике (2 операции в год) объясняются тем, что мы на протяжении многих лет придерживаемся вполне определенных принципов использования данного метода лечения СУ, которые разделяются многими исследованиями в последние годы [16–19].
К ним относятся:
- ВОУТ как попытка излечения СУ может быть использована в отношении больного только 1 раз и при протяженности поражения не более 0,5 см;
- эффективным следует считать тот результат, при котором отсутствует необходимость бужирования уретры в течение года после выполнения ВОУТ;
- при нарастании признаков инфравезикальной обструкции после выполнения ВОУТ в течение года пациенту показана открытая операция на уретре в виде резекции или уретропластики.
К концу 2013 г. в клинике было завершено лечение 84 (90,3%) пациентов при выполнении 101 операции, продолжение хирургического лечения в 2014 г. намечено 9 (9,7%) пациентам.
Как и при всякой хирургической деятельности, мы наблюдали ближайшие осложнения, связанные с особенностями конкретных наблюдений СУ:
- при резекции уретры и концевых анастомозов – осложнений не было; имел место 1 ранний (через 4 мес) рецидив стриктуры уретры;
- при одноэтапной уретропластике:
- поверхностная флегмона раны – 1 наблюдение;
- уретрокожный свищ на промежности – 1 наблюдение;
- при многоэтапных уретропластиках:
- поверхностная флегмона раны – 5 наблюдений;
- уретрокожный свищ на промежности – 1 наблюдение;
- диастаз краев послеоперационной раны с вторичным заживлением – 3 наблюдения.
Все воспалительные осложнения были купированы консервативно. В 2 наблюдениях уретрокожных свищей промежности длительное дренирование уретральным катетером (32 и 38 суток) способствовало заживлению свищей без ущерба для результатов уретропластики.
Выводы. Клинико-статистический анализ хирургического лечения стриктур и облитераций уретры за год работы показывает следующее:
- Значительная часть (58%) больных имеют рецидивные СУ как вследствие неэффективности предшествующего оперативного лечения, так и из-за прогрессирующего течения самой стриктурной болезни.
- Радикальная хирургия СУ выполнена 93 (82,3%) пациентам. В других же наблюдениях была показана безоперационная тактика (13,3%); либо оперативное лечение являлось противопоказанным по соматическим причинам (4,4%).
- Резекция уретры с концевым уретроуретроанастомозом является наиболее эффективным методом лечения СУ, но ее выполнение возможно лишь для 51,8% пациентов с СУ.
- Уретропластика при СУ в значительной части случаев является многовариантной хирургией, где необходимо применение различных хирургических техник.



