Введение. Трансуретральная резекция (ТУР) служит «золотым» стандартом в лечении немышечно-инвазивного рака мочевого пузыря (РМП) [1–3]. Однако высокая частота рецидивов, достигающая 90%, обусловливает необходимость поиска методов по повышению радикальности лечения [3–5].
К одним из путей решения данной задачи относится выполнение операции с применением дополнительных методов интраоперацинного контроля, таких как фотодинамическая диагностика (ФДД), трансуретральный ультразвуковой (ТУУЗ) контроль, узкоспектровая цистоскопия, оптическая когерентная томография [6–12]. Наиболее изученными являются ТУР под фотодинамическим и ТУУЗ-контролем. Однако публикации по сравнительному анализу этих двух методов малочисленны [13].
Целью настоящего исследования было оценить эффективность интраоперационного трансуретрального ультразвукового и фотодинамического контроля при ТУР по поводу немышечно-инвазивных форм новообразований мочевого пузыря, определить достоинства и недостатки каждого из методов.
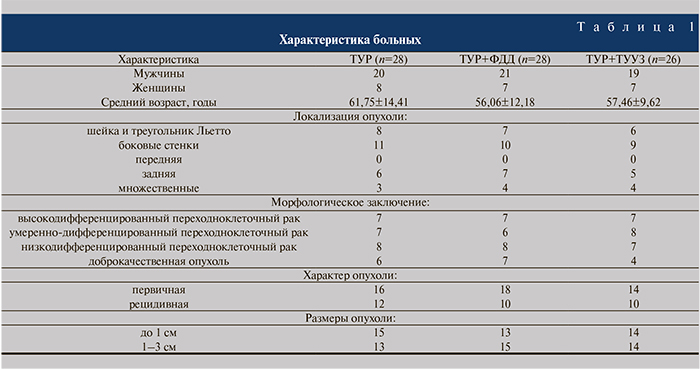
Материалы и методы. Проведен анализ результатов лечения 82 пациентов с немышечно-инвазивными новообразованиями мочевого пузыря в урологической клинике КМУ за 2000–2014 гг. В первую группу вошли 28 пациентов, которым ТУР выполнена в качестве монотерапии, во вторую – 28 пациентов, которым ТУР выполнена под фотодинамическим контролем (ТУР+ФДД). Третью группу составили 26 пациентов, которым ТУР проводилась под динамическим трансуретральным ультразвуковым контролем (ТУР+ТУУЗ; табл. 1).
В ходе диспансерного наблюдения всем больным выполнены стандартное клинико-лабораторное обследование, трансабдоминальное УЗИ мочевых путей и цистоскопия каждые 3 мес в течение первого года, затем 1 раз в 6 мес со 2-го по 4-й год, затем 1 раз в год постоянно или до выявления рецидива.
Операция ТУР под фотодинамическим контролем выполнялась по следующей методике. Перед началом операции готовили 3%-ный раствор 5-аминолевулиновой кислоты (5-АЛК) путем разведения 1,5 г 5-АЛК на 50 мл 4%-ного раствора гидрокарбоната натрия. Выполнялась инстилляция раствора в мочевой пузырь с экспозицией 1,0–1,5 часа. ТУР выполнена с использованием оборудования фирмы «Karl Storz» со специальной оптической системой резектоскопа, ксеноновым источником света «D-Light» с мощностью светового потока в ультрафиолетовой части спектра 380–440 нм. Операция осуществлена под внутривенным наркозом или регионарной анестезией. Изначально проведена цистоскопия в белом свете, затем цистоскопия под фотодинамическим контролем. Выполнена монополярная ТУР в белом свете. По окончании ТУР проведена контрольная фотодинамическая диагностика с целью выявления и удаления обнаруженных патологических участков.
Техника ТУР под ТУУЗ-контролем. Перед началом операции выполнена цистоскопия в белом свете. Затем проведено ТУУЗИ. Исследование выполнено с помощью ротационного УЗ-зонда и набором датчиков частотой 5,5 МГц с возможностью угла сканирования 60º, 90º и 135º в зависимости от зоны МП, адаптированного к тубусу резектоскопа «Karl Storz» 24 Fr., УЗ-томографа «Bruel&Kjaer». После этого выполнена монополярная ТУР. Ультразвуковой эндовезикальный контроль осуществлен динамически на протяжении всей операции с видеопротоколом и объективной оценкой радикальности проводимого лечения.
Статистическая обработка данных осуществлена с использованием пакета прикладных программ Statistica 7.0. Различия выживаемости в группах определены с помощью log-rang-теста. Достоверность различий между относительными показателями вычислена по t-критерию Стьюдента. Для всех видов анализа различия показателей считали статистически значимыми при p<0,05.
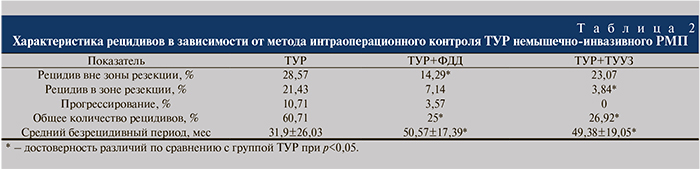
Результаты и обсуждение. В группе пациентов, которым выполнена ТУР в качестве монолечения, общая частота рецидивов составила 60,71%, а средняя продолжительность безрецидивного периода – 31,9 мес (табл. 2).
Рецидивы в зоне резекции имели место у 21,43% пациентов, прогрессирование – у 10,71% (табл. 2); развивались в первые два года после операции (см. рисунок), но не в последующие годы диспансерного наблюдения. Раннее развитие данной категории рецидивов свидетельствует о нерадикальности выполненной операции и наличии резидуальной опухоли. Частота рецидивов вне зоны резекции (истинных рецидивов) составила 28,57%; они возникали на протяжении всех пяти лет наблюдения с пиком развития на втором году послеоперационного периода наблюдения (см. рисунок). Хронология развития истинных рецидивов говорит как о недостаточной диагностике мелких клонов опухолевых клеток в ходе выполнения ТУР, так и о возможной имплантации опухолевых клеток во время операции. Развитие рецидивов вне зоны резекции в отдаленные сроки объясняется возможностью возникновения новых зон опухолевого поражения уротелия и не зависит от радикальности оперативного вмешательства.
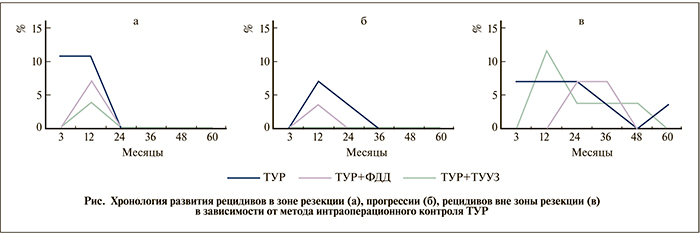
В группе, где ТУР выполнена под фотодинамическим контролем, общая частота рецидивов составила 25% (p<0,05). Продолжительность безрецидивного периода составила в среднем 50,57 мес (p<0,05; см. табл. 2). Рецидивы в зоне резекции диагностировали в 7,14% наблюдений, прогрессирование – в 3,57% в течение первых двух лет после операции (см. рисунок) и не наблюдали в последующем. Установлено статистически значимое снижение частоты рецидивов вне зоны резекции до 14,29% по сравнению с группой ТУР (p<0,05). Данный вид рецидивов не наблюдался в течение первого года после операции и возник лишь через 12 мес (см. рисунок), что обусловлено лучшей визуализацией измененной слизистой во время операции и ее удалением в ходе ТУР.
В группе пациентов, которым ТУР выполнена под ТУУЗ-контролем, общая частота рецидивов составила 26,92% (p<0,05), средний безрецидивный период – 49,38 мес (p<0,05). В данной группе не зарегистрировано ни одного случая прогрессирования, а рецидивы в зоне резекции выявлены лишь у 3,84% пациентов (p<0,05; см. рисунок), что свидетельствует о радикальности удаления опухоли во время операции. В то же время рецидивы вне зоны резекции возникли у 23,07% пациентов и не отличались от аналогичного показателя группы ТУР (см. табл. 2) по срокам их возникновения (см. рисунок).
Заключение. Применение фотодинамического контроля и трансуретрального УЗИ в ходе операции с целью контроля радикальности позволяет повышать результативность лечения. Причем каждый из методов имеет свои преимущества. Применение фотодинамического контроля способствует улучшению интраоперационной визуализации опухоли, в том числе carcinoma in situ, что позволяет определять истинные границы онкопроцесса и обеспечивать абластичность хирургического вмешательства. Из недостатков следует отметить неполный контроль глубины поражения опухоли, чем и обусловлены случаи прогрессирования и рецидива в зоне резекции. Данную задачу позволяет решать ТУУЗ-контроль, о чем свидетельствует низкая частота рецидивов в отдаленных сроках при использовании данного метода контроля.


