Введение. Процессы патологической биоминерализации в организме человека играют определяющую роль в возникновении ряда заболеваний. Появление кальциевых отложений на стенках сосудов, образование пяточных шпор, желчных и особенно мочевых камней – наиболее характерные примеры таких процессов. Последнее все чаще и чаще обнаруживается у населения индустриально развитых стран. При этом оказывается, что более чем у 70 % пациентов, страдающих мочекаменной болезнью (МКБ), депозиты состоят из гидратов оксалата кальция (кальция оксалата моногидрат, CaC2O4×H2O, КОМ; кальция оксалата дигидрат CaC2O4×2H2O, КОД) и их смесей с фосфатами или мочевой кислотой [1–3].
Несмотря на значительные успехи в лечении МКБ, связанные с широким внедрением дистанционной ударно-волновой и контактной литотрипсии, диагностика метаболических нарушений и дальнейшее предотвращение рецидивов камнеобразования представляют сложную задачу. Хотя кальций-оксалатные камни обнаруживают достаточно низкую степень рецидивности – 30–50 % за 5-летний период [4]; постоянно увеличивающееся количество таких пациентов [3, 5] взывает к необходимости внесения концептуальных изменений в стратегию метафилактического лечения.
Более того, для большинства пациентов быстрое и малоинвазивное удаление конкрементов оказалось явно более предпочтительным, чем утомительная и длительная метафилактика камнеобразования, связанная с изменением их привычного образа жизни. Однако высокая рецидивность МКБ, вызванная вовремя некупированными метаболическими нарушениями, часто приводит к серьезным органическим поражениям органов мочевыделительной системы [6]. Считается, что почти у 20% подобных пациентов со временем развиваются нефросклероз и хроническая почечная недостаточность [1, 6]. Очевидно, что затраты на лечение таких осложнений несоизмеримо больше, чем на проведение пусть и утомительных, но крайне необходимых диагностических и метафилактических мероприятий [4, 6]. Несмотря на то что необходимость этого ни у кого не вызывает сомнений, детальный анализ причин камнеобразования и разработка на основе полученных данных стратегии метафилактического лечения в отечественных клиниках проводятся очень редко. С целью изучения метаболических нарушений, вызвавших образование камней на основе гидратов оксалата кальция, нами впервые проведены клинико-лабораторные исследования по количественному минералогическому анализу конкрементов, физико-химическим и биохимическим анализам мочи и крови группы пациенток с кальций-оксалатным уролитиазом.
Материалы и методы. Нами обследованы 20 пациенток с кальций-оксалатными камнями, локализованными в почках или почках и мочеточнике. Средний возраст составил 52±6 года (минимальный – 24 года, максимальный – 68 лет; 9 пациенток в возрасте до 50 лет). У большей части пациенток камнеобразование было первичным.
У всех пациенток определены количественный минералогический состав камня, индекс массы тела (ИМТ) и суточный диурез; исследованы рН-профиль мочи, суточная экскреция с мочой мочевой кислоты, ионов кальция, магния, фосфат-, оксалат- и цитрат-ионов. Количественный минералогический анализ камня проведен с помощью дифрактометра Bruker D 8 Advance (медное или молибденовое излучение с λ=0,154 и 0,071 нм соответственно). Анализ дифрактограмм осуществлен с помощью пакета программ Topas 4 c использованием базы данных PDF 2 или Кембриджской структурной базы данных.
Определение ионов кальция, магния, фосфат-ионов и мочевой кислоты проведено спектрофотометрически с использованием стандартных наборов «Hospitex Diagnostics» и «Fluitest MG XB» с точностью до ±10%. Оксалаты и цитраты определены также спектрофотометрически с использованием аттестованных в Минздраве РФ наборов (ООО «Импакт») с точностью до ±10%. Измерения рН мочи проведены непосредственно после мочеиспускания с помощью карманных рН-метров рН-009(I) (RoHS) с точностью до ±0,1, предварительно откалиброванных по стандартным буферным растворам.
Результаты и обсуждение. Анализ состава конкрементов показал, что наиболее распространенной минералогической фазой камней являлся КОМ и лишь в двух случаях доминировал КОД. Монокомпонентные камни отмечены у 6 пациенток (КОМ), у остальных 14 камни содержали 2, реже 3 минералогические фазы – КОМ, КОД и фосфаты (гидроксилапатит, брушит) или дигидрат мочевой кислоты.
Проведенные биохимические исследования показали, что наиболее часто встречающимся метаболическим нарушением была гипоцитратурия, диагностированная почти у 90% пациенток (при использовании референтного значения 2,5 ммоль/сут [6], приведенного в табл. 1) Если ориентироваться на значение 1,7 ммоль/сут, предложенное Паком [7], то частота гипоцитратурии становится меньше – 65 %.
 Вторым по частоте нарушением оказалась гиперкальциурия, диагностированная у 45% пациенток. Еще 25% пациенток находились в группе риска, поскольку суточная экскреция кальция у них превышала 5 ммоль [6]. Гиперурикозурия отмечена у 11 пациенток, что составляет 55% от числа обследованных женщин. Важно отметить, что лишь в одном случае мочевая кислота в виде дигидратата была обнаружена в составе камня и лишь в трети случаев гиперурикозурия сопровождалась гиперурикемией. Для большинства пациенток избыточное содержание мочевой кислоты в моче лишь способствовало кристаллизации гидратов оксалата кальция. Гипероксалурия и гипомагнийурия выявлены у 25% обследованных.
Вторым по частоте нарушением оказалась гиперкальциурия, диагностированная у 45% пациенток. Еще 25% пациенток находились в группе риска, поскольку суточная экскреция кальция у них превышала 5 ммоль [6]. Гиперурикозурия отмечена у 11 пациенток, что составляет 55% от числа обследованных женщин. Важно отметить, что лишь в одном случае мочевая кислота в виде дигидратата была обнаружена в составе камня и лишь в трети случаев гиперурикозурия сопровождалась гиперурикемией. Для большинства пациенток избыточное содержание мочевой кислоты в моче лишь способствовало кристаллизации гидратов оксалата кальция. Гипероксалурия и гипомагнийурия выявлены у 25% обследованных.
У одной молодой пациентки аномально высокая суточная экскреция оксалатов (более 2 ммоль) сочеталась с высокой экскрецией кальция (7,9 ммоль/сут), низкой суточной экскрецией цитрата (1,3 ммоль) и одним из самых низких значений экскреции магния (1,4 ммоль/сут). Такое сочетание весьма неблагоприятно и требует проведения дополнительных исследований, в частности, для подтверждения или исключения генетически обусловленного расстройства – гипероксалурии типа I. Анализ камня методом электронной микроскопии мог бы оказать большую помощь в решении данной проблемы [5].
Гиперфосфатурия (референтные значения даны в табл. 1) отмечена в 20% наблюдений. При этом лишь у половины пациенток с гиперфосфатурией в камне был зафиксирован гидроксилапатит. В большинстве случаев наличие в кальций-оксалатных камнях гидроксилапатита или брушита не сопровождалось нарушениями метаболизма фосфора.
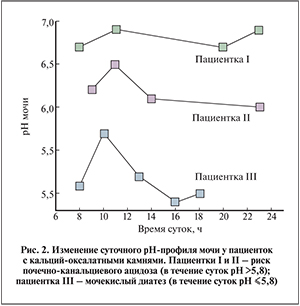
Данные рН-метрии показали, что у 55% больных суточные колебания мочи находились в пределах нормы. У 5 пациенток был зафиксирован мочекислый диатез (в течение суток рН ≤5,8 [6]), у 3 заподозрен почечно-канальцевый ацидоз (ПКА) типа 1 (в течение суток рН >5,8 [6]), у 1 – мочевая инфекция (в течение суток рН >7 [6]). Результаты анкетирования позволили выделить еще несколько факторов, способствовавших камнеобразованию. Оказалось, что у 50% пациенток ИМТ заметно превышал 25 кг/м2, что объективно увеличивает риск камнеобразования [3, 6]; у 40% зафиксирована недостаточная величина суточного диуреза – менее 2 л [6], у 10% больных отмечены частые случаи диареи. Следует отметить, что ни у одной из обследованных пациенток не было зафиксировано идиопатического камнеобразования.
Интересные с практической точки зрения результаты получены при разделении пациенток на две группы – до 50 и после 50 лет (9 и 11 пациенток соответственно). Несмотря на малый объем выборки, полученные результаты хорошо согласуются с имеющимися данными литературы [9]. Как видно из табл. 2, суточная экскреция ионов кальция и фосфат-ионов в среднем была несколько выше у пациенток старшей группы, в то время как экскреция мочевой кислоты – выше у пациенток моложе 50 лет, однако различия оказались статистически не значимы (p>0,05). В свою очередь суточная экскреция оксалатов и цитратов была достоверно ниже у пациенток старшей группы. Последнее коррелирует с данными множества работ (см. [9] и ссылки там), подтверждающими постепенное гормонально обусловленное снижение секреции цитратов в период менопаузы.
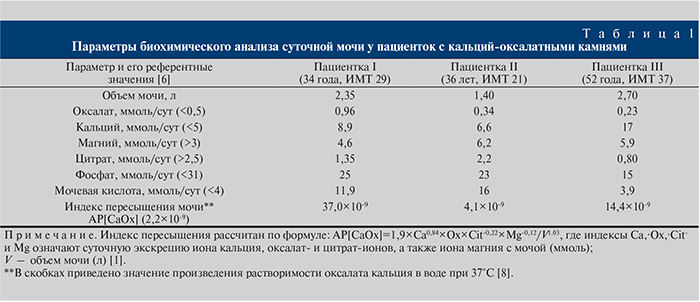
В табл. 1, а также на рис. 1, 2 в качестве примера приведены результаты обследования трех пациенток. Количественный минералогический анализ состава камней показал, что основным компонентом во всех случаях являлся КОМ, при этом камень у пациентки I содержал 20% КОД, у пациентки II – более 30% фосфатов. Индекс массы тела был превышен лишь у пациентки III, из анамнеза которой известно, что еще одним фактором риска для нее является диабет.
Как видно из табл. 1 и рис. 2, у пациентки I имело место сразу несколько нарушений, вызванных, по-видимому, тем, что она находилась во II триместре беременности. Индекс перенасыщения мочи был многократно превышен. В связи с этим после удаления камня пациентке были назначены базовая метафилактика [10], гипооксалатная диета и урологический сбор по схеме с контрольным УЗИ почек через 6 мес.
У пациентки II констатировали малую величину диуреза, риск гиперкальциурии, гиперурикозурию и, по-видимому, высокий риск ПКА, поскольку в камне находилось большое количество неинфицированных фосфатов и главное – рН мочи в течение суток не опускался ниже 6. Рекомендовано пройти нагрузочный тест с хлоридом аммония, соблюдение требований базовой метафилактики и гипоуратной диеты [10].

У пациентки III имел место рецидив камнеобразования. Первый случай отмечен 3 года назад, при этом камень почти полностью состоял из мочевой кислоты и ее моногидрата, образующегося в кислой моче [6], и трикальцийфосфата. Как видно из рис. 2, моча у пациентки закислена, а ее малые суточные колебания указывали на высокий риск мочекислого диатеза [6]. Основные причины камнеобразования в данном случае – это гипоцитратурия и значительная гиперкальциурия, причем, как показывают литературные данные [9], первое часто служит следствием второго. Для определения типа гиперкальциурии пациентке назначен и проведен нагрузочный тест с глюконатом кальция [11]. В утренней моче до и через 4 ч после нагрузки определено соотношение креатинин/кальций, которое составило 1,01 и 0,95 соответственно. Поскольку уровень сывороточного кальция у пациентки был в норме, полученные результаты свидетельствуют о почечной гиперкальциурии [11]. Пациентке рекомендована специальная метафилактика [10]: терапия цитратными смесями в течение не менее 3 мес до достижения рН мочи 6,4–6,8, тиазидные диуретики для снижения суточной экскреции кальция, соблюдение бессолевой диеты и требований базовой метафилактики [10].
Заключение. Проведенные исследования показывают, что в исследованной группе пациенток с кальций-оксалатным уролитиазом:
- главной минералогической фазой камней является моногидрат оксалата кальция, что согласуется с данными литературы [1–6, 11];
- наиболее распространенными метаболическими нарушениями являются гипоцитратурия и гиперкальциурия, при этом у пациенток старше 50 лет суточная секреция цитратов и оксалатов достоверно ниже;
- не обнаружено ни одного случая идиопатического камнеобразования, скорее, наоборот, имело место несколько метаболических нарушений;
- следует определять суточную экскрецию цитратов, что необходимо как для постановки правильного диагноза, так и для оценки эффективности назначаемой цитратной терапии.
Работа поддержана РФФИ (проект 15-44-03016- рег.)



