Введение. В структуре опухолевых заболеваний почки на долю почечно-клеточного рака приходится более 90% [1, 2]. Соотношение мужчин и женщин составляет 1,5:1,0. Пик заболеваемости приходится на возраст 60–70 лет. К факторам риска развития относятся генетический фактор, курение, ожирение и гипертония [3–6].
После выполнения R. Clayman и соавт. в 1990 г. лапароскопической радикальной нефрэктомии стали появляться сообщения о результативности и безопасности этих операций [7]. Сегодня в урологической хирургии определился широкий круг применения лапароскопических операций. Некоторые из них уже стали рутинным вмешательством, в то время как целесообразность выполнения других остается спорной. Одной из таких спорных операций на начальном этапе считалась лапароскопическая радикальная нефрэктомия. Традиционно операция выполнялась по открытой методике. Опасность диссеминации опухолевых клеток во время диссекции сдерживала развитие лапароскопических операций при злокачественных опухолях почки. Однако опыт показал, что лапароскопическая техника позволяет осуществлять удаление почки в блоке, включающем фасцию Герота. Почка может быть удалена в герметичном сачке без ее измельчения через разрез размером 5–6 см [8]. За последние десять лет ведущие урологи всего мира неоднократно демонстрировали, что лапароскопическая нефрэктомия при раке почки осуществима и предпочтительна по сравнению с открытой операцией. Многочисленные исследования показали ее преимущества по сравнению с открытой операцией. Среди них: лучший косметический эффект, меньшие кровопотери и болезненность послеоперационных ран, снижение потребности в использовании анальгетиков в раннем послеоперационном периоде, короткие сроки пребывания в стационаре, быстрое выздоровление [9–11]. В настоящее время все больше доказательств того, что при раке почки в стадии Т1 и Т2 лапароскопическая радикальная нефрэктомия становится серьезной альтернативой открытой операции [12–14]. Возможность удаления опухолей почки больших размеров в стадии Т2–Т3 (10 см и более) зависит также от опыта хирурга [15, 16].
Материалы и методы. Нами проведен ретроспективный анализ больных опухолями почки, которым была выполнена лапароскопическая или ретроперитонеоскопическая радикальная нефрэктомия с 2010 по 2015 г. В исследование были включены 185 больных, получивших оперативное лечение в урологических клиниках медицинского факультета Стамбульского и Азербайджанского медицинского университетов. Среди пациентов были 116 (62,7%) мужчин и 69 (37,3%) женщин в возрасте от 29 до 86 лет (средний возраст – 58,1 года). Ста пятидесяти (81,1%) больным радикальная нефрэктомия была выполнена трансперитонеальным доступом, 30 (16,2%) – ретроперитонеальным, в 5 (2,7%) наблюдениях использована комбинированная техника (hybrid technique). Как правило, лапароскопическую радикальную нефрэктомию выполняли с помощью трех портов – 160 (86,5%) больных. В случаях, когда возникала необходимость в отведении органа, устанавливали дополнительный, четвертый, порт – 20 (10,8 %) больных, в отношении 5 (2,7%) пациентов, оперативное вмешательство которым выполнено комбинированным доступом, использовали 6 портов. Сначала устанавливали 3 порта, как при ретроперитонеальном доступе, далее после лигирования почечной артерии – еще три порта трансперитонеального доступа. В 98 случаях выполнена правосторонняя нефрэктомия, в 88 – левосторонняя.
Основные жалобы пациентов при поступлении: боль и гематурия. От 21% больных раком почки жалобы отсутствовали, и обнаружение опухоли окзалось случайной находкой, выявленной при их обращении к врачам других специальностей (табл. 1).

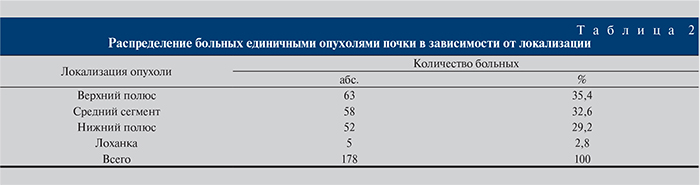
У 178 (96,2%) больных были выявлены единичные опухоли почки, у 7 (3,8 %) – множественные, количество которых колебалось от 2 до 8. Данные о локализации опухолевого процесса представлены в табл. 2.
Хотелось также отметить, что 53 (28,6%) больных в различное время до выполнения радикальной нефрэктомии (от 2 месяцев до 25 лет) перенесли в общей сложности 62 оперативных вмешательства, диапазон, которых колебался от герниопластики до замены клапана аорты и пересадки почки. Данная группа больных требовала еще более бдительного подхода со стороны как анестезиологической, так и послеоперационного ведения, где мы не редко консультировались со специалистами других профилей. Выполнение же лапароскопической радикальной нефрэктомии больным, перенесшим вмешательства на органах брюшной полости, создавало дополнительные трудности во время операции, зачастую связанные с развитием спаячного процесса.
У 15 больных, которым была проведена лапароскопическая радикальная нефрэктомия, был выявлен тромб в почечной вене (уровень 1 по классификации Mayo) и у 1 – тромб в нижней полой вене (уровень 2) [17]. Одиннадцати больным с тромбом в почечной вене оперативное вмешательство выполнено трансперитонеальным доступом, трем – с использованием гибридной техники и одному – ретроперитонеоскопическим доступом. Больному с тромбом в нижней полой вене (уровень 2) была проведена успешная операция по гибридной технике.
Результаты. Из 185 больных, которым была выполнена ЛРН, лишь в одном случае наблюдался летальный исход. Больной 80 лет скончался на 6-е сутки после операции от полиорганной недостаточности. Конверсия (переход на открытую нефрэктомию) потребовалась 12 (6,5%) больным. Причиной конверсии для 6 больных было интраоперационное кровотечение, для 4 – трудности, связанные с рубцово-склеротическими изменениями тканей, для 2 – большие размеры опухоли (14–15 см).
Продолжительность оперативного вмешательства колебалась от 50 до 215 мин (в среднем 104,3 мин), время инсуфляции – от 36 до 205 мин (в среднем 96,2 мин). Средняя интраоперационная кровопотеря составила 147,8 мл. Потребность в гемотрансфузии возникла у 17 (9,2%) прооперированных. Макропрепараты у 138 (79,8%) больных были удалены через разрез Гибсона, у 33 (19,1 %) – из расширенного разреза порта и у 2 (1 %) – из разреза Пфанненштиля. Размеры опухолей варьировались от 2,5 до 15,0 см. У 6 больных опухолевый процесс соответствовал стадии Т1а, у 75 – Т1b, у 45 – T2a, у 11 – T2b, у 28 – T3a, у 10 – T3b. В зависимости от гистологического типа опухоли разделились следующим образом: почечно-клеточный рак – 173 (93,5%) больных, саркома – 1 (0,5%), онкоцитома – 4 (2,2%), ангиомиолипома – 4 (2,2%), кистозная нефрома – 2 (1,1%). У 1 (0,5%) больного выявлено три опухоли почки: 1 онкоцитома (5,5 х 4 см) и 2 кистозные формы почечно-клеточного рака (7,5х6 см; 3,2х2,6 см).
Всем больным во время операции устанавливали дренажную трубку, сроки нахождения которой колебались от 1 до 11 сут (в среднем 3,3 сут). Количество послеоперационных койко-дней варьировалось от 2 до 18 сут (в среднем 4,1 сут).
Обсуждение. Хотелось бы обратить внимание на довольно высокий процент случайного обнаружения опухолей почек. Так, в нашем исследовании более чем у 25% больных почечно-клеточный рак был выявлен случайно или же имели место неспецифичные симптомы. У большого количества больных с опухолями почек заболевание проходит бессимптомно. В настоящее время более 50% случаев почечно-клеточного рака диагностируют случайно при обследовании неинвазивными методами исследования больных с различными неспецифичными симптомами [18]. За последние годы благодаря росту числа различных методов диагностики опухолей частота случайного выявления опухолевого поражения почек резко выросла [1, 19]. Классическая триада симптомов: боль в боку, гематурия и пальпируемая опухоль, встречаются лишь в 6–10 % случаев [20]. Все вышесказанноеподчеркивает важность проведения своевременных профилактических исследований.
Анализируя количество послеоперационных койко-дней, хочется отметить, что 35 (18,9%) больных были выписаны домой в удовлетворительном состоянии на 2-е сутки после операции. Срок госпитализации 98 (53%) прооперированных составил 3–4 дня.
Полученные нами данные подтверждают эффективность использования видеоэндохирургических методов лечения в урологии. Малоинвазивность, низкие показатели смертности и послеоперационных осложнений, минимальная интраоперационная кровопотеря, хороший косметический эффект, быстрая реабилитация больных, короткие сроки госпитализации наглядно демонстрируют достоинства применения лапароскопических и ретроперитонеоскопических вмешательств в хирургическом лечении больных раком почки.


