Введение. Заболеваемость раком почки характеризуется устойчивой тенденцией к росту. Увеличение данного показателя идет преимущественно за счет локализованных опухолей, которые в настоящее время встречаются у 60–70% пациентов с первично диагностированным раком почки [1–5, 11]. В свою очередь более частое выявление локализованных образований небольших размеров в стадии Т1 и Т2 привело к тому, что в настоящее время резекция почки, а не нефрэктомия стала более распространенным и даже рекомендуемым методом лечения новообразований почки [6–11]. Данное обстоятельство, по мнению многих авторов, обусловлено совершенствованием методов лучевой диагностики: ультразвукового, магнитно-резонансной томографии (МРТ) и мультиспиральной компьютерной томографии (МСКТ) с возможностью трехмерного моделирования патологического процесса [12–15].
Открытая резекция почки на сегодняшний день является стандартом органосохраняющего лечения при опухолях почки размером менее 4 см. Тем не менее лапароскопическая резекция все чаще рассматривается как потенциальная альтернатива [11]. Так, после работ [16, 17] этот вид операции стал правомерным вмешательством при хирургическом лечении маленьких новообразований почки.
В ходе многоцентрового исследования [18] с участием 1799 пациентов установлено, что средний объем кровопотери при открытой и лапароскопической резекции почки сопоставим и составляет 376 (10–3300) и 300 (25–6000) мл соответственно. Несмотря на это как при открытой, так и при лапароскопической резекции почки главной проблемой остается достижение адекватного гемостаза. Так, например, при лапароскопии кровотечение не может быть остановлено прямой компрессией паренхимы, что препятствует достижению гемостаза в зоне резекции. В связи с этим поиск наиболее эффективного и безопасного способа интраоперационного (временного или окончательного) гемостаза в ходе резекции почки остается в настоящее время актуальным [19–21].
 Материалы и методы. В клинике урологии Первого МГМУ им. И. М. Сеченова при резекции почки (как открытой, так и лапароскопической) временный интраоперационный гемостаз осуществляется одновременным пережатием артерии и вены (так называемое «en bloc»-пережатие), наложением зажима только на артерию («селективное – selective» пережатие сегментарного сосуда, питающего опухоль или сегмент почки с опухолью), наложением сосудистого зажима «по мере необходимости» (on demand), а также без пережатия кровотока («без зажима» – no-clamping); окончательный интраоперационный гемостаз осуществляется клипированием или лигированием сегментарной почечной артерии, суперселективной эмболизацией сегментарного сосуда, питающего опухоль. Помимо механических способов предупреждения и остановки кровотечения при лапароскопической и открытой резекции почки применяется ряд физических методов в комбинации с герметизирующими системами на основе фибриногена, тромбина и др., наложение швов на рану, применение гемостатических материалов. Выбор метода гемостаза зависит от характера кровоснабжения опухоли (особенностей ангиоархитектоники почки), ее локализации и опыта хирурга.
Материалы и методы. В клинике урологии Первого МГМУ им. И. М. Сеченова при резекции почки (как открытой, так и лапароскопической) временный интраоперационный гемостаз осуществляется одновременным пережатием артерии и вены (так называемое «en bloc»-пережатие), наложением зажима только на артерию («селективное – selective» пережатие сегментарного сосуда, питающего опухоль или сегмент почки с опухолью), наложением сосудистого зажима «по мере необходимости» (on demand), а также без пережатия кровотока («без зажима» – no-clamping); окончательный интраоперационный гемостаз осуществляется клипированием или лигированием сегментарной почечной артерии, суперселективной эмболизацией сегментарного сосуда, питающего опухоль. Помимо механических способов предупреждения и остановки кровотечения при лапароскопической и открытой резекции почки применяется ряд физических методов в комбинации с герметизирующими системами на основе фибриногена, тромбина и др., наложение швов на рану, применение гемостатических материалов. Выбор метода гемостаза зависит от характера кровоснабжения опухоли (особенностей ангиоархитектоники почки), ее локализации и опыта хирурга.
Важную информацию в выборе способа временного гемостаза при резекции почки мы получаем в ходе анализа дооперационного трехмерного моделирования патологического процесса, выполненного на основании данных мультиспиральной компьютерной томографии [13, 14, 22].
По нашему мнению, одним из альтернативных способов окончательного гемостаза при выполнении резекции почки (в особенности лапароскопической) является предварительная суперселективная эмболизация сосудов, питающих опухоль, способствующая уменьшению интраоперационной кровопотери и сокращению времени выполнения операции.
В зависимости от объема редуцируемого кровотока и диаметра питающей опухоль артерии используем полимеризующиеся и склерозирующие растворы, спирали и синтетические вещества.
Результаты. В клинике урологии Первого МГМУ им. И. М. Сеченова за период с 2011 по 2013 г. резекция почки по поводу опухоли выполнена 214 пациентам. Из них в 121 (56,5%) наблюдении осуществлена открытая резекция, в 93 (43,5%) – лапароскопическая. Интраоперационный гемостаз осуществлялся путем пережатия основного ствола почечной артерии в 148 (69,2%) наблюдениях, путем селективного пережатия сегментарной артерии, питающей опухоль, в 49 (22,7%), путем клипирования или лигирования сегментарной артерии, питающей опухоль, в 5 (2,3%), без пережатия кровотока (zero ischemia) в 8 (3,7%), с использованием предварительной суперселективной эмболизации в 4 (1,8%), из них в 3 наблюдениях перед открытой резекцией почки и в 1 – перед лапароскопической. Все пособия выполнены по поводу опухолей почки клинической стадии T1.
 Основным показанием к суперселективной эмболизации перед резекцией почки было наличие полюсных образований и сосуда, отдельно питающего опухоль.
Основным показанием к суперселективной эмболизации перед резекцией почки было наличие полюсных образований и сосуда, отдельно питающего опухоль.
Средний возраст больных составил 51 (30–61) год, средний размер опухоли – 3,4 (3–5,5) см. При открытой резекции время ишемии составило 20,1 (4–52) мин, средний объем кровопотери – 348 (260–2100) мл; при лапароскопической – 15,7 (4–34) мин и 260 (50–1000) мл соответственно.
С целью объективизации показаний к резекции почки всем пациентам провели нефрометрию по общепринятой методике R.E.N.A.L. score. Показатель по нефрометрической шкале R.E.N.A.L. оказался в диапазоне от 6 до 8 баллов, что соответствует среднему уровню сложности предстоящей резекции почки. Также перед операцией с целью оценки функции почек выполняли динамическую нефросцинтиграфию и измерение уровня креатинина и азота мочевины в сыворотке крови. Медиана наблюдения составила 18 (6–34) месяцев.
Приводим клиническое наблюдение открытой резекции почки с предварительной суперселективной эмболизацией.
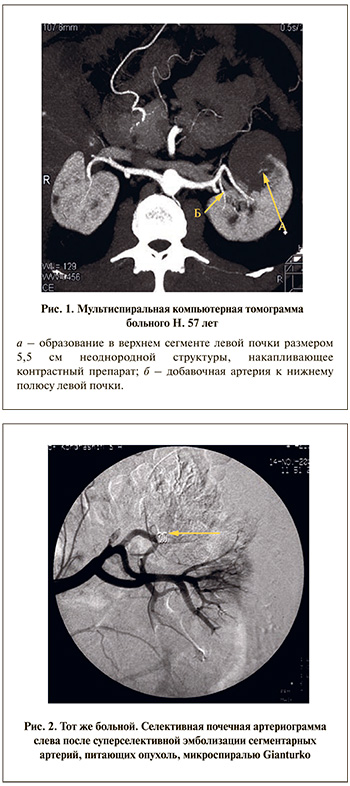
Б о л ь н о й Н. 57 лет поступил в клинику в плановом порядке с жалобой на тупую боль в поясничной области справа и появление крови в моче после физических нагрузок. В 2008 г. впервые отметил примесь крови в моче (тотальную безболевую макрогематурию) с червеобразными сгустками, в дальнейшем при обследовании по месту жительства диагностирован камень левой почки. В том же году по месту жительства выполнена пиелолитотомия слева; послеоперационный период без особенностей. Спустя некоторое время стал отмечать тупую боль в поясничной области справа, макрогематурия сохранялась. При обследовании в июле 2010 г. в нашей клинике диагностированы опухоль левой почки и коралловидный камень правой почки. Данные МСКТ: в лоханке правой почки определяется конкремент размером до 2,3 см, в верхнем полюсе левой почки – образование, накапливающее контрастный препарат, размером до 5,5 см (рис. 1) с инвазией в почечный синус на 0,7 см. я
К нижнему полюсу левой почки отходит добавочная артерия (на 6,5 см ниже основной) диаметром 0,2 см.
 С учетом абсолютных показаний к резекции почки, размеров и локализации опухоли, а также высокого значения нефрометрического показателя (более 7), что не исключало возможность нефрэктомии, первым этапом выполнены перкутанная нефролитотрипсия, литоэкстракция справа. Послеоперационный период протекал без особенностей, нефростомический дренаж удален на 5-е сутки.
С учетом абсолютных показаний к резекции почки, размеров и локализации опухоли, а также высокого значения нефрометрического показателя (более 7), что не исключало возможность нефрэктомии, первым этапом выполнены перкутанная нефролитотрипсия, литоэкстракция справа. Послеоперационный период протекал без особенностей, нефростомический дренаж удален на 5-е сутки.
Вторым этапом с целью уменьшения риска интраоперационного кровотечения в ходе резекции почки и принимая во внимание наличие добавочной сегментарной артерии, питающей опухоль, выполнена селективная артериография слева, суперселективная эмболизация добавочного ствола левой почечной артерии (рис. 2). Учитывая диаметр эмболизируемого сосуда, в качестве эмбола использована спираль Gianturko. При контрольной артериографии констатирована полная окклюзия питающей артерии, коллатеральный кровоток к опухоли отсутствует. Постэмболизационный период протекал без особенностей.
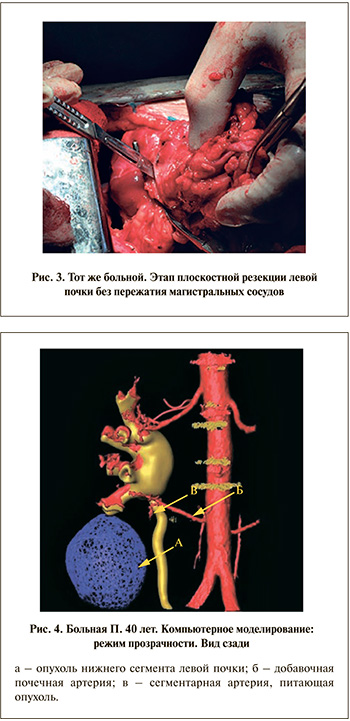
Через 6 сут после эмболизации проведены открытая резекция левой почки, парааортальная лимфаденэктомия (рис. 3). Технических трудностей, потребности в перекрытии магистрального кровотока в ходе операции не возникло. Резекция выполнена по демаркационной линии без повреждения крупных сосудов, интраоперационная кровопотеря составила 200 мл.
Послеоперационный период протекал без особенностей.
Данные морфологического исследования: выявлен умеренно-дифференцированный почечно-клеточный рак. Опухолевая капсула хорошо выражена, определяются множественные участки некроза опухоли как следствие проведенной эмболизации.
В контрольных анализах крови уровень креатинина и азота мочевины в пределах нормы (креатинин – 0,93 мг/дл, азот мочевины – 4,8 ммоль/л). При контрольной динамической нефросцинтиграфии через 3 мес накопительно-выделительная функция левой почки сохранена, выраженных нарушений уродинамики не выявлено; сцинтиграфическая картина правой почки характеризуется умеренным замедлением секреторно-экскреторного транспорта радиофармпрепарата.
В представленном наблюдении методом лечения решено было избрать открытую резекцию почки с учетом размеров и локализации опухоли, ее близости к почечной ножке, а также «неполноценности» контралатеральной почки и высокой вероятности нефрэктомии по результатам нефрометрии.
Приводим пример лапароскопической резекции левой почки с предварительной суперселективной эмболизацией.
Б о л ь н а я П. 40 лет. Диагноз: опухоль левой почки Т1N0M0.
По данным МСКТ выполнено 3D-моделирование патологического процесса. Опухоль размером 5,2х4,7 см, локализованная в нижнем сегменте почки, на 2/3 расположена экстраренально. От аорты к нижнему сегменту почки отходит добавочная почечная артерия, проходящая под мочеточником. Выявлена отдельная сегментарная артерия, питающая опухоль (рис. 4). Запланирована лапароскопическая резекция левой почки.
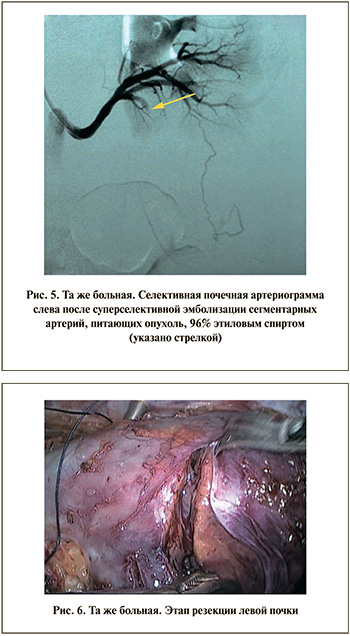
Учитывая наличие сосуда, отдельно питающего опухоль, и преимущественно экзофитное расположение опухоли, первым этапом выполнена суперселективная эмболизация сегментарной артерии с целью снижения интраоперационной кровопотери и исключения тепловой ишемии паренхимы почки. В условиях рентгеноперационной в сегментарную артерию проведен интродьюсер, выполнено контрастирование. При этом визуализированы сосуды, кровоснабжающие опухоль. Для эмболизации использован 96%-ный этиловый спирт в объеме 5 мл. При контрольной аортографии контрастировалась описанная добавочная артерия, поступления контрастного препарата в область опухоли не определялось (рис. 5).
Спустя 4 ч после суперселективной эмболизации выполнена лапароскопическая резекция левой почки. При диагностической лапароскопии брюшной полости обращал на себя внимание стекловидный отек забрюшинного пространства слева как следствие эмболизации. Стандартно были выделены почка и основные элементы почечной ножки, а также опухоль. Резекция выполнена без перекрытия магистрального кровотока, при этом активного кровотечения не наблюдалось. Четко определялась линия демаркации, по которой и выполнена резекция (рис. 6). После отсечения опухоли зона резекции была тщательно осмотрена на предмет положительного хирургического края. Для уверенности в абластичности область резекции была обработана монополярным коагулятором.
С целью окончательного гемостаза рана почки ушита непрерывным двухрядным швом нитью Викрил, нити фиксированы клипсами Absolock с прокладкой валика Surgicel, зона резекции дополнительно укрыта пленкой «Тахокомб». Опухоль удалена из брюшной полости в контейнере и отправлена на гистологическое исследование. Брюшная полость дренирована. Объем кровопотери составил 50 мл.
Гистологическое заключение: в крае резекции опухолевого роста не обнаружено. Опухоль состоит из округлых и полигональных крупных клеток с плотной зернистой эозинофильной цитоплазмой и представляет собой онкоцитому.
Через 3 мес после оперативного вмешательства была выполнена контрольная МСКТ и 3D-моделирование Размеры левой почки – 5,2х4,7х12,5 см. Накопление и выделение паренхимой контрастного препарата нормальное. В контрольных анализах крови уровень креатинина 1,02 мг/дл и азота мочевины 6,5 ммоль/л – в пределах нормы.
На основании данных компьютерного моделирования был подсчитан объем почки, который составил 86,1 мл. При проведении виртуального удаления опухоли с учетом отступления от края резекции до 5 мм объем функционирующей паренхимы почки мог уменьшиться на 4,2 мл. При проведении компьютерного моделирования через 3 мес после резекции с предварительной эмболизацией объем функционирующей паренхимы почки уменьшился на 7,8 мл (9%) от исходного.
Осложнения, характерные для постэмболизационного периода (боль, лихорадка, артериальная гипертензия), а также потеря функции органа по данным лабораторных и радиоизтопных исследований (через 3, 6 и 12 месяцев) в наших наблюдениях не отмечены.
Обсуждение. Суперселективная эмболизация почечных артерий, являющаяся малоинвазивной методикой при лечении ангиомиолипом почек [23], используемая также для купирования послеоперационного кровотечения, вызванного повреждением сосудов в ходе перкутанных операций и резекции почки [24], была предложена Ching-Chia Li и соавт. [25] в 2003 г., а затем, по результатам большего количества пособий, M. Gallucci и соавт [26] в 2004 г. – как новый метод, способный повысить безопасность лапароскопического вмешательства. По мнению авторов, предложенная ими методика не требует создания локальной ишемии или клипирования ввиду минимального объема кровопотери. Более того, эмболизация позволяет визуализировать четкую границу между здоровой и некротизированной паренхимой почки, представляющей собой идеальную линию резекции. По существу, интраоперационное УЗИ и другие методики, помогающие определить границы опухоли, не требуются [25–28].
Кроме того, было доказано, что суперселективная эмболизация обеспечивает условия для выполнения лапароскопической резекции без пережатия основного ствола почечной артерии (так называемая Zero ischemia) и избежать превышения порогового времени тепловой ишемии. Онкологические результаты пособия сравнимы с таковыми при открытой операции, а функциональные результаты являются обнадеживающими благодаря оптимальному сохранению почечной функции [29, 30].
Заключение. Несмотря на то что результаты послеоперационного наблюдения остаются предварительными (из-за небольших сроков) и для подтверждения полученных нами данных необходимо сравнительное исследование, имеем основание полагать, что суперселективная эмболизация артерий, питающих опухоль, перед выполнением резекции почки у пациентов со средним нефрометрическим баллом позволяет отказаться от интраоперационного пережатия кровотока. Во-первых, это предотвращает тепловую ишемию нормальной паренхимы почки, которая в последующем могла бы негативно сказаться на ее функции; во-вторых, делает возможным выполнение резекции в случаях сложной сосудистой анатомии, когда мобилизация почечной артерии, а тем более сегментарных сосудов технически сложна или невозможна, и в-третьих, Zero ischemia ведет к снижению интраоперационной кровопотери, что не только положительно сказывается на общем течении послеоперационного периода, но и способствует расширению показаний к использованию суперселективной эмболизации при лапароскопических операциях.



