Введение. По данным Белорусского канцеррегистра, в Республике Беларусь ежегодно выявляется более 1000 новых случаев рака мочевого пузыря (РМП) [1]. За последнее десятилетие заболеваемость РМП увеличилась на 11%: если в 2004 г. она составляла 11,4 на 100 тыс. населения, то в 2013 г. – 12,7.
В структуре онкологических заболеваний среди мужчин в 2013 г. РМП составил 4,4 % и занял 8-е место, а среди всей онкоурологической патологии – 3-е. От 50 до 80% опухолей мочевого пузыря относятся к т.н. РМП без мышечной инвазии (РМПБМИ) – новообразованиям, соответствующим стадиям Та, Т1 и Тis. Показано, что при таком распространении опухоли регистрируют относительно высокие показатели выживаемости пациентов, однако около 70% поверхностных опухолей рецидивируют и 20–30% прогрессируют в мышечно-инвазивный рак [2].
Несмотря на то что стандартом начального лечения РМПБМИ является трансуретральная резекция (ТУР), это вмешательство считается субоптимальным в отношении полной эрадикации опухоли. Так, было показано, что при повторной ТУР, выполненной в течение 2–8 нед после первичного лечения, остаточная опухоль может выявляться в 33–64% случаев [3]. Тем не менее у большинства пациентов с предполагаемым высоким риском остаточной опухоли после ТУР эта опухоль не обнаруживается и ранняя повторная ТУР может представлять собой избыточное воздействие, повышающее травматичность и стоимость лечения. Таким образом, сужение показаний к повторной ТУР на основании учета прогностических факторов поможет в оптимизации лечебного алгоритма за счет сокращения избыточного лечения. Целью данного исследования было оценить результаты повторной ТУР последовательной серии пациентов с РМПБМИ, проанализировать факторы прогноза выявления остаточной опухоли в результате данного вмешательства и разработать показания к его выполнению.
Материалы и методы. В проспективное исследование после подписания информированного согласия включили пациентов с РМПБМИ и неблагоприятным прогнозом после визуально радикальной ТУР мочевого пузыря. Критерии включения пациентов в исследование: гистологически верифицированный первичный либо рецидивный РМП; макроскопически полное удаление опухоли(ей) в ходе предыдущей ТУР мочевого пузыря; отсутствие мышечной инвазии опухоли по данным гистологического исследования препарата, удаленного в ходе ТУР; отнесение пациента к подгруппе с высоким или промежуточным риском рецидива; отсутствие регионарных либо отдаленных метастазов, уретерогидронефроза.
Пациентам, соответствующим критериям включения в исследование, в течение 4–8 нед после первичной ТУР выполнена повторную ТУР, в ходе которой осуществлены цистоскопия с фиксацией всех выявленных изменений на диаграмме мочевого пузыря, биопсия/ТУР всех подозрительных зон мочевого пузыря, глубокая биопсия зоны предыдущей ТУР с включением мышечного слоя. По показаниям выполнены множественные случайные биопсии мочевого пузыря и биопсия простатической уретры. Все образцы ткани отправлены для гистологического исследования раздельно.
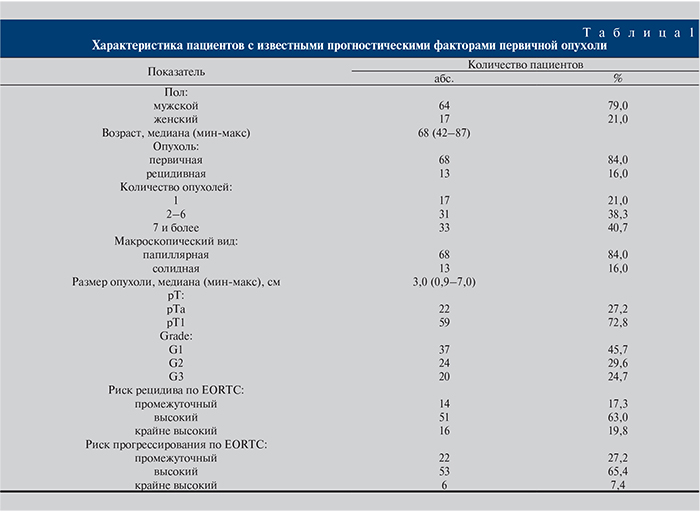
Всего в исследование включены 111 пациентов: 20 женщин и 91 мужчина, медиана возраста – 67 лет. Из всех включенных пациентов 90 (81,1%) были изначально оперированы в РНПЦ ОМР им. Н. Н. Александрова, 21 (18,9%) – в других учреждениях. При этом только у 81 из них были доступными все прогностические характеристики опухоли (табл. 1).
Результаты лечения оценивали путем изучения частоты обнаружения резидуальной опухоли при повторной ТУР и частоты занижения стадии при оценке местной распространенности РМП. Кроме того, проведен анализ зависимости частоты обнаружения резидуальной опухоли от прогностических характеристик опухоли.
Статистическую значимость различий рассчитывали при помощи χ2-теста с поправкой Йетса и точного критерия Фишера для таблиц 2×2 и теста Краскела–Уоллиса для факторов более чем с 2 уровнями значений. Все расчеты проведены с использованием программы STATISTICA v. 7 (StatSoft, Inc., 2004).
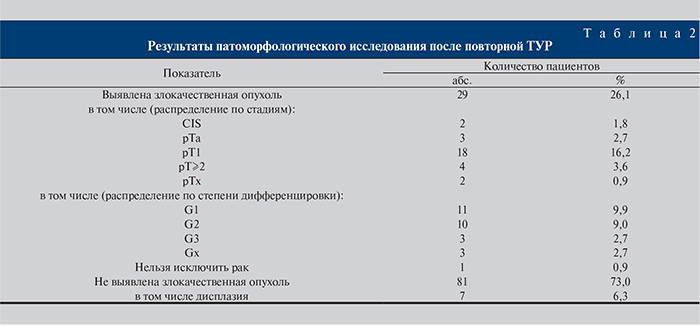
Результаты. Частота и характеристика остаточной опухоли. Повторную ТУР мочевого пузыря выполняли в интервале от 1 до 12 нед после первоначальной (медиана – 6 нед). Во всех случаях увеличение промежутка между ТУР свыше рекомендованного происходило по административным причинам. Всего в результате этого вмешательства выявлено 29 (26,1%; 95% доверительный интервал [ДИ] – 17,8–34,4%) злокачественных опухолей (табл. 2), в 81 (73%) случае в ходе биопсии удалены доброкачественные ткани и в 1 (0,9%) гистологическое заключение не позволило исключить или подтвердить опухоль. При этом карцинома in situ (CIS) выявлена у 2 (1,8%) пациентов, опухоль в стадии pTа – у 3 (2,7%), pT1 – у 18 (16,2 %) и стадии pT2 и более – у 4 (3,6 %; 95% ДИ – 0–7,1%) пациентов. По результатам гистологического исследования оценить стадию рака не представлялось возможным в отношении 2 (0,9%) пациентов. В зависимости от степени дифференцировки опухоли распределены следующим образом: G1 – 11 (9,9%) случаев, G2 – 10 (9%), G3 – 3 (2,7%) и Gx – 3 (2,7%) случая.
Визуальные находки во время повторной ТУР и частота остаточной опухоли. Всего в ходе повторной ТУР видимая опухоль в мочевом пузыре обнаружена у 25 (22,5%) пациентов, в том числе папиллярная у 16 (14,5%) и солидная/язвенная у 9 (8,2%). Не было визуально определяемой опухоли у 85 (77,5%) пациентов. При анализе зависимости визуальных находок во время повторной ТУР от наличия или отсутствия опухоли установлено, что чувствительность цистоскопии составляет 51,7% (95% ДИ – 32,4–71,1%), а специфичность – 87,7% (95% ДИ – 80,3–95%; табл. 3).

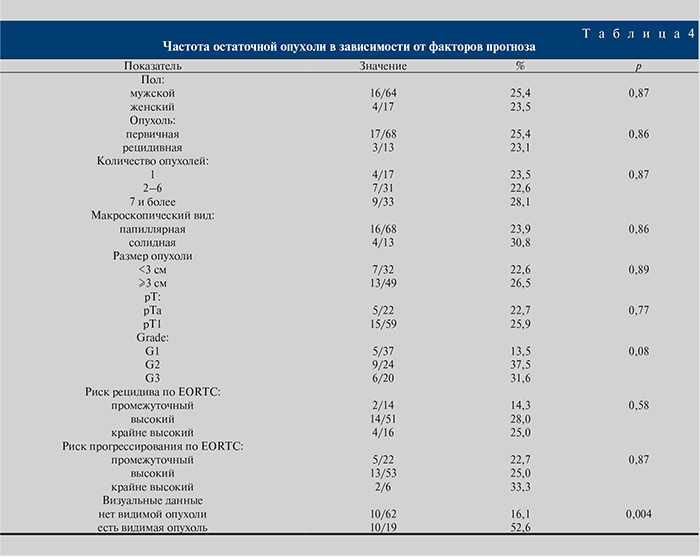
Зависимость частоты остаточной опухоли от прогностических факторов. Проведен анализ зависимости выявления остаточной опухоли при повторной ТУР в зависимости от различных прогностических факторов (табл. 4). Выявлено, что ни один из стандартных клинико-морфологических факторов прогноза не коррелирует с вероятностью выявления остаточной опухоли при повторной ТУР и только степень дифференцировки могла служить фактором, потенциально возможно используемым для предсказания результатов повторной ТУР. Напротив, цистоскопические данные при повторной ТУР имели статистически значимую связь с частотой выявления остаточной опухоли.
При стратификации данных в зависимости от цистоскопической картины и степени дифференцировки обнаружено, что в отсутствие видимой опухоли и G1 только у 1 пациента из 29 (3,5%; 95% ДИ – 0–10,5%) выявлена неинвазивная остаточная опухоль.
Однако в отсутствие видимой опухоли и G2–G3 рак был выявлен у 9 из 33 (27,3%; 95% ДИ – 11,2–43,3%) пациентов (табл. 5). У пациентов с видимой опухолью при повторной ТУР частота выявления рака составила 52,6% (95% ДИ – 27,9–77,4%) и существенно не зависела от степени дифференцировки опухоли (4/8 при опухолях G1 и 6/11 при G2–G3).
Обсуждение. Трансуретральная резекция мочевого пузыря является основным диагностическим и лечебным вмешательством при РМПБМИ. В ходе ТУР должно быть проведено тщательное уретроцистоскопическое исследование, позволяющее зафиксировать важные клинические прогностические факторы (количество опухолей, их размер, характер роста, наличие плоских изменений слизистой и их характеристику); вся опухолевая ткань должна быть удалена либо коагулирована; должен быть получен адекватный материал из опухоли и измененной слизистой для морфологического исследования, что должно позволить правильно определить глубину инвазии опухоли, степень анаплазии и установить факт наличия дисплазии или CIS.
К сожалению, ряд исследований продемонстрировал, что в существенном проценте случаев эти задачи оказываются невыполненными. Так, часть макроскопически видимых опухолей в ходе ТУР остается не выявленной и не удаленной; ряд опухолевых заболеваний мочевого пузыря невозможно визуализировать и удалить, используя обычную технику ТУР; после ТУР зачастую остаются жизнеспособные участки опухоли в подслизистом слое мочевого пузыря в области ее основания; и наконец в ряде случаев морфологическое исследование удаленного препарата при ТУР мочевого пузыря неправильно устанавливает глубину инвазии опухоли, что приводит к выбору неадекватной тактики лечения.
В анализе результатов исследований Европейской организации исследования и лечения рака (EORTC) было обнаружено, что существенная доля рецидивов объясняется неполным удалением опухоли в ходе ТУР. M. Brausi и соавт. [4] проанализировали различия в частоте ранних рецидивов (т.е. выявленных при первой цистоскопии через 3 мес после ТУР) среди различных медицинских учреждений Европы у 2410 пациентов с РМПМИ из семи протоколов EORTC III фазы. Оказалось, что имеется значительная вариабельность в частоте ранних рецидивов между различными лечебными учреждениями. Так, при одиночной опухоли частота рецидивов колебалась от 0 до 21%, при множественных – от 4 до 46%. Такие различия в частоте ранних рецидивов можно объяснить только недостаточно тщательным выполнением ТУР в ряде больниц, что сопровождается оставлением макроскопических опухолей в мочевом пузыря в значительном проценте случаев.
Неудовлетворительные диагностические характеристики цистоскопии в обычном (белом) свете были продемонстрированы при использовании фотодинамической диагностики (ФДД) РМПБМИ. Ряд исследований, проведенных с конца 1990-х гг., показал, что ФДД позволяет выявлять на 9–24% больше опухолей в мочевом пузыря, чем обычная цистоскопия. Так, в мета-анализе Аберденской группы по оценке медицинских технологий чувствительность ФДД в выявлении опухоли составила 92% по сравнению с 71% при обычной цистоскопии [5].

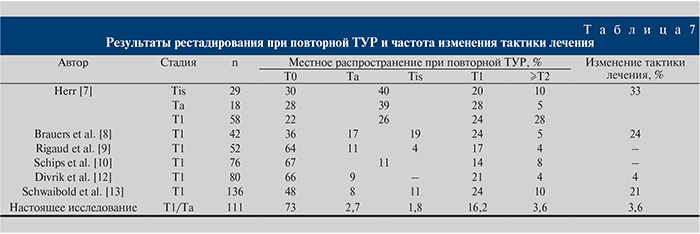
Выявление остаточной опухоли. Для выявления остаточной опухоли была предложена концепция ранней повторной (рестадирующей, или second-look) ТУР, которая выполняется через 1–8 нед после первичной и включает тщательную цистоскопию, удаление всех обнаруженных видимых опухолей и ререзекцию зоны предыдущей ТУР с включением мышечного слоя мочевого пузыря, а также биопсию всех подозрительных участков. Данные о частоте обнаружения остаточной опухоли и выявления мышечно-инвазивной опухоли при первоначальном диагнозе РМПБМИ в опубликованных сериях приведены в табл. 6 [6–13].
В нашем исследовании частота остаточной опухоли составила 26%, что является самым низким показателем среди приведенных данных. Тем не менее этот процент существен, что обосновывает показания к данному воздействию.
Коррекция ошибок стадирования. Клиническое, эндоскопическое и морфологическое определения точной распространенности опухоли у пациентов с РМПБМИ представляет собой довольно сложную задачу. У части пациентов опухоль оказывается более распространенной, чем это было оценено при ТУР и гистологическом исследовании микропрепаратов. Недооценка стадии на этапе начальной ТУР может приводить к неэффективности адъювантной иммунотерапии БЦЖ, раннему прогрессированию и повышению риска смерти от рака.

H. Herr [7] впервые показал, что повторная ТУР может с успехом применяться для установки более точного диагноза, а также раннего выявления мышечно-инвазивных опухолей. В его серии операций при начальном диагнозе РМПБМИ Tis частота выявления мышечно-инвазивной опухоли составила 10%, при неинвазивных папиллярных опухолях (Tа) – 5% и при РМПБМИ T1 – 10%. В последующих работах также была подтверждена существенная частота выявления мышечно-инвазивной опухоли, которая колебалась от 4 до 10%, а также роль повторной ТУР в выявлении ошибок стадирования [8–10, 12].
По нашим данным, частота нераспознавания мышечно-инвазивного заболевания при первичной ТУР оказалась одной из самых маленьких и составила всего 3,6% (табл. 7 [7–13]). Тем не менее, исходя из разного прогноза для данных заболеваний и различной тактики лечения, указанный процент существен, что подтверждает необходимость использования повторной ТУР.
Рекомендации и показания. Все вышеуказанные данные привели к тому, что ряд опубликованных национальных и международных рекомендаций по лечению РМПБМИ, основанных на доказательных данных, поддерживает необходимость включения повторной ТУР в рутинную схему лечения РМПБМИ. Однако показания к выполнению этого вмешательства несколько различаются.
В обновленных в 2007 г. рекомендациях Американской урологической ассоциации [14] указано, что повторная ТУР показана пациентам с гистологически подтвержденными первичными или рецидивными низкодифференцированными, или high grade (HG), опухолями в стадии T1 без мышечной ткани в гистологическом препарате (стандарт). Отмечено, что у пациентов с опухолями HG Ta, а также T1 с наличием мышечной ткани в удаленном препарате повторная ТУР также может быть использована для увеличения точности клинического стадирования, однако степень рекомендаций недостаточно определенная. Европейская ассоциация урологов (EAU) значительно расширяет показания к повторной ТУР: после неполной первичной ТУР, в отсутствие мышечной ткани в препарате при первичной ТУР (кроме опухолей TaG1 и первичной CIS), при всех опухолях T1 и при всех опухолях G3, кроме первичной CIS [15]. В рекомендациях Национальной онкологической сети США (NCCN) показаниями к повторной ТУР являются опухоли T1 или Ta HG при неполной ТУР или отсутствии мышечной ткани в препарате [16]. Международная консультация по РМП, проведенная в 2011 г. совместно с Международной консультацией по урологическим заболеваниям (ICUD) и EAU, в показания для повторной ТУР включает опухоли Ta HG и T1 вне зависимости от степени дифференцировки [17]. И наконец Международная группа по раку мочевого пузыря (IBCG) после изучения всех имеющихся рекомендаций посчитала необходимым выполнять повторную ТУР при опухолях T1 HG, неполной начальной ТУР, в отсутствие мышечной ткани в препарате и пациентам, направленным из других учреждений [18].
Наше исследование говорит о том, что кроме случаев изначально нерадикальной ТУР рутинно повторную ТУР целесообразно выполнять только при опухолях G2–G3 (HG) вне зависимости от категории Т, поскольку у 34,1% таких пациентов выявлялся рак. Поскольку при опухолях G1 цистоскопия – достаточно чувствительный метод выявления остаточной опухоли (из 5 позитивных случаев в 4 при цистоскопии выявлялась видимая опухоль), этот метод можно использовать для отбора пациентов для хирургического вмешательства. Более того, в связи с доброкачественным течением высокодифференцированных опухолей цистоскопию, по-видимому, можно отложить до 3 мес после ТУР, если такому пациенту не показано проведение внутрипузырных инстилляций химио- или иммунотерапевтических препаратов.
Заключение
Частота выявления остаточной опухоли при повторной ТУР в нашем исследования составила 26,1% (29/111 случаев), что клинически значимо и обосновывает показания к данному воздействию. Частота выявления мышечно-инвазивной опухоли при повторной ТУР составила 3,6%, что также клинически значимо и подтверждает необходимость использования данного метода. При стратификации данных в зависимости от цистоскопической картины и степени дифференцировки обнаружено, что в отсутствие видимой опухоли и G1 только у 1 пациента из 29 (3,5%) выявлена остаточная опухоль. Однако в отсутствие видимой опухоли и G2-G3 рак был выявлен у 9 из 32 (28,1%) пациентов (p=0,0005). Таким образом, для селекции пациентов со степенью дифференцировки G1 для повторной ТУР возможно использование цистоскопии. В отсутствие цистоскопических данных за опухоль повторной ТУР можно избежать.



