Введение. В 1980-х гг. ученые из компании Candela создали один из первых лазеров для эндоскопической литотрипсии [1]. Взяв эту технологию за основу, компания «Coherent Inc.» разработала гольмиевый лазер для эндохирургии [2, 3]. Этими исследованиями заинтересовались ученые одного из крупнейших научных центров мира – Центра фотомедицины Веллмана при Общеклинической больнице штата Массачусетс (США), именно они стали одними из первых, кто изучил и описал влияние гольмиевого лазера на ткани [4, 5]. Среди них был доктор Стивен Дретлер (Stephen Dretler), изучавший применение лазеров при контактной литотрипсии [6], и доктор Джон Кабалин (John Kabalin) из Стэндфордского университета. Доктор Кабалин сравнивал воздействие различных видов лазерного излучения на ткани и пришел к выводу, что гольмиевый лазер в диапазоне мощностей 50–80 Вт безопасен, его применение не ведет к выраженной геморрагии и позволяет останавливать интраоперационные кровотечения [7, 8].
После удачного применения гольмиевого лазера с целью литотрипсии было выдвинуто предположение, будто его возможно использовать и для удаления доброкачественной гиперплазии простаты (ДГПЖ). В 1996 г. впервые была описана техника гольмиевой лазерной энуклеации предстательной железы (HoLEP), которая заключалась в анатомически обоснованном иссечении долей простаты до хирургической капсулы [9]. Техника была доработана и дополнена авторами в 1998 г. – после выделения и энуклеации доли смещали в ретроградном направлении в мочевой пузырь, где их в последующем подвергали морцелляции [10, 11]. В рандомизированных исследованиях показано, что результатом HoLEP в послеоперационном периоде является сокращение времени катетеризации и госпитализации [12–14]. По данным мета-анализов и исследований, сравнивавших HoLEP с другими минимально инвазивными эндоскопическими методиками (лазерная вапоризация, биполярная трансуретральная резекция), HoLEP ведет к более значимому улучшению показателей Международной шкалы оценки простатических симптомов I-PSS и максимальной скорости потока мочи (Qmax) [14–16]. Результаты HoLEP (Qmax и I-PSS) были сопоставимыми с таковыми открытой аденомэктомии при более коротком периоде послеоперационной катетеризации и госпитализации [17, 18].
Большинство из существующих эндоскопических пособий выполняются при объеме гиперплазии простаты не более 80 см3; особенностью HoLEP является возможность применения пособия при больших (>80 см3) и гигантских (>200 см3) ее размерах [19, 20].
Целью нашего исследования стала оценка эффективности HoLEP, особенно при операциях на железах гигантских размеров.
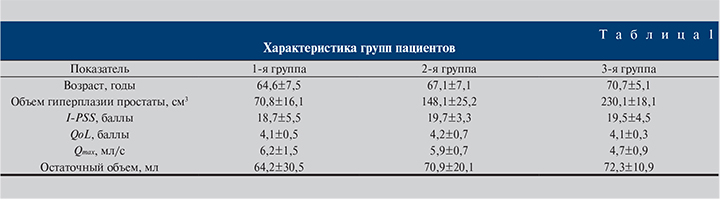
Материалы и методы. Настоящее исследование было проведено в 2013–2015 гг. на базе НИИ уронефрологии и репродуктивного здоровья Первого МГМУ им. И. М. Сеченова. В нем приняли участие 459 пациентов с инфравезикальной обструкцией, обусловленной ДГПЖ. План обследования включал тестирование по I-PSS, оценку индекса качества жизни QoL, определение Qmax, объема остаточной мочи, объема предстательной железы с помощью трансректального УЗИ.
В зависимости от объема гиперплазии простаты пациенты были разделены на три группы. Первую группу составили 278 пациентов с объемом гиперплазии простаты до 100 см3, 2-ю – от 100 до 200 см3, 3-ю – более 200 см3 (табл. 1).
Для статистического анализа нами был использован t-критерий Стьюдента, а также критерий Крускала–Уоллиса. За значимое отклонение было принято значение p<0,05.
Техническое оснащение. В своей работе мы использовали резектоскоп № 26 Ch с постоянной ирригацией, обеспечивший низкое давление ирригационной жидкости (типа Iglesias), рабочий элемент с каналом для проведения лазерного волокна, а также лазерную установку мощностью 100 Вт с длиной волны 2,1 нм и лазерное волокно с концевым свечением Slim LineTM 550 мкм. Мы имеем опыт использования лазера мощностью 60 Вт, однако снижение мощности существенно сказывалось на продолжительности операции.

Для удаления аденоматозной ткани использовали цистоскоп с прямым рабочим каналом (диаметр рабочего канала – 5 мм) и морцеллятор. В его состав входят вращающиеся ножи-тубусы (два 5-мм полых вращающихся лезвия), рабочая часть, оборудованная электродвигателем, подающим энергию во все приспособление и создающим разряжение в тубусе морцеллятора, благодаря чему засасывается вся удаленная ткань и блок управления, поддерживающий необходимую скорость вращения ножей на протяжении всей операции [21].
Методика выполнения HoLEP. Эндоскоп вводят в мочевой пузырь с последующим проведением лазерного волокна по каналу лазероскопа. Кончик волокна зафиксирован в конце эндоскопа на расстоянии 1 см от края оптики в положении на 6 часах. Хирург придерживает одной рукой наружную часть эндоскопической камеры, в то время как с помощью другой руки он может вращать и двигать эндоскоп во время энуклеации. Затем совершают инцизии в области шейки мочевого пузыря в позициях на 5 и 7 часах условного циферблата, в складках между медиальной и латеральными долями гиперплазии. Разрезы проводят через всю толщу ткани гиперплазии до циркулярных волокон капсулы простаты. Эти инцизии ведут из дистального положения по направлению к семенному бугорку. Далее их объединяют проксимально перед семенным бугорком и поэтапно смещают среднюю долю в мочевой пузырь.
Энуклеацию левой доли гиперплазии простаты начинают с разреза в позиции на 5 часах условного циферблата от шейки мочевого пузыря до уровня семенного бугорка, достигая волокна капсулы простаты (рис. 1). На уровне хирургической капсулы разрез расширяют путем латерального проведения лазерного волокна и тем самым выделяют гиперплазированную ткань. Эндоскоп вводят в направлении против часовой стрелки до уровня 2 часов условного циферблата. Далее делают надрез на позиции 12 часов условного циферблата по направлению вдоль капсулы от шейки мочевого пузыря до уровня семенного бугорка. Это ведет к энуклеации левой доли, после чего ее смещают в мочевой пузырь. Правую долю железы выделяют аналогично. Совершают надрез на позиции в 7 часов условного циферблата по направлению от шейки мочевого пузыря до уровня семенного бугорка. Инцизию проводят через толщу гиперплазии до достижения волокон хирургической капсулы. Достигнув этого уровня, разрез расширяют, направляя лазер медиально. Эндоскоп при этом движется по часовой стрелке. Совершают надрез из позиции 11 часов условного циферблата вдоль капсулы. Затем оба этих разреза из позиций 7 и 11 часов условного циферблата объединяют на уровне семенного бугорка, что ведет к выделению правой доли [21].

При использовании вышеописанной методики хорошего гемостаза достигают почти во всех случаях, тем не менее перед морцелляцией проводят коагуляцию всех кровоточащих сосудов, даже если характер кровотечения незначительный.
Морцелляция. До начала морцелляции заменяют инструмент и проводят цистоскоп с прямым рабочим каналом, при этом, не заменяя наружний тубус, подключают дополнительную ирригацию, перекрывают канал для оттока жидкости. Достаточное наполнение мочевого пузыря необходимо для эффективной и безопасной морцелляции. Затем по каналу цистоскопа проводят нож для морцелляции. Его лезвия должны находиться в центре мочевого пузыря на максимальном удалении от слизистой оболочки. Далее с помощью контрольных педалей включают аспирацию, но не вращение лезвий (рис. 2). И только после того как гиперплазированная ткань будет поймана и зафиксирована кончиком ножа морцеллятора, включают вращение лезвий. Это ведет к измельчению ткани и ее дальнейшему выведению из пузыря. Следует отметить, что небольшие фрагменты аденомы не стоит пытаться поймать в морцеллятор, так как есть вероятность повреждения мочевого пузыря. Для их сбора мы использовали модифицированную механическую петлю резектоскопа или шприц Рене–Александера. После того как вся ткань гиперплазии удалена, в мочевой пузырь проводят трехходовой катетер Фолея диаметром 18–20 Fr и подключают промывную систему [21].
Особенности операций на гиперплазии предстательной железы гигантских (более 200 см3) размеров. Во-первых, удаление гиперплазии простаты гигантских размеров часто сопровождалось выраженной геморрагией. Для остановки кровотечения мы использовали лазерное излучение (коагуляцию осуществляли путем отведения лазерного волокна на 3 мм от сосуда или путем снижения мощности излучения до 40 Вт. В некоторых случаях при активном, продолжающемся кровотечении применяли электрохирургические методики – шариковый коагулирующий электрод (Coagulating BALL ELECTRODE). Стоит отметить, что крайне важно добиваться хорошего гемостаза не только с целью профилактики геморрагических осложнений, но и для улучшения видимости во время последующей морцелляции.

Во-вторых, при гиперплазии гигантских размеров чаще всего формируется несколько узлов гиперплазированной ткани, каждый из которых по-своему меняет рельеф хирургической капсулы и затрудняет ее выделение. Мы считаем важным при энуклеации гиперплазии гигантских размеров сосредоточить все внимание на выделении основного узла. Остальные участки гиперплазированной ткани могут быть энуклеированы после его удаления.
В-третьих, при гиперплазии гигантских размеров ткань предстательной железы часто значительно выступает в полость мочевого пузыря (интравезикальная часть) и интимно прилежит к устьям мочеточников, что значительно увеличивает риск повреждения устьев мочеточников во время проведения энуклеации в зоне шейки мочевого пузыря. Этот факт сказывается на сложности при работе в данной зоне и требует повышенной бдительности.
С целью профилактики недержания мочи в послеоперационном периоде при выделении гиперплазированной ткани в зоне семенного бугорка мы рекомендуем снижать мощность лазерного излучения до 40 Вт.
В завершение энуклеации перед смещением аденоматозной ткани в мочевой пузырь целесообразно осуществлять несколько неглубоких инцизий по поверхности узла для облегчения последующей морцелляции. Данные надрезы облегчат ножу последующий захват гиперплазированной ткани и тем самым позволят сократить время операции.
После морцелляции в мочевом пузыре часто остаются небольшие фрагменты ткани округлой формы размером около 2 см. Данные узлы имеют высокую плотность и не поддаются обработке ножом. Для их удаления мы использовали модифицированную механическую петлю резектоскопа либо осуществляли их электрорезекцию на мелкие части.
В ряде случаев большой объем гиперплазии простаты может затруднять движения резектоскопа. Некоторые исследователи [22, 23] при недостаточной длине резектоскопа на железах объемом 300 см3 при невозможности достижения шейки мочевого пузыря были вынуждены выполнять промежностную уретеростомию, для того чтобы избежать излишней компрессии полового члена. В нашей работе при энуклеации желез объемом до 260 см3 необходимости в проведении подобного рода манипуляции не возникло.
В 3 наблюдениях (объем простаты – 210, 218 и 240 см3) при сопутствующих крупных камнях мочевого пузыря после проведения энуклеации с целью сокращения времени операции мы осуществляли цистолитотомию и одномоментное удаление аденоматозных узлов. В последующем рану ушивали наглухо, а мочевой пузырь дренировали уретральным катетером в течение 5 дней.
Результаты. Для оценки эффективности HoLEP на гигантских железах мы не только сравнивали послеоперационные показатели, но и оценивали скорость (эффективность) морцеляции и энуклеации во всех трех группах. Ожидаемо продолжительность энуклеации и морцелляции в третьей группе была выше, чем в первых двух (табл. 2). Однако после расчета показателей эффективности энуклеации и морцелляции было установлено, что их скорости на больших (100–200 см3) и гигантских (более 200 см3) железах значительно превышают таковые на железах до 100 см3 (p<0,05; табл. 2).
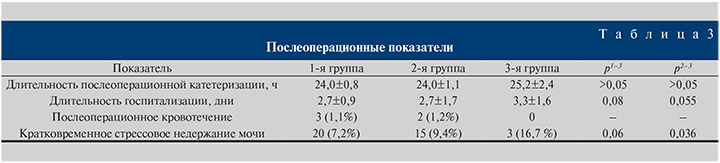
Продолжительность дренирования мочевого пузыря уретральным катетером составила в среднем 24 ч, длительность пребывания в стационаре – в среднем 3 дня (табл. 3).
Послеоперационное кровотечение возникло в 5 наблюдениях; пациентов, нуждавшихся в переливании компонентов крови, не было ни в одной из трех групп. Кратковременное (длительностью до 3 месяцев) стрессовое недержание мочи отмечено в 38 случаях (табл. 3). В последующем при снижении мощности лазера до 40 Вт во время энуклеации в зоне сфинктера частота данного осложнения снизилась. Повреждение устьев мочеточников, отмеченное единожды (во 2-й группе), потребовало дренирования верхних мочевыводящих путей катетером-стентом в течение 2 нед. После удаления дренажа уродинамика полностью восстановилась.
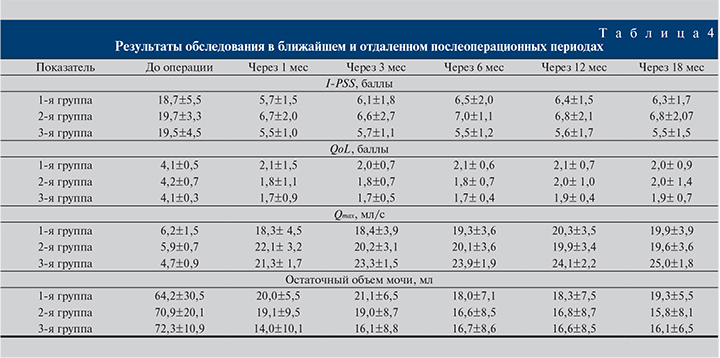
Для оценки эффективности HoLEP при ДГПЖ гигантских размеров контрольные обследования пациентов проводили спустя 1, 3, 6, 12 и 18 мес после операции (табл. 4). По результатам проведенного исследования нами не было выявлено статистически значимого различия в величине оцениваемых послеоперационных показателей (I-PSS, QoL, Qmax, остаточный объем мочи) между разными группами, то есть результаты через 1, 3, 6, 12 и 18 мес во всех трех группах были сопоставимыми между собой (p>0,05).
Обсуждение. Важно заметить, что все выполненные нами операции на железах объемом более 200 см3 были сложными и трудоемкими. Это привело нас к выводу, согласно которому, прежде чем приступать к операциям на гигантских железах, хирургу следует овладеть методикой энуклеации и самостоятельно выполнить не менее 20 операций на железах объемом до 100 см3. Данное заключение согласуется с мнением ряда других исследователей [24, 25].
Тот факт, что по итогам послеоперационного наблюдения в течение 18 мес нами не было выявлено статистически значимых различий (p>0,05) в исследуемых показателях (I-PSS, QoL, Qmax, остаточный объем мочи) между тремя группами с разными объемами гиперплазии, позволяет подтвердить, что гольмиевая лазерная энуклеация – одинаково высокоэффективная методика лечения желез как объемом до 100 см3, так и большего (100–200 см3) и даже гигантского (более 200 см3) объема.
Если суммировать такие факты, как высокая эффективность энуклеации при больших объемах гиперплазии, небольшой процент осложнений и одинаковые отдаленные результаты операции во всех трех группах, можно предположить, что HoLEP может не только стать альтернативой трансуретральной резекции и открытой аденомэктомии [16, 17, 23], но и прийти им на замену. Овладение методом гольмиевой лазерной энуклеации позволяет с одинаковой эффективностью лечить больных с практически любым размером гиперплазии предстательной железы. Многие исследователи сообщают, что при удалении гиперплазии простаты размером более 100 см3 улучшения по шкале I-PSS и Qmax после HoLEP сравнимы с таковыми после открытой аденомэктомии [17, 23, 26–29].
Заключение. Гольмиевая лазерная энуклеация (HoLEP) является эффективной и безопасной методикой оперативного лечения больных гиперплазией простаты. Она выполнима при любых размерах аденомы, что позволяет расценивать ее как эндоскопическую альтернативу открытой аденомэктомии и новым «золотым» стандартом хирургического лечения ДГПЖ.


