Введение. На сегодняшний день стандартом хирургического лечения инфравезикальной обструкции, вызванной доброкачественной гиперплазией предстательной железы (ДГПЖ), принято считать трансуретральную резекцию гиперплазии простаты (ТУРП) [1]. Однако при объемах предстательной железы более 100 см3 высокая частота рецидивов и осложнений как в ближайшем, так и отдаленном послеоперационном периодах не позволяет считать ТУРП методом выбора [2–4]. Так, частота рецидивов после ТУРП при размерах ДГПЖ более 100 см3 составляет более 30% в течение 5 лет после операции, что в 3 раза выше, чем при размерах аденоматозных узлов до 100 см3 [5].
 В последние годы при оперативном лечении гиперплазии простаты средних и крупных размеров стали набирать популярность не резекционные, а энуклеирующие методы. По данным многочисленных международных исследований, а также по опыту нашей клиники, наиболее популярной, а также высокоэффективной и безопасной методикой остается HoLEP ДГПЖ [2–6]. Однако у данного метода есть два серьезных недостатка: высокая стоимость оборудования, а именно высокомощного гольмиевого лазера и лазерных волокон, мешающая ее повсеместному распространению, и необходимость удаления энуклеированной аденоматозной ткани из мочевого пузыря с помощью морцеллятора, что также усложняет операцию и повышает ее стоимость. Все эти недостатки характерны для трансуретральной энуклеации ДГПЖ с помощью тулиевого лазера (Thu-Yag). При выполнении открытого вмешательства аденоматозные узлы удаляют путем пальцевой диссекции вдоль хирургической капсулы, что обеспечивает радикальность операции и значительное снижение риска «ложного» рецидива заболевания. Одной из малоинвазивных альтернатив открытой аденомэктомии является лапароскопическая, при которой удаленную аденому предстательной железы извлекают через переднюю брюшную стенку при помощи лапароскопической техники. При этом радикальность данных операций практически одинакова [7].
В последние годы при оперативном лечении гиперплазии простаты средних и крупных размеров стали набирать популярность не резекционные, а энуклеирующие методы. По данным многочисленных международных исследований, а также по опыту нашей клиники, наиболее популярной, а также высокоэффективной и безопасной методикой остается HoLEP ДГПЖ [2–6]. Однако у данного метода есть два серьезных недостатка: высокая стоимость оборудования, а именно высокомощного гольмиевого лазера и лазерных волокон, мешающая ее повсеместному распространению, и необходимость удаления энуклеированной аденоматозной ткани из мочевого пузыря с помощью морцеллятора, что также усложняет операцию и повышает ее стоимость. Все эти недостатки характерны для трансуретральной энуклеации ДГПЖ с помощью тулиевого лазера (Thu-Yag). При выполнении открытого вмешательства аденоматозные узлы удаляют путем пальцевой диссекции вдоль хирургической капсулы, что обеспечивает радикальность операции и значительное снижение риска «ложного» рецидива заболевания. Одной из малоинвазивных альтернатив открытой аденомэктомии является лапароскопическая, при которой удаленную аденому предстательной железы извлекают через переднюю брюшную стенку при помощи лапароскопической техники. При этом радикальность данных операций практически одинакова [7].
Возможность проведения трансуретральной энуклеации с помощью стандартного оборудования для ТУРП долгое время считалась заманчивой, но невозможной перспективой. Появление специальных петель для выполнения би- и монополярной электроэнуклеаций с помощью стандартного оборудования для ТУРП открыло новые возможности в лечении пациентов с ДГПЖ – монополярной электроэнуклеации ДГПЖ [8–10]. В настоящей работе представлен наш первый опыт применения данной методики.
Материалы и методы. В период с декабря 2014 г. по текущее время на базе клиники урологии Первого МГМУ им. И. М. Сеченова 35 пациентам (средний возраст – 65,92±8,81 года) с доказанной инфравезикальной обструкцией, вызванной ДГПЖ, выполнена монополярная энуклеация гиперплазии предстательной железы (основная группа). С учетом предшествующего опыта лазерной энуклеации, эффективной при «зрелой» ДГПЖ, мы отбирали больных с размером узлов гиперплазии более 50 см3. Мы сознательно не включали в исследование пациентов с размером узлов гиперплазии более 120 см3, считая это нецелесообразным на этапах освоения метода.
Показанием к операции для всех пациентов была неэффективность предшествующей консервативной терапии ДГПЖ.
На этапе включения в исследование всем больным было проведено комплексное обследование, включившее пальцевое ректальное исследование, общеклинические анализы крови и мочи, анализ крови на простатспецифический антиген, анализ секрета простаты, УЗИ для оценки состояния мочевых путей, урофлоуметрию с определением максимальной и средней скорости мочеиспускания, а также оценку жалоб и качества жизни по шкалам I-PSS и QoL соответственно. Для исключения рака предстательной железы перед операцией по медицинским показаниям пациентам выполнена трансректальная биопсия простаты под УЗ-контролем.
С целью оценки эффективности и безопасности данного метода в те же сроки была набрана контрольная группа из 35 пациентов (средний возраст – 65,4±7,01 года), сопоставимая по основным показателям, которым была выполнена лазерная энуклеация гиперплазии простаты. Этим больным в предоперационном периоде выполнено аналогичное комплексное клинико-лабораторное обследование.
Критерий исключения из исследования: наличие в анамнезе оперативных вмешательств на органах малого таза. Результаты предоперационного обследования пациентов обеих групп представлены в табл. 1.

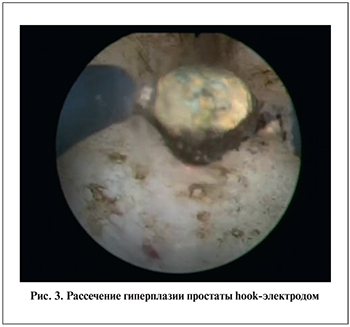
Операции по монополярной энуклеации гиперплазии простаты выполнены одной операционной бригадой, по лазерной энуклеации – другой операционной бригадой, имеющей большой опыт таких операций. Оба вида операций выполнены в условиях эндоскопической операционной с использованием аппаратуры и инструментов для стандартной ТУРП (рис. 1). Во всех случаях использован резектоскоп фирмы «Karl Storz» (Германия) размером 26 Сh с постоянной ирригацией. Для энуклеации первое время применяли электрод-толкатель (рис. 2), который по мере освоения данной методики был заменен ввиду лучшей визуализации интраоперационной картины на hook-электрод фирмы COOK (рис. 3), применяемый для маркировки и рассечения слизистой между наружным сфинктером и предстательной железой, а также стандартный набор для монополярной ТУРП, а именно: резекционную петлю, валиковый коагуляционный электрод и шприц Ренне–Александера.
 При проведении сравнительного исследования учтены следующие данные: продолжительность операции, «сухой» остаток, изменения в показателях плазмы крови (концентрация гемоглобина, натрия), время ирригации и длительность дренирования мочевого пузыря в послеоперационном периоде, частота развития послеоперационных осложнений (тампонада мочевого пузыря, необходимость гемотрансфузии, задержка мочеиспускания и недержание мочи, количество повторных операций по поводу послеоперационного кровотечения).
При проведении сравнительного исследования учтены следующие данные: продолжительность операции, «сухой» остаток, изменения в показателях плазмы крови (концентрация гемоглобина, натрия), время ирригации и длительность дренирования мочевого пузыря в послеоперационном периоде, частота развития послеоперационных осложнений (тампонада мочевого пузыря, необходимость гемотрансфузии, задержка мочеиспускания и недержание мочи, количество повторных операций по поводу послеоперационного кровотечения).
Техника трансуретральной монополярной энуклеации гиперплазии простаты. В самом начале операции выполняют диагностическую уретроцистоскопию, во время которой оценивают проходимость уретры, осматривают наружный сфинктер мочевого пузыря, уточняют размер и расположение узлов гиперплазии, визуализируют устья мочеточников и их дистанцию от шейки мочевого пузыря, оценивают слизистую мочевого пузыря. Далее hook-электродом производят рассечение слизистой на 5 и 7 часах условного циферблата от шейки мочевого пузыря до семенного бугорка и циркулярный разрез вдоль наружного сфинктера. Данный этап операции может быть выполнен стандартной петлей, однако, по нашему опыту, гораздо удобнее данную манипуляцию выполнять именно hook-электродом. Главное на этом этапе операции – достичь ложной капсулы простаты, имеющей белесоватую глянцевую поверхность. Ложная капсула представлена несколькими листками фиброзной ткани с наличием интерстициальной ткани между ними и располагается на границе аденомы и предстательной железы. При выполнении открытой аденомэктомии «ложную» капсулу разделяют на два слоя методом тупой диссекции, при этом один слой будет покрывать удаленную аденому, другой – оставшуюся периферическую часть. Для правильного выполнения последующей энуклеации очень важно попасть «в слой», т.е. обнажить именно эту зону.
 Следующие этапы операции зависят от размеров и расположения ДГПЖ, предпочтения и опыта оперирующего хирурга. Если размер аденомы большой, имеется выраженная средняя доля, целесообразно отделение ее долей, следуя стандартной технике гольмиевой энуклеации, что в значительной мере будет способствовать интраоперационной ориентации. Для оптимального отделения с помощью hook-электрода на 5 и 7 часах условного циферблата делают продольные борозды от шейки мочевого пузыря до циркулярной маркировочной линии дистальнее семенного бугорка. Далее выполняют энуклеацию средней доли с помощью электрода-толкателя или hook-электродом, помогая себе при этом тубусом резектоскопа. По мере освоения данной методики мы пришли к выводу: энуклеацию долей аденомы предстательной железы удобнее выполнять hook-электродом, помогая себе тубусом резектоскопа, ввиду того, что электрод-толкатель из-за своих больших размеров зачастую мешает визуализации интраоперационной картины. Перед вылущиванием боковых долей можно их дополнительно рассечь на 12 часах условного циферблата. Впоследствии электродом-толкателем или hook-электродом, помогая себе при этом тубусом резектоскопа, вылущивают боковые доли, которые, так же как и среднюю, либо полностью смещают в мочевой пузырь для последующей морцелляции, либо оставляют фиксированными к шейке мочевого пузыря, и данные флотирующие фрагменты ткани разрезают с помощью резекционной петли и отмывают с помощью шприца Рене–Александера. Обращаем внимание на то, что осуществлять резекцию флотирующих тканей, фиксированных к шейке мочевого пузыря с помощью небольшого тканевого мостика, – довольно непростая и опасная задача даже для опытного уролога ввиду затрудненной ориентации, практически полного отсутствия опоры у тканей; при их резекции возможна и дополнительная травматизация шейки и стенок мочевого пузыря. Нередко крупные фрагменты смещаются в мочевой пузырь и в дальнейшем их довольно непросто удалить ввиду отсутствия точки опоры.
Следующие этапы операции зависят от размеров и расположения ДГПЖ, предпочтения и опыта оперирующего хирурга. Если размер аденомы большой, имеется выраженная средняя доля, целесообразно отделение ее долей, следуя стандартной технике гольмиевой энуклеации, что в значительной мере будет способствовать интраоперационной ориентации. Для оптимального отделения с помощью hook-электрода на 5 и 7 часах условного циферблата делают продольные борозды от шейки мочевого пузыря до циркулярной маркировочной линии дистальнее семенного бугорка. Далее выполняют энуклеацию средней доли с помощью электрода-толкателя или hook-электродом, помогая себе при этом тубусом резектоскопа. По мере освоения данной методики мы пришли к выводу: энуклеацию долей аденомы предстательной железы удобнее выполнять hook-электродом, помогая себе тубусом резектоскопа, ввиду того, что электрод-толкатель из-за своих больших размеров зачастую мешает визуализации интраоперационной картины. Перед вылущиванием боковых долей можно их дополнительно рассечь на 12 часах условного циферблата. Впоследствии электродом-толкателем или hook-электродом, помогая себе при этом тубусом резектоскопа, вылущивают боковые доли, которые, так же как и среднюю, либо полностью смещают в мочевой пузырь для последующей морцелляции, либо оставляют фиксированными к шейке мочевого пузыря, и данные флотирующие фрагменты ткани разрезают с помощью резекционной петли и отмывают с помощью шприца Рене–Александера. Обращаем внимание на то, что осуществлять резекцию флотирующих тканей, фиксированных к шейке мочевого пузыря с помощью небольшого тканевого мостика, – довольно непростая и опасная задача даже для опытного уролога ввиду затрудненной ориентации, практически полного отсутствия опоры у тканей; при их резекции возможна и дополнительная травматизация шейки и стенок мочевого пузыря. Нередко крупные фрагменты смещаются в мочевой пузырь и в дальнейшем их довольно непросто удалить ввиду отсутствия точки опоры.
Непосредственно энуклеацию выполняют с помощью монополярного электрода-толкателя или hook-электрода и тубуса резектоскопа. Если «слой» идентифицирован правильно, аденоматозные ткани достаточно легко механически смещаются вдоль ложной капсулы предстательной железы в сторону мочевого пузыря. Электрохирургия применяется лишь для коагуляции кровоточащих сосудов и рассечения спаек (blunt enucleation).
Смещенные в мочевой пузырь узлы гиперплазии подвергают морцелляции, или резецированные на мелкие кусочки в области шейки мочевого пузыря отмывают с помощью шприца Рене–Александера. Однако стоит отметить, что для желез объемом больше 90 см3 применение морцеллятора для эвакуации удаленной ткани более эффективно, так как урологи, имеющие опыт энуклеирующих методик, могут выполнять энуклеацию единым блоком, без разделяющих борозд, что хоть и является технически более сложным, но существенно сокращает время операции. Операцию завершают дренированием мочевого пузыря трехходовым уретральным катетером (для постоянной ирригации мочевого пузыря; см. рис. 4). При окрашивании промывных вод кровью используют натяжение уретрального катетера, назначают гемостатическую терапию. Сроки дренирования мочевого пузыря зависят от непосредственной интраоперационной картины, однако в большинстве случаев составляют 2–3 дня.

По завершении стационарного лечения спустя 1 мес в амбулаторных условиях проведено контрольное обследование для оценки полученных результатов.
Результаты обследования и лечения подвергнуты статистической обработке с определением стандартного отклонения.
Результаты. Основные показатели интра- и послеоперационного периодов в обеих группах приведены в табл. 2. Результаты обследования по прошествии 1 мес после операции представлены в табл. 3.
В табл. 4 приведены интраоперационные осложнения, отмеченные при выполнении операций в обеих группах пациентов.
В целом частота осложнений в обеих группах была невысокой. Одному пациенту, которому была выполнена монополярная энуклеация, понадобилось проведение гемотрансфузии, однако ее необходимость скорее обусловлена отягощенным соматическим фоном и постоянным приемом антикоагулянтов по витальным показаниям. Тому же пациенту в экстренном порядке были выполнены уретроцистоскопия, отмывание тампонады мочевого пузыря, ревизия ложа удаленной гиперплазии простаты. В другом клиническом наблюдении случайной находкой были стриктуры уретры, потребовавшие увеличения объема оперативного вмешательства в размере оптической эндоуретротомии. Также в основной группе в 1-м наблюдении отмечено недержание мочи по стрессовому типу, что может быть связано с повреждением вентральной части наружного сфинктера во время энуклеации боковых долей гиперплазии простаты. Спустя 4 мес мочеиспускание было восстановлено консервативной терапией. В контрольной группе зафиксированы один случай острого простатита и два кровотечения с последующей тампонадой мочевого пузыря, потребовавших повторной операции в отдаленном послеоперационном периоде.
Обсуждение. Данные многочисленных исследований доказывают, что отдаленные результаты ТУРП, особенно при больших размерах ДГПЖ, уступают результатам открытой аденомэктомии в отношении частоты развития «ложных» рецидивов заболевания [1, 11]. Эти различия связаны с тем, что при ТУРП не всегда удаляются все аденоматозные ткани, а зачастую создается лишь широкий канал для адекватной эвакуации мочи при мочеиспускании [1, 2, 10, 12]. Периферические, а также вентральные и апикальные ткани аденомы зачастую не удаляются, при этом, чем больше объем гиперплазии простаты, тем больше ткани остается неудаленной.
Все большую популярность на сегодняшний день приобретают трансуретральные энуклеирующие методики. Для их выполнения используют различные моно- и биполярные резекционные петли, вапортроды различных конструкций, лазеры. Среди всех этих методов хирургического лечения наиболее распространенной считается трансуретральная энуклеация с помощью гольмиевого лазера (HoLEP), которая с 1998 г. стала активно внедряться в клиническую практику благодаря работам зарубежных авторов и развитию морцелляции энуклеированных тканей с 2003 г. [2–6]. Однако данная методика, по нашему мнению, а также, согласно данным А.Г. Мартова и соавт. [13], имеет один существенный недостаток, а именно высокую стоимость оборудования, что может помешать ее повсеместному распространению [6]. Кроме того, к особенностям операции относится высокая кривая обучения. Необходимо выполнить минимум 50 операций, чтобы освоить данную методику. При этом урологи, освоившие технику стандартной трансуретральной резекции ДГПЖ и имеющие опыт выполнения данных операций, также нуждаются в освоении техники лазерной энуклеации. И лишь опытные урологи, выполняя энуклеацию, точно следуют «слою», применяя лазер лишь для дополнительного рассечения и коагуляции тканей. Подтверждают вышесказанное основополагающие работы и мета-анализы, посвященные гольмиевой энуклеации [2–5].
Биполярная трансуретральная хирургия представляется еще одним перспективным методом лечения ДГПЖ. Использование биполярной энергии позволяет избегать рисков монополярного воздействия: «ТУР-синдрома», или синдрома водной интоксикации, ожогов и электроповреждений, также стоит отметить ее эффективное использование в лечении больных любыми электрокардиостимуляторами и токопроводящими металлоконструкциями. Кроме того, применение биполярной хирургии сводит к минимуму вероятность повреждения наружного сфинктера и ЭД.
Выводы. Стоит отметить, что в нашем исследовании объем простаты спустя месяц после операции был одинаков в обеих группах, что позволяет судить о высокой радикальности как монополярной энуклеации, так и HoLEP. Полученные нами первые результаты выполнения трансуретральной монополярной энуклеации гиперплазии простаты дают основание считать данный метод лечения радикальным, а также безопасным и экономичным. Дальнейшее наблюдение за прооперированными пациентами позволит нам сделать окончательный вывод о месте данной методики среди методов лечения больных ДГПЖ и стабильности полученных результатов.



