Введение. В настоящее время для лечения ДГПЖ применяются медикаментозная терапия, эндоскопические методы лечения (трансуретральная резекция аденомы предстательной железы) и открытая аденомэктомия [1–6]. Радикальным способом лечения пациентов с ДГПЖ остается аденомэктомия, позволяющая устранять инфравезикальную обструкцию и ирритативную симптоматику [7–12]. Однако в последние 25 лет в связи с появлением лекарственных препаратов для симптоматического лечения ДГПЖ многие пациенты стали отдавать предпочтение медикаментозной терапии, которая позволяет лишь уменьшать выраженность симптомов заболевания и откладывать радикальное хирургическое вмешательство на неопределенное время.
В литературе отсутствуют данные, позволяющие четко обосновывать возможность проведения длительной симптоматической терапии на основании функциональных и морфологических изменений мочевого пузыря.
Цель исследования: определить характер морфологических изменений в стенке мочевого пузыря у пациентов с ДГПЖ, находящихся на медикаментозной терапии, для обоснования допустимых сроков ее применения.

Материалы и методы. Под наблюдением находились 120 пациентов с ДГПЖ 2-й стадии в возрасте от 65 до 80 лет, которым была выполнена аденомэктомия; 110 пациентов – после медикаментозной терапии, продолжительность которой варьировалась от 1–6 мес до 10 лет. Пациенты принимали α-адреноблокаторы и ингибиторы 5α-редуктазы и их комбинацию.
Для подтверждения диагноза выполнены:
- обязательные методы исследования: анализ жалоб пациента по Международной системе оценки симптомов при заболеваниях предстательной железы (I-PSS) в баллах, анализ качества жизни QoL в баллах, физикальное обследование, пальцевое ректальное исследование предстательной железы и семенных пузырьков, общий анализ мочи, оценка функционального состояния почек по уровню сывороточного креатинина, определение уровня простатического специфического антигена в сыворотке крови;
- рекомендуемые методы исследования: урофлоуметрия, ультразвуковое определение объема остаточной мочи;
- факультативные методы исследования: трансабдоминальное УЗИ, трансректальное УЗИ, экскреторная урография.

Кроме того, использовали морфологический анализ стенки мочевого пузыря, полученный от 120 больных во время аденомэктомии. Фиксация материала осуществлена в 10%-ном нейтральном формалине по Лилли или жидкости Боуэна. Согласно общепринятой методике [13, 14], после соответствующей проводки по спиртам возрастающей концентрации следовала обработка в ксилоле и заливка в парафин. На микротоме Leica SM 2000R готовили парафиновые срезы толщиной 4–5 мкм. Полученные препараты окрашивали гематоксилином и эозином, по ван Гизону, а также использовали для иммуногистохимического исследования [15, 16] с помощью набора моноклональных антител (МКАТ), характеристика которых представлена в табл. 1.
 Связывание первых антител с клеточными и структурными элементами определено с помощью стандартного биотин-стрептавидин-пероксидазного метода (DAKO: LSAB®+System-HRP, код K0690) с диаминобензидином в качестве хромогена. Характер иммуногистохимических реакций оценивали с учетом интенсивности и процента окрашенных клеток [17].
Связывание первых антител с клеточными и структурными элементами определено с помощью стандартного биотин-стрептавидин-пероксидазного метода (DAKO: LSAB®+System-HRP, код K0690) с диаминобензидином в качестве хромогена. Характер иммуногистохимических реакций оценивали с учетом интенсивности и процента окрашенных клеток [17].
Для удобства оценки морфологических изменений в стенке мочевого пузыря все наблюдения были разделены на несколько групп (табл. 2).
Результаты. В табл. 3 представлены результаты обследования пациентов с ДГПЖ в зависимости от сроков проведения медикаментозного лечения.
Сравнительный анализ результатов обследования пациентов с ДГПЖ до операции показал, что в случае непродолжительной (не более 6 мес) медикаментозной терапии показатели, характеризующие урологический статус пациента с ДГПЖ, статистически значимо не отличались от показателей в контрольной группе. Наиболее выраженные изменения в показателях качества мочеиспускания и качества жизни имели место у пациентов с длительной медикаментозной терапией (от 6 до 10 лет), которые статистически значимо отличались от показателей в контрольной группе.
Одномоментная чреспузырная аденомэктомия с глухим швом мочевого пузыря и гемостазом съемными лигатурами выполнена всем 120 пациентам, 110 пациентам – в разные сроки после медикаментозной терапии. Контрольное обследование было проведено через 3 мес после операции (табл. 4).
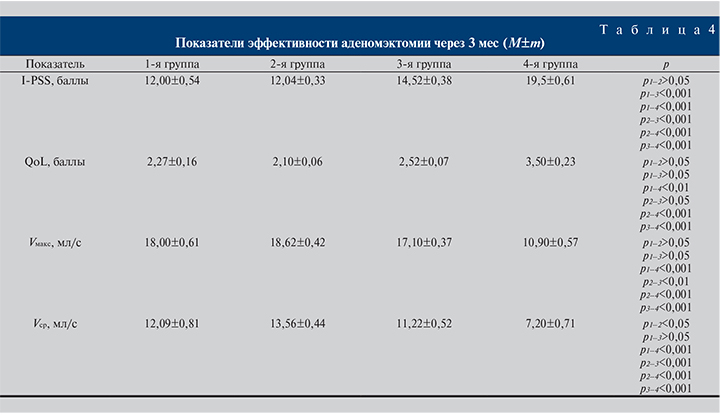
Сравнительная оценка состояния по шкалам I-PSS и QoL в послеоперационном периоде позволила установить, что чем короче был период медикаментозной терапии до аденомэктомии, тем менее выражены были изменения по шкалам: до 6 мес – I-PSS 12,04±0,33 балла, QoL 2,1±0,06; более 5 лет – 19,5±0,61 и 3,5±0,23 балла соответственно.
Сравнительный анализ результатов лечения ДГПЖ показал, что у пациентов первых двух групп, не получавших медикаментозную терапию или принимавших препараты от 1 до 6 мес, показатели скорости мочеиспускания (Vмакс, Vcр) в послеоперационном периоде были статистически значимо выше, чем у тех, кто принимал их от года до 5 лет. Существенно ниже были показатели пациентов 4-й группы (табл. 4).
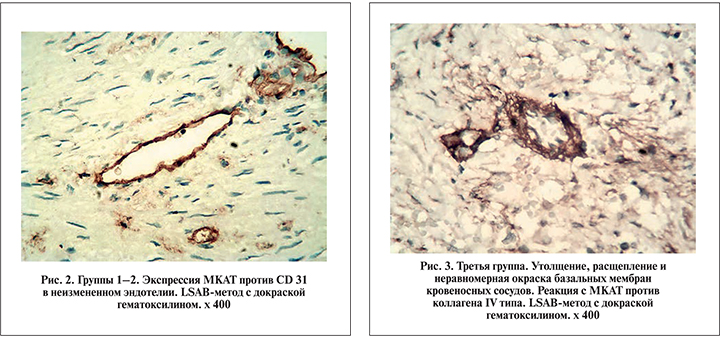
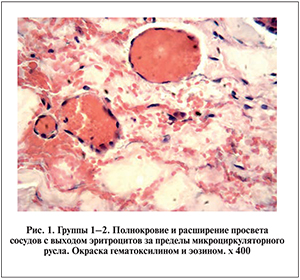
Морфологические исследования показали, что у пациентов, не использовавших препараты или принимавших их не более 6 мес, строение стенки мочевого пузыря было практически идентичным, что позволило нам объединить их в одну группу наблюдений (1–2). Так, в подавляющем большинстве случаев гистологически определялись неизмененные слизистая оболочка, подслизистая основа, мышечная и адвентициальная оболочки. Слизистая оболочка была представлена переходным эпителием и собственной пластинкой. Последняя была образована хорошо васкуляризированной рыхлой волокнистой неоформленной соединительной тканью. Иммуногистохимически в эпителиальном пласте выявлена равномерная экспрессия МКАТ против панцитокератинов, а в его базальной мембране – против коллагена IV типа. Кровеносные сосуды слизистой оболочки были резко полнокровны, просвет их расширен, отмечен выход отдельных эритроцитов за пределы микроциркуляторного русла (рис. 1). В то же время иммуногистохимический анализ показал нормальное строение эндотелиальной выстилки и базальных мембран, судя по экспрессии МКАТ против CD 31 и коллагена IV типа (рис. 2). Мышечная оболочка состояла из трех слоев гладкой мускулатуры, в которых иммуногистохимически выявлен десмин. Пучки гладкомышечных клеток были разделены тонкими прослойками соединительной ткани, дающими положительную реакцию с МКАТ против виментина. Иногда в мышечной оболочке имел место умеренный интерстициальный отек. Во многих наблюдениях данной группы в стенке мочевого пузыря обнаружены очаговые лимфогистиоцитарные инфильтраты.
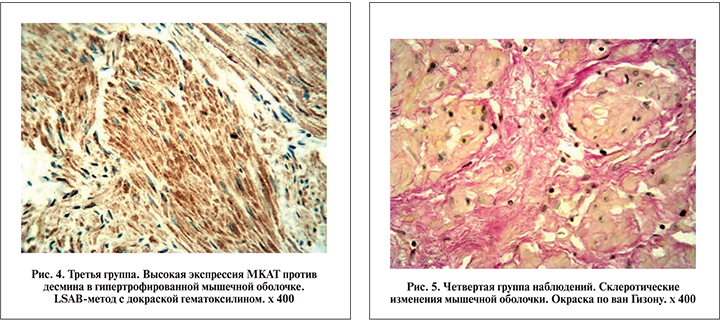
У пациентов 3-й группы выявлена гиперплазия переходного эпителия со значительным утолщением его пласта. Иммуногистохимически при этом определена неравномерная окраска МКАТ против панцитокератинов, а также расщепление и фрагментация базальной мембраны, судя по экспрессии МКАТ против коллагена IV типа. Имели место более выраженные микроциркуляторные расстройства: кроме полнокровия и расширения просвета сосудов встречались обширные кровоизлияния. При этом иммуногистохимически определены выраженные изменения сосудистых стенок. Реакция с МКАТ против CD 31 выявила набухание и десквамацию эндотелия с облитерацией просвета сосудов, а с МКАТ против коллагена IV типа – утолщение, расщепление и неравномерную окраску базальных мембран (рис. 3). Мышечная оболочка была значительно гипертрофирована с выраженной реакцией МКАТ против десмина в клетках (рис. 4). Экспрессия МКАТ против виментина в прослойках соединительной ткани по сравнению с 1-й группой при этом не менялась. Часто имел место выраженный интерстициальный отек с дискомплексацией мышечных пучков. Встречалась очаговая и диффузная лимфогистиоцитарная инфильтрация.
 В 4-й группе переходный эпителий в большинстве наблюдений был гипоплазирован с истончением эпителиальной выстилки. Иммуногистохимический анализ с использованием МКАТ против панцитокератинов и коллагена IV типа показал неравномерную окраску эпителиальных клеток, а также расщепление и фрагментацию базальной мембраны. Микроциркуляторные расстройства в виде расширения просвета сосудов, полнокровия и кровоизлияний отсутствовали. Как правило, определен склероз сосудистых стенок с высокой экспрессией в них МКАТ против виментина. Мышечная оболочка была подвержена атрофии с выраженными склеротическими процессами (рис. 5). Межмышечные прослойки соединительной ткани были значительно утолщены с увеличением здесь экспрессии МКАТ против виментина (рис. 6). Часто встречались участки склеролипоматозной трансформации стенки мочевого пузыря. В той или иной степени сохранялась лимфогистиоцитарная инфильтрация.
В 4-й группе переходный эпителий в большинстве наблюдений был гипоплазирован с истончением эпителиальной выстилки. Иммуногистохимический анализ с использованием МКАТ против панцитокератинов и коллагена IV типа показал неравномерную окраску эпителиальных клеток, а также расщепление и фрагментацию базальной мембраны. Микроциркуляторные расстройства в виде расширения просвета сосудов, полнокровия и кровоизлияний отсутствовали. Как правило, определен склероз сосудистых стенок с высокой экспрессией в них МКАТ против виментина. Мышечная оболочка была подвержена атрофии с выраженными склеротическими процессами (рис. 5). Межмышечные прослойки соединительной ткани были значительно утолщены с увеличением здесь экспрессии МКАТ против виментина (рис. 6). Часто встречались участки склеролипоматозной трансформации стенки мочевого пузыря. В той или иной степени сохранялась лимфогистиоцитарная инфильтрация.
Обсуждение. Таким образом, клинически установлено, что у пациентов, которым показано плановое хирургическое лечение по поводу ДГПЖ, симптоматическое медикаментозное лечение по длительности не должно превышать 6 мес, так как более длительная консервативная терапия ухудшает послеоперационные результаты. Это подтверждено данными морфологического исследования, согласно которым у пациентов, не использовавших препараты или принимавших их не более 6 мес, сохранялась нормальная гистологическая структура мочевого пузыря. Определялись только микроциркуляторные расстройства в виде полнокровия и расширения просвета сосудов без нарушения эндотелиальной выстилки и базальных мембран; умеренный интерстициальный отек мышечной оболочки и наличие в ряде наблюдений лимфогистиоцитарной инфильтрации. У пациентов с продолжительностью медикаментозной терапии от года до 5 лет микроциркуляторные расстройства усугублялись и характеризовались появлением обширных кровоизлияний, повреждением эндотелия и базальных мембран сосудов. Имела место гиперплазия переходного эпителия с утолщением его пласта. Особо обращала на себя внимание гипертрофия мышечной оболочки мочевого пузыря. Более выражена была и лимфогистиоцитарная инфильтрация.
В случае применения препаратов сроком от 5 до 10 лет микроциркуляторные расстройства завершались склерозом сосудистых стенок, их утолщением и сужением просвета. Переходный эпителий подвергался гипоплазии с истончением его пласта. Мышечная оболочка выглядела атрофированной. Здесь имели место выраженные склеротические процессы: между пучками мышечных волокон происходило разрастание соединительной ткани. Часто обнаруживались участки склеролипоматозной трансформации.
В работе приведены результаты морфологических исследований по изучению изменений в стенке мочевого пузыря на фоне длительной медикаментозной терапии. Исследования будут продолжены для уточнения роли различных факторов, влияющих на результаты хирургического лечения пациентов с ДГПЖ.
Выводы
- Результаты хирургического лечения пациентов с ДГПЖ находятся в прямой зависимости от состояния стенки мочевого и сроков медикаментозной терапии.
- Длительная медикаментозная терапия может способствовать появлению морфологических изменений в стенке мочевого пузыря – от незначительных микроциркуляторных расстройств до гипертрофически-гиперпластических изменений, а также атрофии и склероза.
- При наличии показаний к хирургическому лечению у пациентов с ДГПЖ и отказом пациента от проведения операции – аденомэктомии, медикаментозную терапию целесообразно проводить не более 6 мес с повторной консультацией.



