Введение. Во всем мире в структуре всех злокачественных онкологических заболеваний с частотой 2,4% почечно-клеточный рак (ПКР) занимает 12-е место. Ежегодно данная патология приводит к смерти около 140 тыс. пациентов [1]. Только в Российской Федерации с 2010 по 2014 г. зарегистрировано около 100 тыс. новых случаев. Ежегодный прирост заболеваемости составляет около 3–4% [2].
В связи с развитием и совершенствованием методов лучевой диагностики в последнее время ПКР все чаще выявляется на ранних стадиях, как правило Т1 [3–5]. В 50% случаев это является «случайной» находкой при УЗИ или мультиспиральной компьютерной томографии (МСКТ), магнитно-резонансной томографии (МРТ) [6]. Особенность опухолевого процесса в почке при стадии Т1–Т2 состоит в стертой клинической картине, зачастую имеет место бессимптомное течение [7].
На протяжении десятилетий «золотым» стандартом в лечении рака почки стадии Т1–Т2 считалась радикальная нефрэктомия. Однако в ходе проведенных в последнее время исследований установлено, что продолжительность жизни больных, подвергшихся органосохраняющему оперативному вмешательству при малых размерах опухоли (до 4 см), гораздо выше за счет снижения риска развития сердечно-сосудистых заболеваний [8, 9]. Понимание важности сохранения большего объема функционирующей почечной ткани, а также последующее появление минимально инвазивных методик лечения существенно сократили показания к полному удалению почки [10].
С момента первого сообщения Clayman в 1991 г. о применении лапароскопического доступа для лечения рака почки его стали широко использовать при хирургическом лечении данной категории больных [11]. В настоящее время все чаще проводятся высокотехнологичные оперативные пособия в объеме лапароскопических и робот-ассистированных операций.
Выбор в пользу минимально инвазивных лапароскопических и робот-ассистированных подходов при решении вопроса об органосберегающих операциях на почке обеспечивает скорейшее выздоровление пациентов и сокращение сроков госпитализации, при этом позволяя соблюдать принципы онкологической абластичности и эффективности [12].
В настоящее время помимо стандартных УЗИ, МСКТ и МРТ как методов предоперационного обследования широкое распространение получает 3D-моделирование – техника, позволяющая получать объемное, информативное изображение патологического процесса [13]. Данный метод существенно расширил границы применения лучевых методов исследования, хотя и он – всего лишь графическое представление той или иной области.
 Эволюция так называемых аддитивных методов производства способствовала внедрению в медицину 3D-печати – современной технологии, позволяющей на дооперационном этапе получать объемную модель органа.
Эволюция так называемых аддитивных методов производства способствовала внедрению в медицину 3D-печати – современной технологии, позволяющей на дооперационном этапе получать объемную модель органа.
Как известно, любой опухолевый процесс уникален. Местоположение, глубина и ориентация опухоли по отношению к чашечно-лоханочной системе (ЧЛС), артериям и венам широко вариабельны, поэтому неоспоримое достоинство 3D-печати – это возможность создания строго индивидуальных для каждого пациента 3D-моделей, являющихся точной копией срезов его двухмерного снимка, полученного с помощью лучевых методов исследования (МСКТ или МРТ).
Особенно интересен этот метод при опухолях почки стадии T1–T2, так как, согласно рекомендациям Американской и Европейской ассоциаций урологов, операцией выбора в подобных случаях является резекция почки [14, 15].
На сегодняшний день в мире исследований, посвященных применению 3D-печати, немного, а в России подобных исследований не проводилось.
Цель исследования: оценить возможность применения 3D-печати в урологии для лечения пациентов с локализованным раком почки.
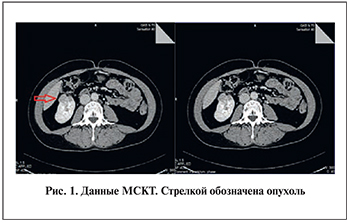
Материалы и методы. В исследование вошли 5 пациентов, у которых по результатам предоперационных лучевых исследований (УЗИ) были диагностированы новообразования почки. Эти больные находились на лечении в клинике урологии Первого МГМУ им. И. М. Сеченова с января 2016 по апрель 2017 г. На дооперационном этапе каждому пациенту была проведена МСКТ с контрастным усилением на аппарате Toshiba Aquilion One 640 (Япония; рис. 1). Положение пациента – лежа на спине. Параметры съемки: режим исследования спиральный, толщина среза – 0,5 мм, напряжение – 120 кВ, сила тока – 80 мА, скорость вращения трубки – 0,5 с, зона исследования: от купола диафрагмы до лобкового сочленения; внутривенное контрастирование: контрастный препарат «Ультравист-370» – 80–90 мл, скорость введения – 3,5–4 мл в 1 с. Получена информация обо всех четырех фазах исследования почек.
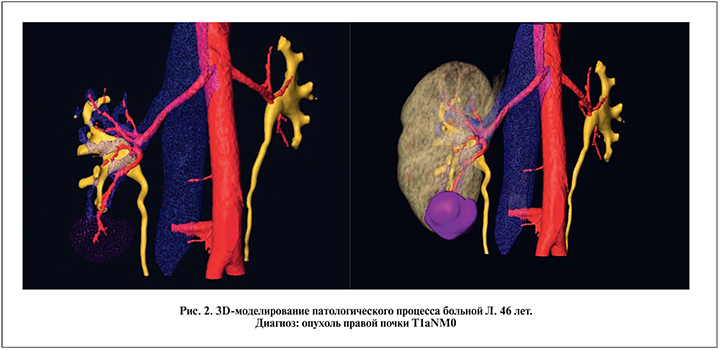
Следующий этап – получение виртуальных 3D-моделей (рис. 2). Для получения трехмерных объектов мы использовали программу Amira компании VSG версии 5.4.5 (лицензия ASTND.44644), которая обрабатывает данные МСКТ, полученные в формате DICOM (Digital Imaging and Communications in Medicine). Далее информация о моделях конвертируется в формат STL (stereolithography) и отправляется непосредственно на производство 3D-модели.
Процесс разработки и изготовления 3D-модели органа состоит из четырех основных этапов:
- Подготовка модели и вспомогательных изделий для 3D-печати.
- Нарезка и 3D-печать модели.
- Изготовление силиконовой формы для отливания модели.
- Заливка формы и постобработка.
Подготовка модели и вспомогательных изделий для 3D-печати
На данном этапе из первичной модели удаляются артефакты, сглаживается сетка полигонов, к требуемым местам добавляется толщина к стенкам модели, что обусловливается необходимостью печати FDM. Исправляются места перекрытия стенок сосудов друг другом. При необходимости модель разделяется на части для обеспечения возможности 3D-печати. Для фиксации моделей сосудистой и чашечно-лоханочной систем внутри заливаемой формы моделируется основание для их крепления. После всех операций моделируется форма для литья в силикон. Таким же образом создается модель штампа для изготовления опухоли. Обработка моделей производится в бесплатных программах Meshmixer (Autodesk, Inc., США) и Blender (Blender Foundation, Нидерланды, программное обеспечение с открытым исходным кодом).
 Нарезка и 3D-печать модели
Нарезка и 3D-печать модели
Готовые модели подготавливаются для 3D-печати по технологии FDM с помощью бесплатного программного обеспечения Cura с открытым исходным кодом. Печать осуществляется из пластика PLA на 3D-принтере с четырьмя соплами (три сопла принтера использовались для цветных пластиков и одно – для пластика поддержки). Выбор такой сложной схемы печати обусловлен сложностью самой модели, в которой сосудистая система (красная и синяя) и ЧЛС (желтая) взаимно пересекались друг с другом и разделить их для раздельной печати было невозможно. Общее время первичной печати всех элементов модели почки в зависимости от сложности модели может варьироваться от 10 до 20 ч (рис. 3).
Изготовление силиконовой формы для отливания модели
Силиконовая форма для финальной модели изготавливается в два этапа. На первом этапе напечатанная форма для литья помещается в контейнер и заливается наполовину силиконом. После отвердения силикона обрабатывается разделительной смазкой и силиконом заливается вторая половина. Сверху модели закладывается литник для заливки. После полимеризации силикона форма разбирается, внутрь помещается напечатанная модель сосудистой системы и ЧЛС, элемент ее удержания внутри формы. Таким же образом в форму помещается и фиксируется отлитая модель опухоли. В качестве силикона используется двухкомпонентный силикон Tool Decor-15, термостойкий, безусадочный литьевой силикон для форм на платине, твердость по Шору А:15 (мягкий).
Заливка формы и постобработка
В собранную форму с установленными моделями сосудистой и чашечно-лоханочной систем, а также окрашенной в контрастный цвет моделью опухоли заливается прозрачный состав, формирующий тело почки.
В зависимости от поставленной задачи тело почки может быть сформировано из прозрачного двухкомпонентного состава либо из термопластичного геля.
 Прозрачные двухкомпонентные составы (в основном силикон) более устойчивы к механическим, термическим и химическим воздействиям и наиболее удобны для изготовления макетов почек как для учебных целей, так и для предоперационной подготовки и информационного обеспечения в процессе операции.
Прозрачные двухкомпонентные составы (в основном силикон) более устойчивы к механическим, термическим и химическим воздействиям и наиболее удобны для изготовления макетов почек как для учебных целей, так и для предоперационной подготовки и информационного обеспечения в процессе операции.
Термопластичные прозрачные составы заливаются в форму в разогретом состоянии в жидкой фазе и затвердевают после остывания. Макеты почек, выполненные из прозрачных термопластичных составов (гелей), наиболее удобны для обучения и тренировок медицинского персонала перед операциями по удалению опухолей.
Общее время на изготовление первичной модели почки составляет 4 дня, последующие аналогичные повторные модели изготавливаются за 2 дня. Стоимость изготовления первой модели составляет 35 тыс. руб., последующих – 12 тыс. руб.
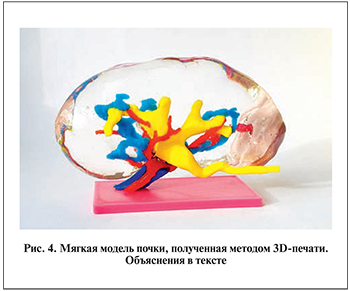
При создании моделей почки были использованы различные материалы для качественного визуального отличия внутренних структур почки. Помимо различных материалов каждая внутренняя структура имела свою определенную идентифицирующую окраску. Паренхима модели была произведена из полупрозрачного, эластичного, схожего по мягкости с нативной почкой термопластичного материала. Аналогичный материал использовался и для изготовления опухоли, однако для лучшей визуализации был применен темно-коричневый краситель. Чашечно-лоханочная система и сосуды изготовлены из более жесткого пластика PLA. Цветовой индикатор ЧЛС – желтый; сосудов, артерии и вены – красный и синий соответственно (рис. 4).
Следующим этапом исследования стали предоперационное планирование и тренинг. Для оценки эффективности полученных методом 3D-печати моделей в предоперационном планировании нами было проведено анкетирование.

В анкетировании участвовали пять оперирующих хирургов. Всем участникам для изучения была предложена информация о пяти пациентах, полученная с помощью компьютерной томографии. Вместе со снимками каждый участник получил 5 одинаковых анкет без указания данных пациентов. Анкеты содержали 4 основных вопроса предоперационного планирования (табл. 1). После заполнения первых анкет были предложены 3D-модели тех же пациентов и снова проведено анкетирование. Участники сравнили результаты, полученные с помощью лучевых методов исследования, с той информацией, которую предоставляет индивидуальная 3D-модель почки, после чего каждым из анкетируемых был проведен тренинг лапароскопической резекции почки (ЛРП) печатной модели почки в боксе.
Результаты
Результаты анкетирования
- Нефрэктомия или резекция. По результатам анкетирования 3 из 5 хирургов, принимавших участие в анкетировании, поменяли свой потенциальный подход к операции как минимум 1 раз.
- Открытый или лапароскопический вид оперативного вмешательства. Использование 3D-модели в ходе предоперационного планирования повлияло на решение двух врачей, которые предпочли лапароскопический доступ открытому.
- Лапароскопический или ретроперитонеоскопический доступ. По результатам анкетирования 4 хирурга изменили свое решение о виде доступа, использовав как инструмент предоперационного планирования 3D-модель почки.
- Способ временного гемостаза. Визуализация внутрипочечных сосудов, используемых в 3D-печатной модели почки, заставила изменить решение о способе временного гемостаза у всех участников анкетирования как минимум 1 раз (табл. 2).
Результаты предоперационного тренинга
С целью предоперационного тренинга мы использовали стандартный набор эндоскопических инструментов и тренажерный лапароскопический бокс.
Каждую 3D-модель почки помещали в бокс таким образом, чтобы отразить реальное топографо-анатомическое расположение в забрюшинном пространстве при планируемом хирургическом пособии.
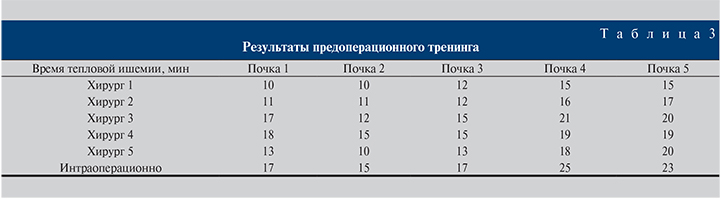
Время, потраченное на резекцию почки во время тренинга, и интраоперационное время тепловой ишемии представлены в табл. 3.
Следует учитывать, что время тепловой ишемии реального оперативного пособия соответствует времени, потраченному на резекцию и на момент восстановления почечной паренхимы.
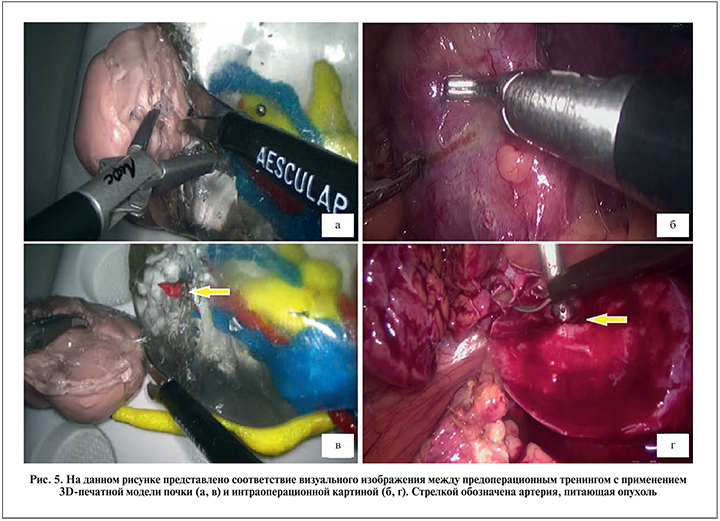
Проанализировав все пять наблюдений, мы пришли к выводу: использование 3D-печатных моделей почки для предоперационного тренинга оказалось эффективным. Во-первых, 3D-модели позволили лучше изучить патологическую анатомию опухоли почки. Во-вторых, высокое сходство 3D-моделей с настоящими почками способствовало улучшению хирургических навыков выполнения основного этапа резекции почки с опухолью (рис. 5). В-третьих, проведенные тренировки позволили хирургу, выполняющему операции, еще раз убедиться в правильности выбранной индивидуальной хирургической тактики лечения.
Результаты хирургических вмешательств
Все операции были выполнены из лапароскопического доступа одним хирургом с большим опытом проведения эндоскопических вмешательств. Среднее время оперативных пособий составило 187 мин. Все пособия проведены в условиях тепловой ишемии с перекрытием основной почечной артерии. Среднее время тепловой ишемии составило 19,5 мин, средний объем кровопотери – 170 мл. Конверсий в открытые пособия и органоуносящих вмешательств не было. Послеоперационных осложнений по классификации Clavien–Dindo и летальных исходов не наблюдалось. Ни в одном случае не возникло потребности в гемотрансфузии. Все хирургические края были отрицательными. В четырех наблюдениях морфологически верифицирован ПКР, в одном – онкоцитома.

Подробная информация о демографических, операционных и гистологических данных представлена в табл. 4.
Обсуждение. В нашем исследовании с помощью 3D-принтера создано 5 мягких печатных моделей почек с опухолью, индивидуальных для каждого пациента. В последующем мы оценили эффективность использования данных моделей в ходе предоперационного планирования.
За последние несколько лет были опубликованы аналогичные научные работы по использованию 3D-печати, однако они не были лишены определенных недостатков. Так, в 2014 г. J. Silberstein и соавт. опубликовали свое пилотное исследование по методике 3D-печати. Авторы одними из первых предложили использовать 3D-модель почки в ходе предоперационного планирования на больных раком почки [16]. По утверждению авторов, одним из главных недостатков напечатанной 3D-модели почки является использование в производстве твердых материалов, что делает невозможным предоперационный тренинг.
В исследовании [17] для предоперационной тренировки применяли мягкую 3D-печатную модель почки с опухолевым образованием. Использование мягких материалов, имитирующих почечную паренхиму, позволило выполнить предоперационный тренинг резекции почки с опухолью, однако в изготовленной модели отсутствовали элементы внутрипочечных структур. В то же время четкое понимание ангиоархитектоники, расположения опухоли по отношению к ЧЛС, детальное представление патологического процесса служат залогом успешного выполнения оперативного вмешательства.
Созданные нами 3D-модели анатомически точно воссоздали форму и структуру почки. Было отмечено практически идеальное соответствие размеров, рассчитанных при помощи компьютерных программ, таковым напечатанной 3D-модели почки. Все модели включали ЧЛС, почечные вены и артерии, а также опухолевые новообразования. Использование полупрозрачных материалов для создания моделей позволило визуализировать всю внутреннюю анатомию почки и патологическую анатомию объемного образования, тем самым обеспечивать получение наиболее полной информации о расположении опухоли, облегчив планирование хирургического вмешательства. Физические свойства материалов, используемых для изготовления 3D-моделей почек, были высоко оценены опытными хирургами нашей клиники. По мнению большинства оперирующих врачей, ощущения от эластичности и плотности модели были сопоставимыми с таковыми, возникающими интраоперационно. Использование модели, имитирующей реальную почечную ткань, обеспечивает врачу возможность приобрести необходимые тактильные навыки, а также проводить тренировки вне операционной.

По нашему мнению, одним из главных преимуществ, которым обладает наша 3D-печатная мягкая модель почки, является возможность ее многоразового использования для отработки навыков высокотехнологичных методов оперативного вмешательства. Дело в том, что используемый для изготовления модели материал при нагревании приобретает свойство пластичности, тем самым позволяя повторно, после тренировочной резекции опухоли, моделировать с помощью нагревания исходную конфигурацию почки. При этом число вновь смоделированных почек, соответствующих исходным параметрам, составляет не менее 5.
Среди недостатков нашего исследования необходимо отметить следующие. Во-первых, наше исследование носило пилотный характер и включало небольшое число пациентов. Ограниченная выборка пациентов не позволяет делать какие-либо окончательные выводы об эффективности применения данной технологии. В то же время полученные результаты служат основанием для дальнейших исследований в этой области.
Во-вторых, технические возможности современных 3D-принтеров не позволяют изготавливать индивидуальные модели в короткие сроки. Так, на изготовление одной 3D-модели почки было затрачено в среднем 96 ч. Данный недостаток пока существенно влияет на перспективу более массового применение методики 3D-печати в условиях медицинских учреждений.
В-третьих, на сегодняшний день отсутствует детальный расчет рентабельности применения 3D-печати в медицине. Экономический анализ – это одна из краеугольных составляющих при принятии решения о внедрении той или иной инновационной технологии в медицину.
Несмотря на определенные недостатки, технология 3D-печати все глубже проникает во все медицинские направления. Эволюция малоинвазивных методик в урологии должна сопровождаться точным предоперационным планированием и совершенствованием навыков хирургов. Как показало наше исследование, такую возможность предоставляют 3D-мягкие печатные модели.
Заключение. В настоящем исследовании продемонстрирована перспективность использования 3D-печати с целью предоперационного планирования и исполнения операций, позволяющего создать высокоточную трехмерную мягкую физическую модель с локализованным раком почки конкретно каждого пациента.



