Частота местнораспространенного колоректального рака с инвазией в органы мочевыделительной системы составляет 5% от всех случаев первичных опухолей данной локализации [1]. Количество публикаций, посвященных вовлечению почек при местнораспространенном или рецидивном раке толстой кишке, весьма ограниченно. При анализе данных в базах медицинской литературы PubMed и Cochrane library нами было выявлено описание лишь 19 случаев опухолевой инвазии почек при колоректальном раке [2–5].
Поражение почек при раке толстой кишки может оказаться причиной обструктивной уропатии. Развитие данного осложнения, обусловленного массивной инвазией в почечную паренхиму и парауретральные ткани, описано S. M. Greenfield [2]. Метастазы в почку с распространением на лоханку и развитием ее некроза представлены в работе A. J. Chippindale et al. [3]. Поражение почки может также носить двусторонний характер, но при этом обструктивная уропатия не развивается [4, 5].
Ввиду немногочисленности публикаций, посвященных описанию вовлечения почек при раке толстой кишки, представляем собственное клиническое наблюдение.
П а ц и е н т Р. 71 года обратился в ГНЦК им. А. Н. Рыжих в феврале 2018 г. с жалобами на запоры. Из анамнеза известно, что в 2011 г. в ГНЦК больному выполнена лапароскопически ассистируемая левосторонная гемиколэктомия с формированием трансверзосигмоидного анастомоза по поводу рака сигмовидной кишки pT3N0M0. Послеоперационный период протекал без осложнений. Больной был выписан на 7-й день после операции. Гистологическое исследование удаленного препарата показало, что опухоль имела строение умеренно дифференцированной аденокарциномы преимущественно криброзного строения. В 12 удаленных лимфатических узлах брыжейки метастазов выявлено не было. Больной находился под наблюдением районного онколога. Обследования проходил нерегулярно. В 2013-м и 2015 г. пациенту выполняли эндоскопическую полипэктомию из ободочной кишки.
При настоящем обращении комплексно обследован. При физикальном осмотре кожные покровы и видимые слизистые оболочки бледно-розовой окраски. Периферические лимфатические узлы не увеличены. В легких дыхание проводилось во все отделы – везикулярное; побочных дыхательных шумов выявлено не было. Частота дыхательных движений – 15 в 1 мин. При аускультации: тоны сердца ритмичные, приглушенные. Артериальное давление – 130/70 мм рт.ст., ЧСС – 68 в 1 мин. Живот не вздут, участвовал в акте дыхания равномерно. Послеоперационный рубец по средней линии без воспалительных изменений. При пальпации в левом мезогастрии нечетко определялось плотное, ограниченно подвижное болезненное опухолевидное образование до 5 см в диаметре. Печень пальпировалась у края реберной дуги. Симптом поколачивания отрицательный с обеих сторон. Дизурических явлений больной не отмечал. При осмотре в перианальной области расчесов мацераций не было. При пальцевом исследовании прямой кишки тонус сфинктера и волевые усилия были удовлетворительными. На 8 см от края ануса по передней полуокружности определен нижний полюс плотного ограниченно подвижного опухолевидного образования. В лабораторных анализах все показатели в пределах референсных значений. При колоноскопии от 01.02.2018 колоноскоп был проведен до купола слепой кишки. Зона анастомоза четко дифференцировалась на 22 см от края ануса по отметкам на колоноскопе, просвет кишки в этой области широкий, стенки эластичные, слизистая оболочка розовая. На 8 см от наружного края анального канала определен дистальный край экзофитной опухоли протяженностью до 4 см, занимавшей ¾ окружности кишечной стенки. При гистологическом исследовании биопсийного материала из образования в прямой кишке были выявлены фрагменты слизистой толстой кишки с очагами гиперплазии крипт, фиброзированием основы без признаков опухолевого роста.
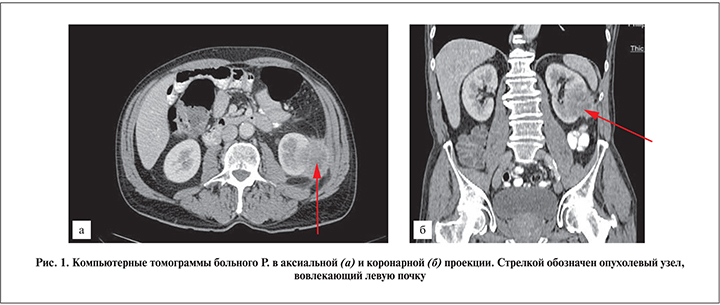
При КТ органов грудной клетки, брюшной полости и органов малого таза от 02.02.2018 в прямой кишке был выявлен опухолевый узел до 2,7 см в диаметре с преимущественно внекишечным расположением и вовлечением семенных пузырьков и поражением регионарных лимфатических узлов. Также в области нижнего полюса левой почки с его вовлечением расположено опухолевидное образование размером 6,3×4,7×5,1 см, распространяющееся на брюшину левого латерального канала, врастающее в левую косую мышцу живота (рис. 1). Однозначно высказаться о характере данного образования на дооперационном этапе было затруднительно. На основании проведенного обследования и приняв во внимание данные анамнеза заболевания, КТ, колоноскопии, гистологического исследования биопсийного материала, больному был установлен диагноз «метахронный карциноматоз с вовлечением почки и прямой кишки».
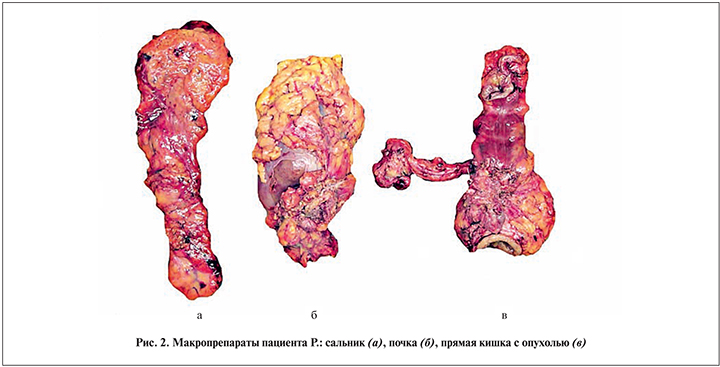
01.03.2018 пациент был прооперирован. В связи с выраженным спаечным процессом после предыдущей операции выполнен адгезиовисцеролизис. По передней поверхности нижнего полюса левой почки определялся плотный узел диаметром 4,4 см, прораставший в почку и боковую стенку живота. Второй узел размерами 3×3 см располагался в полости малого таза, прорастал в верхнеампулярный отдел прямой кишки, вовлекая семенные пузырьки с обеих сторон, семявыносящий проток справа и прилегал к правому мочеточнику в области его устья. Была проведена мобилизация оставшихся левых отделов ободочной кишки, поперечной ободочной кишки, левой почки. В связи с тем что не представлялось возможным исключить инвазию опухолевого узла в левую почку, было решено выполнить не ее резекцию, а нефрэктомию. Осуществлена мобилизация прямой кишки до нижнеампулярного отдела вместе с опухолевым узлом и вовлеченными с обеих сторон семенными пузырьками, правым семявыносящим протоком. В процессе мобилизации в связи с прилежанием опухолевого узла к правой стенке таза проведена перевязка внутренней подвздошной артерии в месте отхождения от общей подвздошной артерии. Ободочная кишка была пересечена проксимальнее ранее сформированного трансверзосигмоидного анастомоза на 1 см, прямая – на уровне среднеампулярного отдела, на 5 см дистальнее нижнего полюса опухоли. После этого макропрепарат единым блоком удален из брюшной полости. В левой мезогастральной области сформирована одноствольная трансверзостома. Таким образом, больному была выполнена комбинированная ререзекция левых отделов ободочной кишки, прямой кишки по Гартману, резекция семявыносящих протоков и двусторонняя везикулэктомия, нефроуретерэктомия слева с резекцией боковой стенки живота, одноствольная трансверзостомия (рис. 2, 3).
 Операция завершена внутрибрюшинным введением митомицина С в дозе 20 мг на 1 м² площади поверхности тела пациента.
Операция завершена внутрибрюшинным введением митомицина С в дозе 20 мг на 1 м² площади поверхности тела пациента.
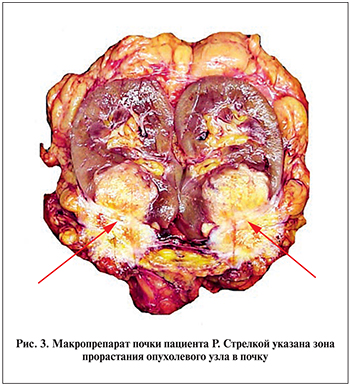
Гистологическое исследование удаленного препарата показало, что в прямой кишке имелась метахронная опухоль, имеющая строение умеренно дифференцированной аденокарциномы с глубоким изъязвлением, очагами некроза, периваскулярным и периневральным ростом с врастанием в брюшину, семенные пузырьки и окружающую их клетчатку, обрастанием семявыносящего протока с очаговым врастанием в его стенку. В 3 параректальных из 19 исследованных лимфатических узлах определены метастазы аденокарциномы с полным замещением лимфоидной ткани, очагами инвазии опухоли за капсулу узлов. Узел, вовлекший почку, расположен в основном экстраренально, был представлен опухолевой тканью аналогичного строения опухоли прямой кишки с врастанием в капсулу и паренхиму нижнего полюса почки и наличием опухолевых эмболов в ее сосудах. Сосуды ворот почки и мочеточник были интактными. Также определено врастание опухолевого узла в резецированные участки скелетных мышц передней брюшной стенки с инвазией сосудов.
Послеоперационный период протекал без осложнений.
В удовлетворительном состоянии на 12-й день пациент был выписан под наблюдение онколога по месту жительства. С учетом анамнеза заболевания, данных проведенного обследования и лечения пациенту показано проведение химиотерапии по схемам на основе оксалиплатина и фторпиримидинов.
Обсуждение. При любом образовании в почке при колоректальном раке необходимо проводить дифференциальный диагноз между первичным раком почки и ее вторичным поражением. В большинстве случаев метастазы колоректального рака в почки бессимптомны и обнаруживаются при контрольном обследовании. По данным аутопсийных исследований 11 328 трупов, метастазы в почки при раке толстой кишки были выявлены в 2,8% случаев, при этом частота изолированного поражения почек неизвестна [6]. Неизученным также является вопрос патогенеза поражения почек при колоректальном раке. Одни авторы считают, что это происходит путем гематогенной диссеминации, в то время как другие – имплантационным путем [7]. Исследователи полагают, что периренальные фасция Героты и брюшина играют важную роль в процессе диссеминации опухоли, в связи с чем восстановление их структуры по окончании операции остается необходимым этапом [9]. В работе авторов, выполнявших операции на экспериментальных животных, продемонстрировано, что восстановление брюшины после операции и сохранение почечной фасции снижают вероятность диссеминации опухоли [8, 9]. Кроме того, показано, что дефекты в брюшине могут играть важную роль при имплантационном метастазировании опухолей [10].
Обсуждая настоящее клиническое наблюдение, также необходимо рассмотреть два возможных механизма образования метастаза в левом мезогастрии, вовлекшего левую почку и боковую стенку живота: имплантационное и гематогенное метастазирование. В пользу гематогенного пути метастазирования свидетельствуют следующие аргументы: метастатическое поражение органа забрюшинного пространства и солитарный характер поражения. В то же время необходимо отметить, что пациенту во время первой операции выполнялась мобилизация левых отделов ободочной кишки с рассечением брюшины левого латерального канала. Это в совокупности со сниженной массой тела (индекс массы тела – 20 кг/м2) и небольшой толщиной жировой капсулы почки, расположением опухолевого узла, по данным интраоперационной ревизии, вне почки с вовлечением мышц боковой стенки живота не позволяет однозначно высказаться в пользу гематогенного пути метастазирования, полностью исключив имплантационный. Помимо этого до получения результатов патоморфологического исследования опухолевый узел в полости малого таза, расположенный преимущественно внекишечно, расценивался как карциноматозный с вторичным вовлечением прямой кишки, семенных пузырьков и семенных протоков, что с учетом данных анамнеза заставляет думать о возможности метахронного карциноматоза. Об имплантационном пути образования метастаза свидетельствовало интраабдоминальное, преимущественно экстраренальное, расположение опухолевого узла. Отсутствие у больного других отдаленных внебрюшинных метастазов при наличии метастаза в почку маловероятно и скорее всего также говорит в пользу его возникновения имплантационным путем. Только патоморфологическое исследование удаленного препарата позволило установить, что опухолевый узел в тазу является не карциноматозным, а метахронным раком прямой кишки. Генез опухолевого узла, вовлекшего почку и боковую стенку живота, достоверно определить не представляется возможным. Констатируя факт, что он является метастазом, четко установить путь метастазирования не получилось. Таким образом, абсолютных признаков, позволяющих дифференцировать гематогенный и имплантационный метастазы, в данной клинической ситуации нет.
В связи с этим ввиду невозможности исключить перитонеальный карциноматоз нами интраоперационно была проведена внутрибрюшная химиотерапия митомицином С с целью воздействия на микроскопические проявления заболевания после удаления метахронной опухоли прямой кишки и опухолевого узла вместе с вовлеченной почкой и резекции боковой стенки живота. После выписки из стационара больному назначена химиотерапия по схемам на основе оксалиплатина и фторпиримидинов.
Заключение. Поражение почки метастазами при колоректальном раке – довольно редкая в клинической практике ситуация. Практический врач должен быть осведомлен о такой возможности, ввиду того что лечебная тактика при гематогенном метастазировании и карциноматозе различна. Проведение внутрибрюшной химиотерапии целесообразно в случае перитонеального карциноматоза.


